木质素降解真菌的筛选与鉴定
刘佳莉,成于恒
(1.河北环境工程学院河北省农业生态安全重点实验室,河北秦皇岛 066102;2.福建师范大学地理科学学院,福建福州 350007)
木质素是一类结构复杂而稳定的有机聚合物,它结实坚韧,不容易腐烂,同时赋予植物作为植物细胞壁形成中特别重要的刚性成分。木质素还是自然界仅次于纤维的第二大可再生生物资源,全球年产量可达1500亿t[1]。
我国是一个农业大国,农产品的生产量在世界居于领先地位,每年会产生大量的农业废弃物——秸秆,但由于我国对秸秆的集中处理设施和技术规范还远没有到位,绝大多数都是以焚烧的形式处理,此种方法利用率低,同时还会排出大量的有害气体和烟尘,导致空气质量下降,造成了严重的空气污染,影响人体健康,不利于农业和环境的协调发展。木质素是秸秆的主要组成部分,它在自然环境中降解缓慢,所以寻找一种可以高效利用木质素的方法变得尤为迫切。
目前,常用于降解木质素的方法有物理法、化学法、物理化学法、生物法,但是物理法、化学法、物理化学法都对反应条件比较苛刻,对设备要求高[2]。而通过微生物法来处理木质素,具有反应条件温和、低耗能的特点,所以生物降解法为我们提供了更具体更有效的选择,微生物当中能分解木质素的大多是真菌。20世纪80年代,科学家们先后从真菌的代谢产物中发现了漆酶、木质素过氧化物酶和锰过氧化物酶,这三种类酶都被证实对木质纤维具有降解作用[3-4]。本文通从秦皇岛海滨国家森林公园中的土壤中,筛选出具有高效降解木质素的真菌,然后对其酶活性进行测定,最后对影响产酶的条件进行探究。
1 材料与方法
1.1 试验土样
从秦皇岛海滨国家森林公园中选取三块10m×10m的样地,取样时刨除土层表面凋落物等杂质,使用五点取样法,用土钻采集5个深度约20cm的土芯,挑除细根,去除肉眼可见的作物残留物及石头等细小杂质,彻底混合形成一个均匀的混合样品放置于自封袋中,然后将样品放在装有冰袋的保温箱中,立即送往实验室进行后续处理分析。
1.2 菌株的筛选
称取10g土壤于锥形瓶中,加入90ml灭菌处理的蒸馏水,200rpm,30min,取10-3、10-4、10-5浓度悬液涂布于固体培养基上,挑取真菌菌落进行纯化。经过6轮纯化后,菌株放于4℃冰箱冷藏保存备用。
参考李灵灵等人的方法[5]挑取在PDA固体培养基上培养3d后经纯化菌株的菌丝,接种到PDA-愈创木酚固体培养基上,置于28℃恒温培养箱内培养,观察其是否显现出红色;接种于苯胺蓝固体培养基上,置于28℃恒温培养箱内培养,观察有无透明圈出现。
1.3 酶活测定
将筛选出的真菌置于PDA固体培养基中28℃下培养5d后,制备菌块,接种于含有液体发酵产酶培养基[6]的100ml锥形瓶中,接种量3%,放于30℃,150rpm的水浴摇床中培养5d。提取发酵培养5d的产酶培养液置于灭菌处理后的离心管中。在28℃,4500rpm条件下离心15min,静置10min后的上层清澈液体为粗酶液。
漆酶(Lac)活性测定使用愈创木酚方法[7]。每1min催化1nmol/L愈创木酚的酶量为1个酶活,单位为U。
锰过氧化物酶(Mnp)活性测定反应体系为3ml,使用50mmol/L,pH=4.5的酒石酸-酒石酸钠缓冲液2ml,15mmol/L硫酸锰1ml,粗酶液0.4ml,在37℃加入0.1ml的10mmol/L H2O2溶液启动反应,测定在240nm处3min吸光度的变化[8-9]。
每种酶活测定做5次重复。
1.4 生长曲线的测定
将菌株用接种针接于液体培养基中培养12h后,吸取100μl菌液于新的液体培养基中,每2h在600nm波长下测定吸光度,并绘制生长曲线。
1.5 形态学鉴定
将菌株接种于PDA培养基上培养5d,观察菌落形态并在显微镜下观察菌丝,然后结合《真菌鉴定手册》区分真菌种类。
1.6 木质素降解率的测定
将菌株接种到200ml液体培养基中培养3d,然后从中吸取100μl菌液接于木质素降解液体培养基中。每两天吸取5ml液态培养物并离心(7500rpm/min,5min),将稀释10倍后的上层清液置于275nm波长下,测定其OD值。同一菌株做三个重复。
1.7 初始pH值对酶活性的影响
设置液体培养基初始pH值为3.0、3.5、4.0、4.5、5.0五组,于30℃,150rpm恒温培养,每两天取一次样,4500rpm下离心15min,分别取不同pH值下的培养液上清液测定酶活。
1.8 数据分析
使用Excel 2016对菌株各项实验所得数据统计、计算并制作图表。使用SPSS 23.0对数据差异性进行Duncan分析。
2 实验结果与分析
2.1 愈创木酚显色和苯胺蓝褪色
愈创木酚是一种木质素苯环单元特征类似物,能降解木质素的真菌会产生漆酶(Lac),漆酶可以使愈创木酚变为红色,若菌株可以分泌漆酶,则会在PDA-愈创木酚平板上显现出红色显色圈,显色圈的大小可以衡量产酶量与活性。
但由于愈创木酚的特殊物理化学性质,使用愈创木酚培养基无法检出锰过氧化物酶(MnP)与木质素过氧化物酶(Lip)。而锰过氧化物酶(MnP)与木质素过氧化物酶(Lip)可以使偶氮染料苯胺蓝发生褪色,所以使用苯胺蓝平板可以检测出锰过氧化物酶和木质素过氧化物酶。褪色圈大小可以衡量两种酶的酶量与酶活力。
本实验共筛选出6株真菌,其中只有菌株X1具有产木质素降解酶能力。X1在PDA-愈创木酚平板(图1A)上显红色效果强烈;与未接种的苯胺蓝平板(图1C)对比,菌株X1在PDA-苯胺蓝平板上培养使蓝色全部褪色(图1B),说明菌株X1可以产生降解木质素的酶,且产酶效果好。

图1 愈创木酚显色和苯胺蓝褪色平板
2.2 酶活测定
将菌株X1接种于液体发酵培养基中培养5d,吸取菌液离心,取上层清澈液体测定三种酶的酶活力。测定结果表明Lac活力为38.4U/ml,MnP活力为104.9U/ml,如表1。

表1 菌株X1漆酶、锰过氧化物酶酶活
2.3 菌株生长曲线
由于培养液中的菌株量增加可以降低透光率、增加吸光值(OD值),所以我们以培养时间为横坐标,以培养液在600nm下的OD值为纵轴绘制图像,结果见图2,由于含菌量少,在6h前变化较缓,在6h之后生长速率加快,10h后趋于稳定不再增长,此时菌株数量达到最大值。
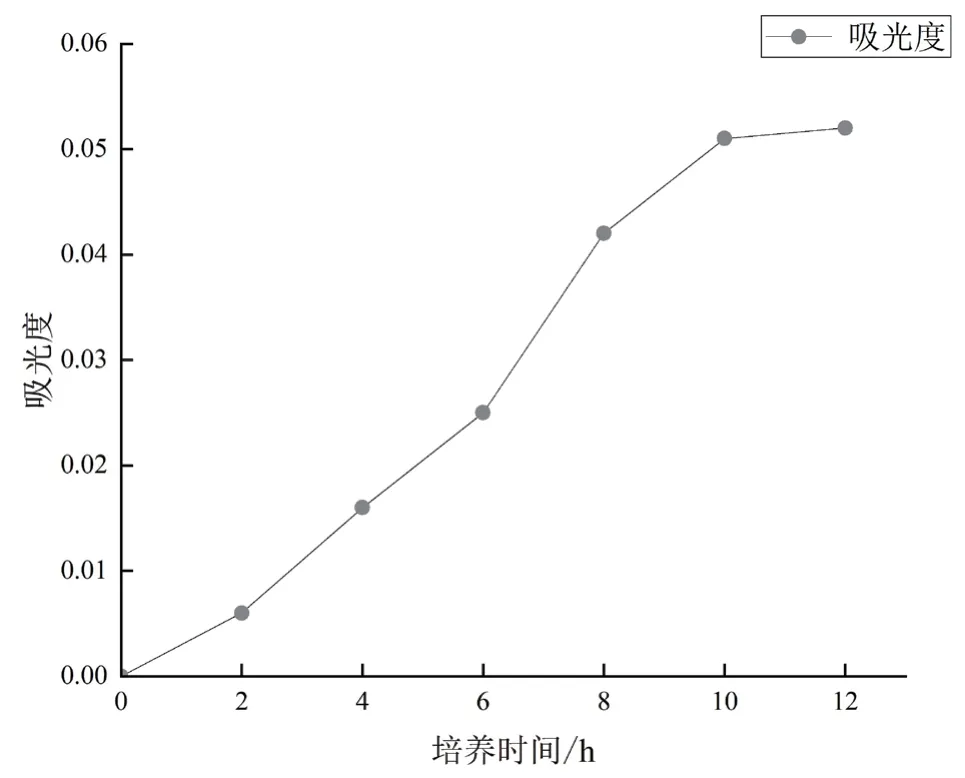
图2 菌株X1生长曲线
2.4 菌株形态学观察
将菌株点接种于PDA培养基上培养5d,X1的菌落外表为白色,呈平面扩散生长,形状为扁平圆形,菌落中心略微突出,菌丝易于挑取为短绒毛状,菌落干燥,底部与培养基的结合紧密,菌落边缘与培养基结合处较为坚硬。通过在显微镜下观察其菌丝,发现其为单菌丝,菌丝上有横隔,末端呈钝圆形(图3)。同时结合《真菌鉴定手册》判断其为半知菌亚门,丝孢纲,丝孢目,丛梗孢科,地霉属。
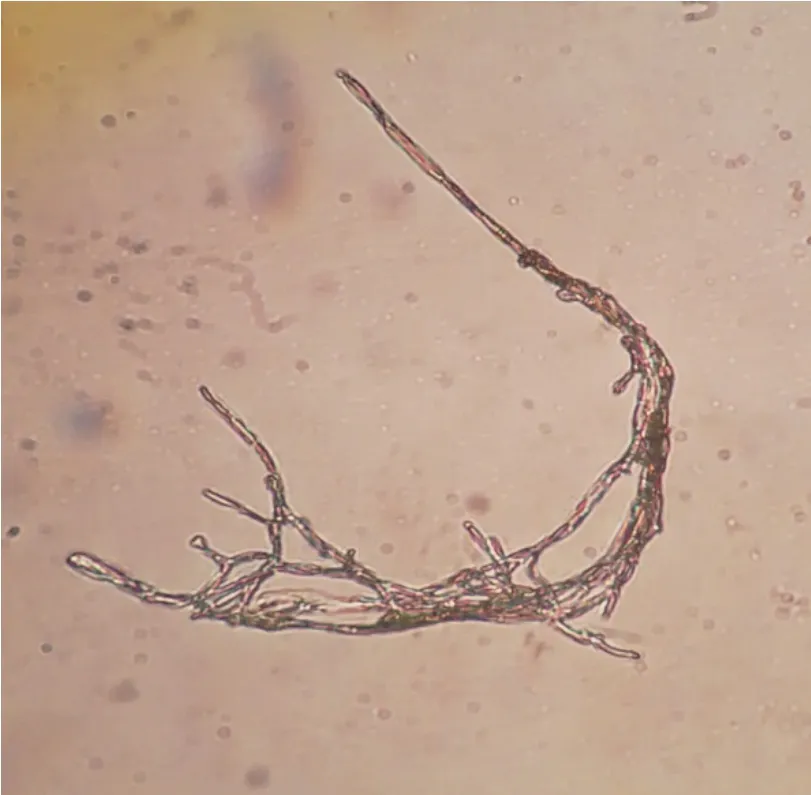
图3 菌株菌丝形态
2.5 菌株木质素降解率测定
通过对菌株X1木质素降解真菌解木质素量测定,发现在测定的前两天对于碱性木质素的降解率变化较小,可能由于菌株在前期生长缓慢且先利用培养基中的碳源和氮源,第三天开始降解木质素,第四天降解速率达到最高,第五天降解率达到峰值并基本维持峰值,菌株X1对于碱性木质素降解率为44.55%(图4)。
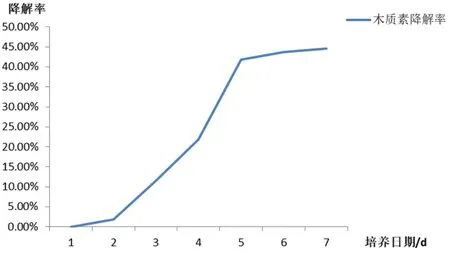
图4 木质素降解率
2.6 初始pH对漆酶、锰过氧化物酶活性的影响
在菌株生长前2d时,不同pH对于酶活力的影响并不算大,但在第2d之后显现出差异。当菌株在初始pH值为4.0,培养2d后漆酶活力迅速上升,直到培养6d时漆酶活力达到最大值45.6 U,之后由于含菌量达最大值,培养基内营养成分被消耗,菌株活力下降甚至死亡,酶活力降低(图5)。在初始pH值为4.0时,培养2d后锰过氧化物酶活力迅速上升,也在培第养6d时酶活力达到峰值为133.0 U,在pH值为4.5时酶活性在第6d接近峰值,但在前期和后期低于pH值为4.0的酶活,pH值处于3.0和3.5时,明显对酶活力产生抑制(图6)。真菌X1在pH为4.0的情况下生长发育最好,在培养第6d时,产酶性能最佳。
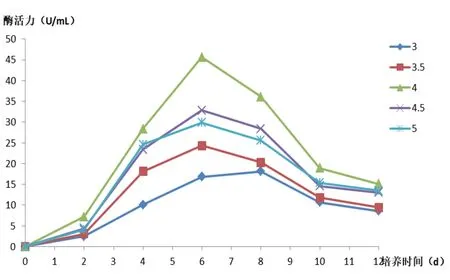
图5 初始pH对漆酶酶活影响
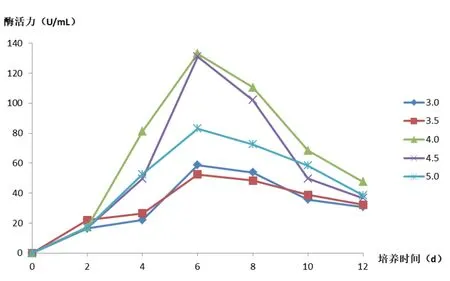
图6 初始pH对锰过氧化物酶酶活影响
3 结论与讨论
菌株X1可以产漆酶、锰过氧化物酶、木质素氧化酶等三种可以降解木质素的酶。当培养基pH为4时菌株的产酶能力最强,最佳产酶时间为第6天,与刘梁涛等人的结论一致,但漆酶活性低于刘梁涛的结论[10]。该菌株对于碱木质素的降解率随着时间的增加而增加,在培养7d后可达到44.55%,在第4d之后降解率趋于稳,该菌株对于碱木质素的降解率44.55%低于王福玲实验得到 的65.4%[11],高于乔乔报道的36.4%[12],降解效率适中。
本实验筛选出的真菌X1具有木质素降解能力,可以进一步应用于化工生产领域、环保领域、农林领域等,可为木质素的降解、利用和秸秆还田提供新的微生物材料。

