猪肉及制品中HEV、PEDV 和PDCoV 三重qPCR 方法的建立与应用
余姓鸿,张 婧,安 微,杨 苗,谢 礼,舒佳新,薛昌华,郑 巧,林 华,,韩国全,
(1.成都海关技术中心,四川成都 610041;2.四川农业大学食品学院,四川雅安 625014)
作为猪肉生产和消费大国,我国动物源性疾病对猪肉产量和价格造成不同程度的影响,给进出口贸易带来了巨大冲击。2018 年以来,在非洲猪瘟、戊型肝炎等以猪为宿主的病毒感染,以及新冠疫情的冲击下,我国2020 年第一季度猪肉产量下降29.1%,整年猪肉平均价格高达46.83 元/kg[1],给居民猪肉消费带来巨大压力。其次,戊型肝炎、冠状病毒等人兽共患病所引发的重大食源性疾病对动物源性食品安全乃至人类公共卫生安全产生了巨大威胁。2016 年,据估计,每年全世界有6 亿人(几乎每10 人中就有1 人)因食用受污染的食品而患病,并有42 万人死亡[2]。因此,在生鲜猪肉及其制品流通环节,建立快速准确的检测病毒方法,切断病毒传染源,对猪肉品质保障、动物源性疾病防控与食品安全检测具有现实意义。
戊型肝炎病毒(Hepatitis E virus,HEV)和冠状病毒(Coronaviruses,CoVs)为典型的人兽共患病病原,而猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)和猪δ冠状病毒(Porcine delta corona virus,PDCoV)为冠状病毒属,与猪的急性腹泻密切相关。根据基因组核苷酸序列差异,HEV 可被分为八种基因型(G1~G8),其中G3 和G4 为典型的人兽共患病病原[3]。研究表明食用HEV 感染的猪肉及其制品可导致G3 和G4 传播。西班牙一户人家以猎杀野猪为食导致G3 戊型肝炎感染[4];荷兰一项研究在肝脏及其制品中均检出HEV 核酸阳性[5]。研究显示HEV 也存在于生血制品和用作食品添加剂的血液蛋白等其他生猪消费品中[6]。可见,食用猪肝等猪肉及制品存在HEV 感染风险。PEDV 1971 年首次出现在英国的育肥猪群中,20 世纪80 年代,猪流行性腹泻(Porcine epidemic diarrhea,PED)在日本、韩国、印度[7]、泰国[8]等亚洲多国发生大规模流行,2013 年美国发生PED 疫情,并快速传播至14 个州[9-10],严重影响全美的猪肉供应链。PDCoV 又称为猪丁型冠状病毒和猪三角洲病毒,2014 年首次在美国俄亥俄州某猪场发现[11],随后美国其他州的猪场同样检测到该病毒,迅速引起了生猪养殖行业的重视。目前该病的发病率呈逐年上升趋势,已在美国、加拿大、墨西哥、越南、老挝、泰国、日本、韩国、中国等地均有检出,给生猪养殖行业造成巨大经济损失[12]。另外,研究表明PDCoV 具备跨物种传播的能力,可造成鸡、犊牛和鸟类的感染[13-14],而猪与人类和其他野生动物接触相对频繁,使其极可能成为潜在的人兽共患病病毒中间宿主[15]。
HEV、PEDV 和PDCoV 均以猪作为易感宿主,三种病毒可造成猪肉及其制品病原微生物污染,人类食用被污染的肉类食品可感染相关疾病,且其继发细菌感染存在导致人类食物中毒的风险。而HEV 和冠状病毒(Coronaviruses,CoVs)为典型的人兽共患病病原,PEDV 和PDCoV 均为冠状病毒属,存在通过猪肉、猪内脏及其制品增加人类感染病毒的风险。另外,PEDV 和PDCoV 是引起猪病毒性腹泻的主要病原,对新生仔猪危害最为严重,且两种病毒在临床症状、病理变化和流行病学等方面极为相似,呈混合感染[16]。自2021 年境外预检首次检出猪戊型肝炎后,全国海关强化国门生物安全监测机制,严防动物疫病输入,加强了对国外进口生猪样品中HEV、PEDV 和PDCoV 等动物源性食品疾病的监测[17]。目前,PCR 检测技术在动物源性食品疫病检测中的应用相当普遍,且对一种或两种动物疫病病原的检测方法已趋于稳定。有大量学者建立了HEV单重qPCR 检测方法[18-20],且PCR 技术在PEDV 和PDCoV 混合感染检测应用广泛[7,16,21-23],但对该三种病毒的同时检测研究较少。而目前三种病毒的单重qPCR 方法检测耗时长,消耗试剂成本高。因此建立一种同时诊断这三种病毒的高灵敏度、快速检测方法,为预防和阻断HEV、PEDV 和PDCoV 的食源性传播提供技术支撑,实现从食品原料源头上控制和保障其食用安全,保障猪肉及其制品的消费,降低肉类进出口贸易严重的经济损失,促进国际贸易发展。
1 材料与方法
1.1 材料与仪器
猪肉罐头173 份、冷冻猪肉样品(包括冻猪肉、罐头原料肉、冷冻猪背膘、冷冻猪皮和猪脚等)55 份、猪肉肠,猪肉粒和猪肉片20 份 总共248 份样品,2021 年12 月份到2022 年3 月份期间成都海关技术中心收到的送检样品;养殖场生猪粪拭子样品282 份 样本核酸均保存于成都海关技术中心实验室-80 ℃超低温冰箱;HEV 阳性样本 由西南民族大学实验室和中国疾控中心提供;非洲猪瘟病毒(African swine fever virus,ASFV)、猪瘟病毒(Classical swine sever virus,CSFV)、口蹄疫病毒(Foot-and-mouth disease virus,FMDV)、伪狂犬病病毒(Pseudorabies virus,PRV)、猪圆环病毒2 型(Porcine circovirus-2,PCV-2)、猪圆环病毒3 型(Porcine circovirus-3,PCV-3)、猪细小病毒(Porcine parvovirus infection virus,PV)、猪传染性胃肠炎病 毒(Porcine transmissible gastroenteritis virus,TGEV)、塞尼卡谷病毒(Seneca valley virus,SVV)、猪蓝耳病毒(Porcine Reproductive and Respiratory Syndrome virus,PRRSV)阳性质粒或疫苗 由成都海关技术中心实验室保存;QIAcuity™ Probe PCR Kit、QIAcuity® One-Step Viral RT-PCR Kit、质粒小提试剂盒 QIANGEN 凯杰企业管理上海有限公司;pUC57 Simple TA/平端通用克隆载体(含感受态)海基生物科技有限公司;SsoAdvanced Universal Probes Super mix 伯乐生命医学产品上海有限公司;MagPure Viral DNA/RNA Mini LQ Kit 广州美基生物科技有限公司;One Step Prime ScriptTMRTPCR Kit(Perfect Real Time)TAKARA 宝生物工程有限公司。
实时荧光定量PCR 仪、高速冷冻离心机XR3、ML 蛋白纯化与核酸提取仪、恒温混匀仪 美国赛默飞世尔科技公司;QIAcuity Four PCR 仪QIANGEN 凯杰企业管理上海有限公司;全自动凝胶图像分析系统 美国UVP 公司;生物安全柜Biotech 公司;电子天平 德国赛多利斯公司;NanoDrop ONEC 超微量核酸蛋白仪 德国Eppendorf 艾本德中国公司;冷冻研磨仪 上海净信实业发展有限公司。
1.2 实验方法
1.2.1 引物探针的设计与合成 在GenBank 中查找下载HEV 的多个候选基因序列,通过DNAMAN和Megalign 软件进行基因序列比对,筛选出特异性片段,利用Primer 6.0 软件设计多对引物和探针,将设计好的引物探针交予生工上海生物工程有限公司合成。PEDV 引物探针序列参照标准SN/T 1699-2017《猪流行性腹泻检疫技术规范》,PDCoV 引物探针序列参照标准SN/T 5124-2019《猪Delta 冠状病毒检疫技术规范》,序列详细信息见表1。
1.2.2 阳性质粒制备 PEDV 和PDCoV 的阳性质粒参照各自的基因序列(GenBank 登录号分别为MT787025.1 和OK546242.1)由生工生物公司合成。用美基公司的MagPure Viral DNA/RNA Mini LQ Kit 试剂盒提取戊型肝炎病毒核酸,扩增目的片段。反应体系参照One Step TB Green® PrimeScriptTMRT-PCR Kit(Perfect Real Time)试剂盒说明书,反应程序为:逆转录42 ℃,5 min,95 ℃,10 s;95 ℃预变性3 min;95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸30 s,40 个循环,72 ℃延伸10 min;16 ℃保存。PCR 产物经1%琼脂糖电泳检测,按照Takara Mini BEST Agarose Gel DNA Extraction Kit 胶回收试剂盒进行切胶回收处理,随后按照pUC57 Simple TA/平端通用克隆载体(含感受态)操作说明书将目的片段连接到PUC57 载体上。最后将连接产物转化至RTS DH5α感受态细胞,扩大培养后PCR 验证、测序鉴定,测序结果在NCBI 上进行BLAST 分析,序列正确的即为所需阳性质粒。将制备成功的质粒用质粒小提试剂盒提取后核酸蛋白仪测定质粒浓度,计算拷贝数。冻存至-80 ℃待用。
1.2.3 病毒RNA 提取 样品前处理参考文献[24]。猪肉制品:用剪刀多点挑取非脂肪、非结缔组织部分样品3.0 g 置于15 mL 匀浆管中,对于调料较多的罐头和猪肉肠样品,先加入4 mL PBS 清洗样品3 次,去除漂浮油脂和调味品等杂质,后加入4.5 mL PBS 颠倒混匀,用冷冻研磨仪匀浆,确保样品组织完全破碎,反复冻融3 次,使病毒充分释放到PBS 中,5000 r/min 离心5 min 后备用。生猪粪拭子样品:首先,制备10%的粪便悬液,取粪便标本0.1 g 至1.5 mL EP 管中,加入0.9 mL PBS,pH 调至7.2,涡旋振荡3 次,每次10 s。静置10 min 后,以8000 r/min 转速离心10 min,吸取上清至新的1.5 mL EP 管中备用。
核酸提取:吸取处理好的样品上清液200 μL,按照Mag Pure Viral DNA/RNA Mini LQ Kit 提取试剂盒说明书操作,用KingFisher ML 核酸提取仪提取病毒RNA。
1.2.4 三重qPCR 方法体系建立及优化 根据One Step PrimeScript™ RT-PCR Kit(Perfect Real Time)试剂盒说明书进行HEV、PEDV 和PDCoV 三重qPCR 反应,反应体系和程序参照前期预实验单重qPCR 优化好的体系和程序,程序为:预变性95 ℃,10 s;变性95 ℃,10 s,退火延伸58 ℃,30 s,45 个循环收集荧光。在此基础上,进一步对设计的三对引物,用合成的阳性质粒进行反应程序和引物探针浓度优化。对退火温度(52、54、56、58、60、62 ℃),引物浓度(HEV、PEDV 引物浓度10 μmol/L,PDCoV 引物浓度5 μmol/L,使用量0.2、0.4、0.5、0.6、0.8、1.0、1.2 μL),探针浓度(HEV、PEDV 探针浓度10 μmol/L,使用量0.1、0.2、0.4、0.6、0.8、1.0、1.2 μL;PDCoV 探针浓度5 μmol/L,使用量0.2、0.4、0.6、0.8、1.0、1.2、1.5 μL)进行反应条件优化(见表2),再将三种病毒各自最优的引物探针浓度交叉组合后进行反应,确定三重qPCR 的最佳反应条件。
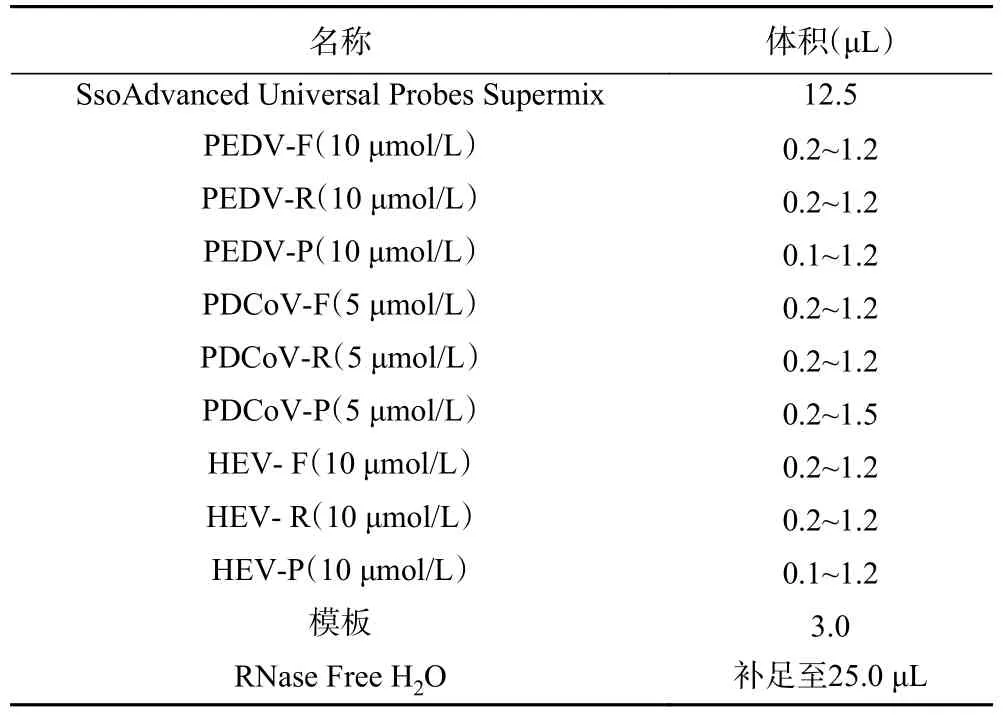
表2 HEV PEDV PDCoV 三重 qPCR 优化反应体系Table 2 HEV PEDV PDCoV triple qPCR optimization reaction system
1.2.5 三重qPCR 方法特异性试验 提取ASFV、CSFV、FMDV、PRV、PCV2、PCV3、PPV、TGEV、SVV、PRRSV 病毒核酸作为模板,加入HEV、PEDV和PDCoV 的混合阳性质粒,并以RNase Free H2O为阴性对照,使用已优化好的反应条件进行三重qPCR 反应,验证HEV、PEDV 和PDCoV 三重qPCR方法的特异性。
1.2.6 三重qPCR 方法敏感性试验和标准曲线绘制
将HEV、PEDV、PDCoV 阳性质粒按照体积比1:1:1 混合后,连续10 倍梯度稀释,再2 倍稀释,设置阴性对照,确定三重qPCR 方法最低检测限,与标准方法[24-26]进行比对。然后选用6 个点,用Applied Biosystems® QuantStudio®5 荧光定量PCR 仪配套软件绘制三重qPCR 方法标准曲线,并进行线性回归分析。
1.2.7 三重qPCR 方法重复性试验 将HEV、PEDV、PDCoV 混合阳性质粒进行连续10 倍倍比稀释,选取106、105、104和103copies/μL 的4 个不同浓度梯度重组质粒进行三重qPCR 重复试验,每个浓度的模板分别进行批内重复和批间重复试验,每个浓度重复3 次,评估所建立方法的重复性。
1.2.8 人工污染猪肉样品检测
1.2.8.1 样品处理方法 在2.5 cm×2.5 cm×2.5 cm的小块切割肉表面选取4 个注射点,将100 μL 104、103、102copies/μL 三个稀释浓度的HEV、PEDV 和PDCoV 混合阳性质粒核酸提取液分别用注射器注射到三份小块切割肉中,后放于4 ℃,2 h 以上增加病毒附着量。将污染的三个罐头原料肉样品分别置于3 支50 mL 离心管中,加入PBS 研磨成匀浆液,5000 r/min 离心5 min,取上清液200 μL,按照MagPure Viral DNA/RNA Mini LQ Kit 提取试剂盒说明书操作,用KingFisher ML 核酸提取仪提取病毒RNA,核酸置于-80 ℃保存。每个浓度重复3 次,同时以未污染的罐头原料肉样品作为阴性对照。
1.2.8.2 人工污染样品病毒回收率计算 用建立的三重qPCR 检测方法分别对不同浓度污染的切割肉病毒核酸和混合阳性质粒核酸进行检测,每个浓度重复3 次,计算病毒回收率。回收率计算如下:
1.2.9 实际样本检测 对2021 年12 月份到2022年3 月份期间成都海关技术中心收到的248 份猪肉及制品和282 份各养殖场种猪粪拭子样本核酸用三重qPCR 方法和标准检测方法平行检测,同时以106copies/μL 的阳性混合质粒为阳性对照,RNase Free H2O 为阴性对照。对结果进行比较分析,评价该方法的实用性。
1.3 数据处理
采用DNAMAN 和Megalign 软件进行序列比对,Premier 6.0 进行引物设计。重复性验证结果和回收率采用SPSS 软件进行均数方差分析和ANOVA分析;退火温度优化数据SPSS 软件分析后采用Origin 绘制图像;qPCR 图像处理采用CFX-Managerr荧光定量PCR 仪Bio-Radcc 配套软件和Applied Biosystems® QuantStudio®5 荧光定量PCR 仪配套软件进行分析处理。
2 结果与分析
2.1 阳性质粒制备
HEV、PEDV 和PDCoV 三种病毒阳性质粒浓度及其拷贝数见表3。
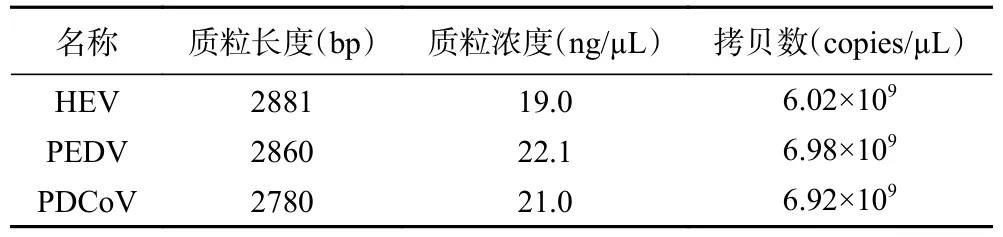
表3 质粒浓度及拷贝数Table 3 Calculation of plasmid concentration and copy number
2.2 三重qPCR 反应体系的优化
2.2.1 退火温度优化 HEV、PEDV 和PDCoV 三重qPCR 退火温度优化显示,在52~62 ℃区间设定6 个温度梯度间Ct 值存在显著性影响(P<0.05)(图1),在退火温度58 和62 ℃时,HEV、PEDV和PDCoV 三种病毒Ct 值较小,再比较荧光信号强度,在退火温度58 ℃时,三种病毒Ct 值较小荧光强度最高(图2)。综合考虑得出最优温度58 ℃,在该退火温度下,荧光信号强扩增曲线平滑且Ct 值较低。三重qPCR 的反应程序为:42 ℃,5 min;95 ℃,10 s;95 ℃,10 s,58 ℃,45 s,45 个循环。
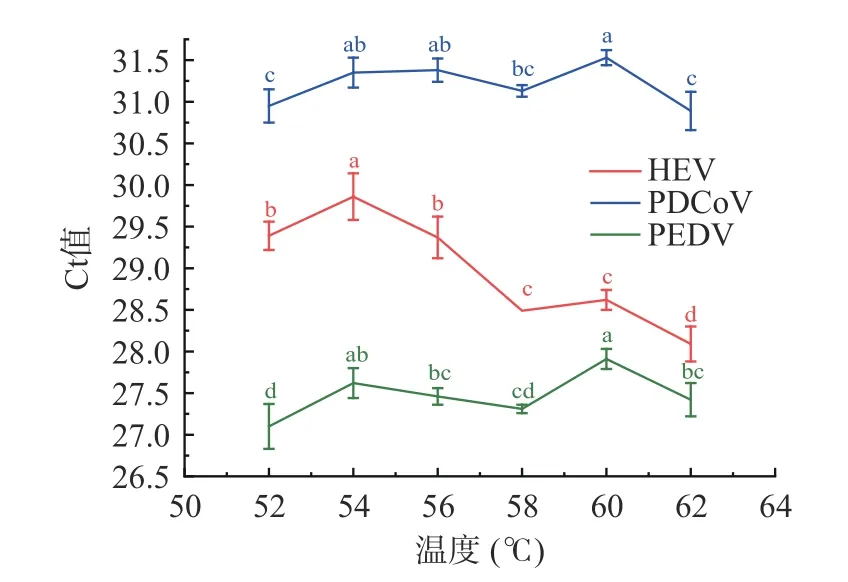
图1 不同退火温度下三重qPCR 扩增Ct 值结果Fig.1 Results of Ct values and significance of triple qPCR amplification under different annealing temperatures
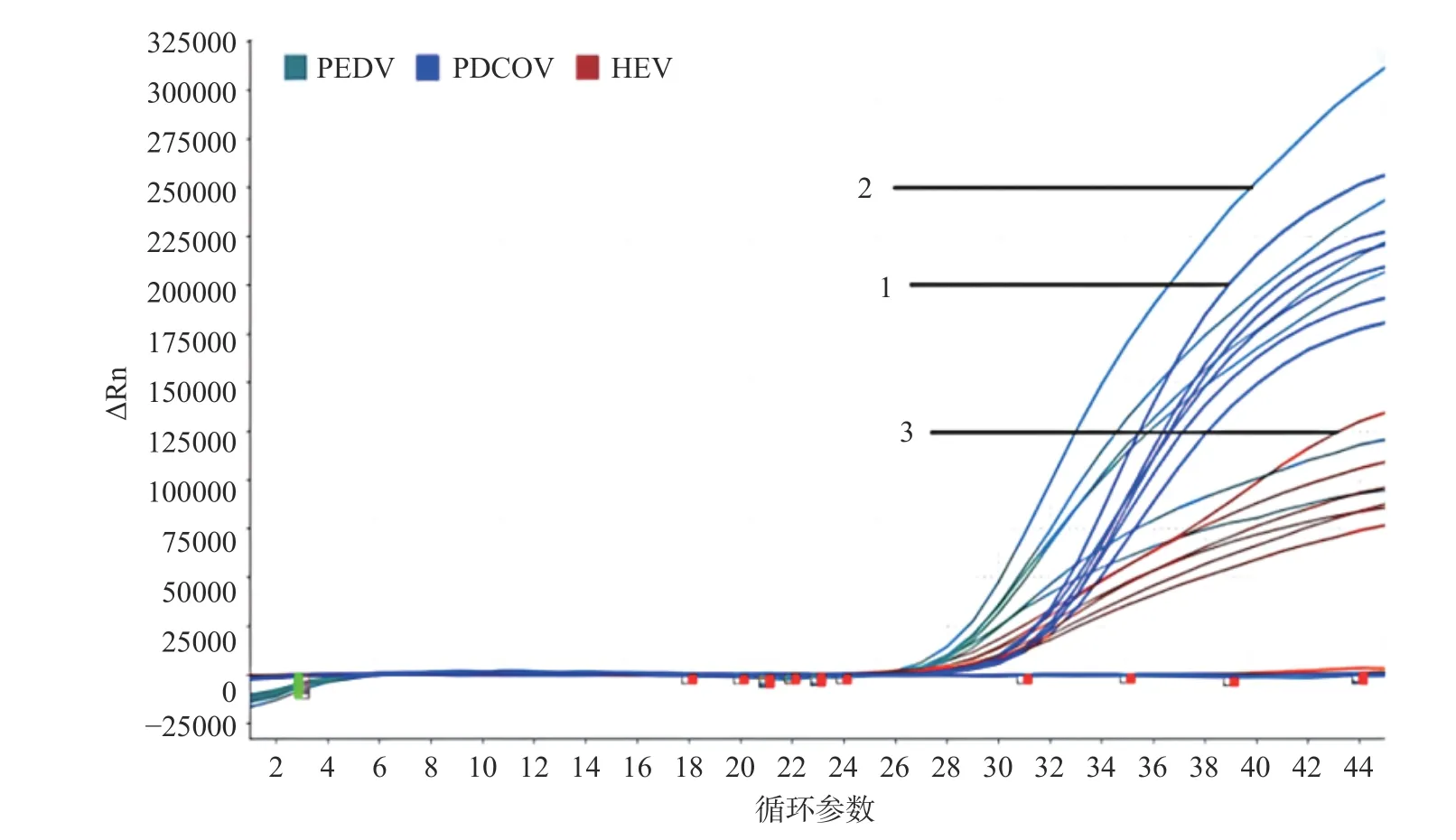
图2 最佳退火温度条件下三重qPCR 扩增结果Fig.2 Triple-qPCR amplification results of optimal annealing temperature
2.2.2 引物探针浓度优化 首先固定PEDV 和PDCoV 两种病毒的引物探针浓度,根据HEV 扩增曲线Ct 值、扩增效率、荧光信号强度选出HEV 最优的两对引物探针浓度组合(10 μmol/L,1.0 μL,1.0 μL;10 μmol/L,1.0 μL,0.8 μL),同样方法选出PEDV 和PDCoV 最优的两对引物探针浓度组合(PEDV:10 μmol/L,0.5 μL,0.2 μL;10 μmol/L,1.0 μL,0.5 μL,PDCoV:5 μmol/L,1.0 μL,0.5 μL;5 μmol/L,0.8 μL,0.4 μL)。再将三种病毒各自最优的两对引物探针浓度交叉组合后进行反应,选出对三种病毒Ct 值和荧光信号强度影响最小的组合。三种病毒引物探针优化结果扩增图见图3,Ct 值见表4,确定三重qPCR 的最佳反应体系如表5。
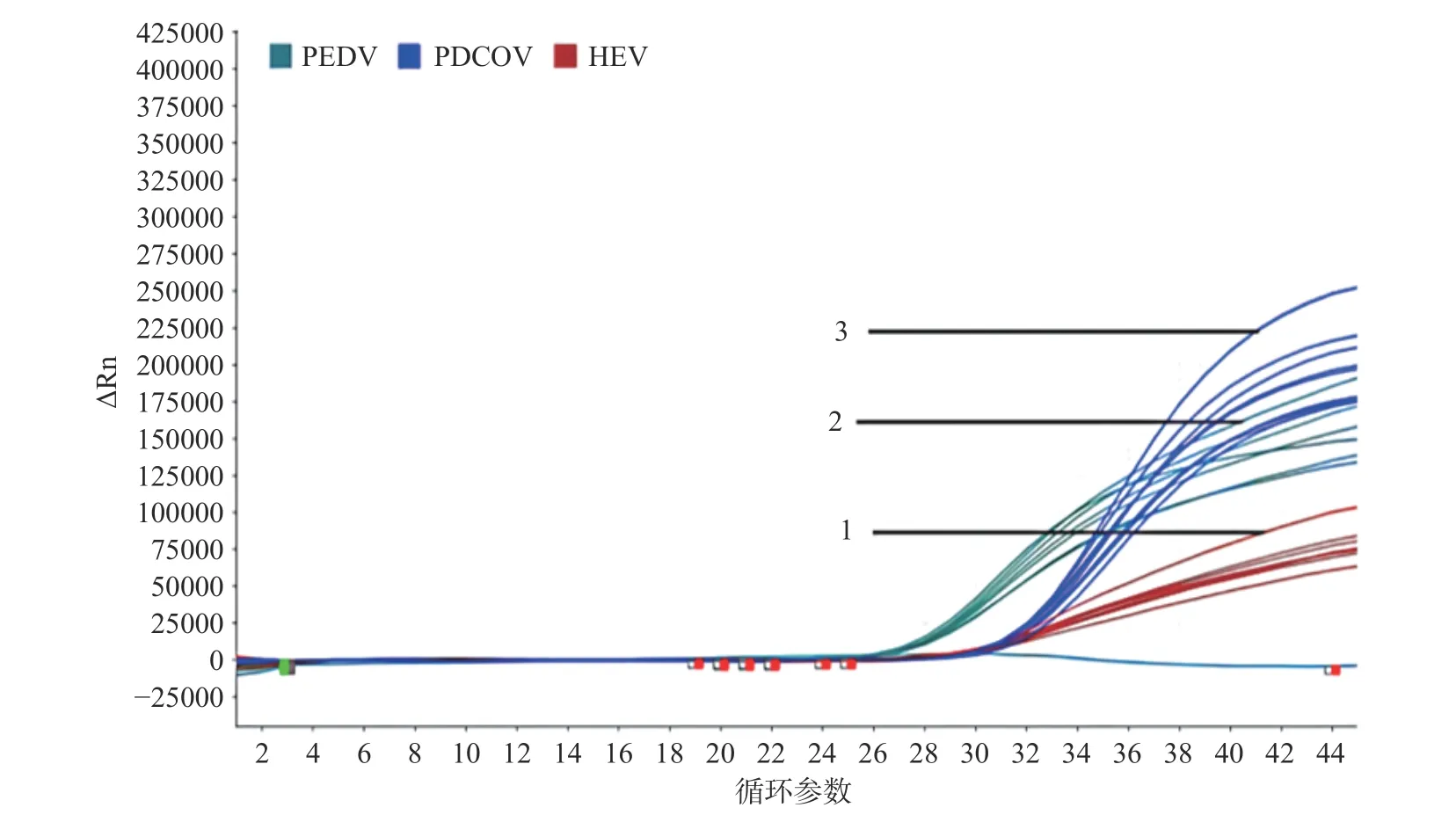
图3 HEV、PEDV 和PDCoV 三重qPCR 引物探针优化结果Fig.3 Optimization results of Triple qPCR primers and probes for HEV,PEDV,and PDCoV
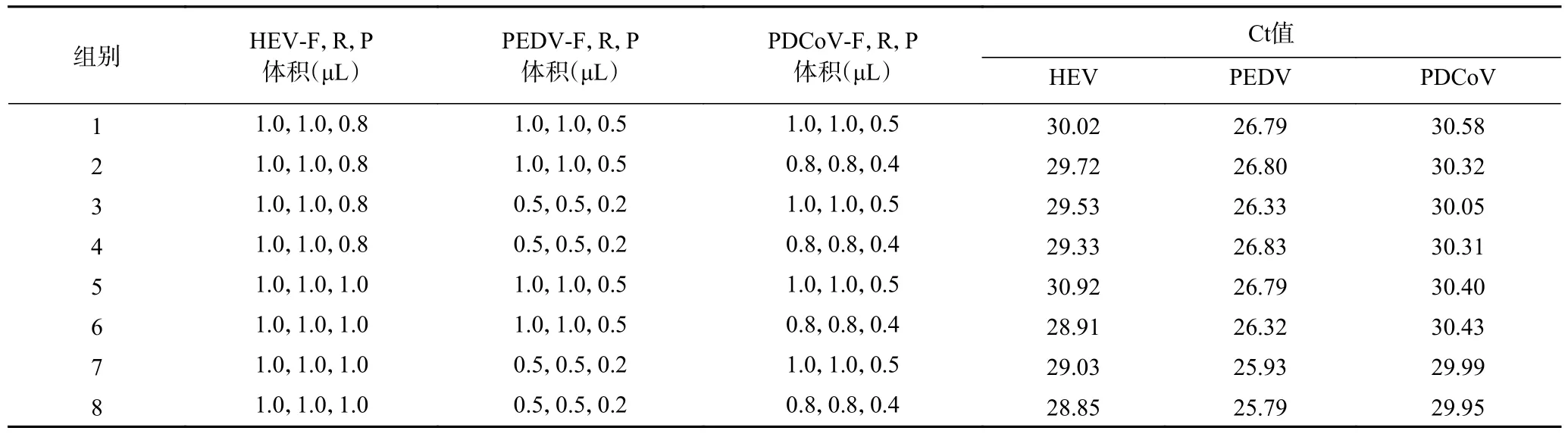
表4 HEV、PEDV 和PDCoV 三重qPCR 引物探针优化结果(Ct 值)Table 4 Optimization results of triple qPCR primer probes for HEV,PEDV,and PDCoV (Ct value)
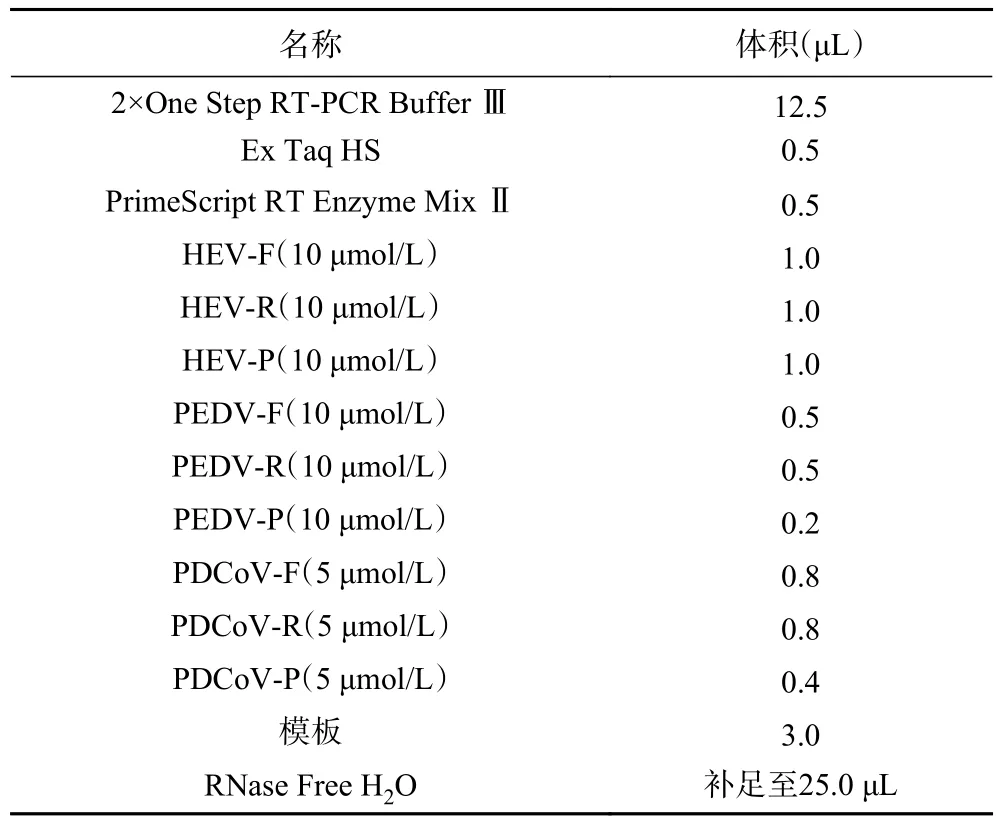
表5 HEV PEDV PDCoV 三重 qPCR 反应体系Table 5 HEV PEDV PDCoV triple qPCR reaction system
2.2.3 三重qPCR 特异性验证 将上述已建立好的三重qPCR 检测方法用于其他10 种相关病毒检测,结果显示,只有HEV、PEDV、PDCoV 有阳性扩增曲线,其余10 种病毒(ASFV、CSFV、FMDV、PRV、PCV2、PCV3、PPV、TGEV、SVV、PRRSV)和阴性对照均无扩增曲线(图4),表明建立的三重qPCR 检测方法具有良好特异性。
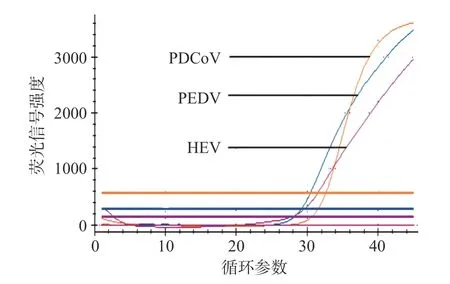
图4 HEV、PEDV 和PDCoV 三重qPCR 特异性试验Fig.4 HEV,PEDV and PDCoV fluorescence of triple qPCR specificity test
2.2.4 三重qPCR 灵敏度和标准曲线 选用HEV、PEDV 和PDCoV 混合阳性质粒(浓度分别为6.02×107~6.02×100、6.98×107~6.98×100和6.92×107~6.92×100copies/μL)8 个梯度作为模板,使用已优化好的方法进行三重qPCR 反应,结果显示,三种病毒浓度最低均能检测到100copies/μL(图5)。再将100copies/μL 混合阳性质粒梯度二倍稀释(HEV、PEDV 和PDCoV 阳性质粒浓度分别为6.02、3.01、1.505 copies/μL,6.98、3.49、1.295 copies/μL 和6.92、3.46、1.73 copies/μL),进行三重qPCR 反应,直至无稳定曲线扩增。结果表明,三重qPCR 检测方法中,HEV 阳性质粒检测限为6.02 copies/μL,PEDV 阳性质粒检测限为6.98 copies/μL,PDCoV 阳性质粒检测限为6.92 copies/μL,低于该浓度无扩增曲线且无法收集到相关荧光信号。

图5 HEV、PEDV 和PDCoV 三重qPCR 的灵敏度Fig.5 Sensitivity of triple-qPCR of HEV,PEDV and PDCoV
绘制标准曲线结果显示(图6),在核酸拷贝数107~102copies/μL 范围内,三种病毒标准曲线均呈良好线性关系。HEV、PEDV 和PDCoV线性决定系数(R2)分别为0.999、0.996 和0.993;三种病毒引物扩增效率(E)分别为94.16%、113.56%和112.15%。

图6 HEV、PEDV 和PDCoV 三重qPCR 标准曲线Fig.6 Standard curve of triple-qPCR of HEV,PEDV and PDCoV
2.2.5 三重qPCR 重复性验证 以106、105、104、103copies/μL 的HEV、PEDV、PDCoV 混合阳性质粒作为模板,进行了批内重复和批间重复试验。检测结果各组平行数据标准差(SD)均小于0.4,集中趋势好,组内和组间变异系数(CV%)均在0.10%~3.00%之间,可见建立的三重qPCR 检测方法重复性以及稳定性好(表6)。
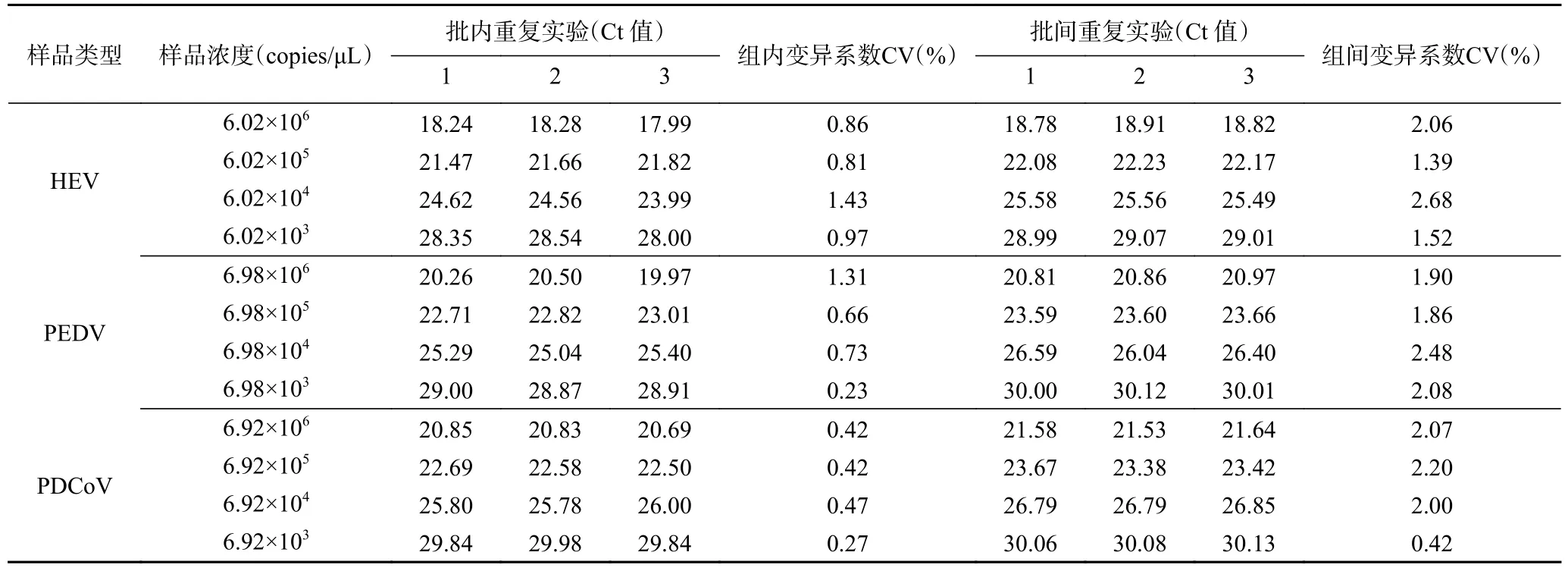
表6 HEV、PEDV 和PDCoV 三重qPCR 重复性验证Table 6 HEV,PEDV and PDCoV triplex qPCR repeatability test
2.2.6 人工污染猪肉的检测结果 用104、103、102copies/μL 三个浓度的HEV、PEDV 和PDCoV混合阳性质粒核酸对罐头原料肉人工污染,评价三重qPCR 方法在食品中的检测效果。结果显示,HEV、PEDV 和PDCoV 三种病毒不同污染浓度的回收率满足方差齐性(P=0.285,P=0.580,P=0.613>0.05),选用单因素ANOVA 检验-LSD 法进行两两比较,三种病毒回收率在任意两种污染浓度之间的差异均存在统计学意义(P<0.05)(表7)。可见,三种病毒在不同的污染浓度的食品中回收率均较好,均能被稳定检测。

表7 三重qPCR 方法对罐头原料肉不同污染浓度回收率Table 7 Recovery rate of different contamination concentration of canned raw meat by triple-qPCR method
2.2.7 实际样品检测结果 同时用SN/T 4235-2015、SN/T 1699-2017 和SN/T 5124-2019 标准检测方法、建立好的三重qPCR 检测方法对2021 年12 月份到2022 年3 月份期间成都海关技术中心收到的248 份出口猪肉及其制品,以及282 份各养殖场的生猪粪拭子样品进行检测。检测结果显示,在248 份出口猪肉及其制品中,标准检测方法、三重qPCR 方法对HEV、PEDV 和PDCoV 三种病毒的检出率均为0%;在282 份进口的生猪粪拭子样品中,标准方法对HEV、PEDV 和PDCoV 三种病毒的检出率分别为0%、1.06%、3.19%;三重qPCR 方法的检出率分别为0.35%、1.06%、3.19%(表8),可见,与标准检测方法相比,HEV 检出率得到了提升,PEDV 和PDCoV 检出率一致。
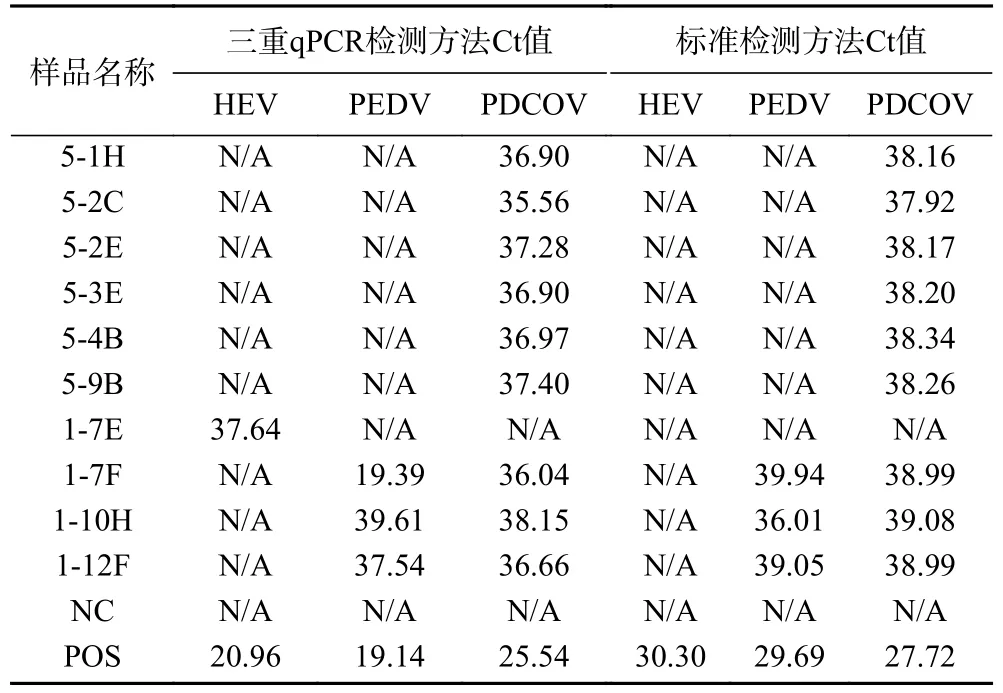
表8 三重qPCR 和标准检测方法对实际样品的阳性检测结果Table 8 Positive test results of triple qPCR on pig derived samples
3 讨论与结论
动物源性食品中的动物疫病可以通过直接或间接污染动物源性食品,对食品安全、养殖业发展以及人类健康和公共卫生安全构成严重威胁。WHO 调查显示,75%的动物疫病是人兽共患病,其中有70%至少可以传染给一种动物[27],像戊型肝炎病毒、诺如病毒、轮状病毒等会造成人类食物中毒,虽然目前我国已经成功研制了戊肝疫苗,但并没有在市面上广泛应用,若不加强病毒传播的防范,有可能成为我国消化道传播的主要病毒性肝炎。而冠状病毒中α和β属多为人兽共患病毒,最为典型的中东呼吸综合征病毒(MERS-CoV)和引起严重急性呼吸综合征病毒(SARS-CoV)都是从动物宿主中产生的。在北京市新冠肺炎疫情防控工作第130 场新闻发布会上,国家卫生健康委专家组专家、国家食品安全风险评估中心微生物实验室主任李凤琴介绍,新冠病毒不会在食品之间传播,但有可能被污染,从新冠肺炎疫情严重的国家进口冷链食品表面和外包装都发现SARS-CoV-2 污染[28],可见冷冻食品可能成为CoVs传播的媒介,加重疫情形势。另外由于冠状病毒遗传物质单链RNA 稳定性差且病毒基因组结构长,不排除其他冠状病毒属经变异进化感染人类的可能性。
目前,对HEV、PEDV 和PDCoV 三种病毒的检测多采用单重荧光定量和环介导等温扩增反应(Loop-mediated isothermal amplification,LAMP)等基因诊断技术,多重qPCR 检测方法的研究较少。在其他学者建立的检测方法中,TaqMan 荧光定量RT-PCR 方法对HEV 的检测灵敏度可达2.0×101copies/μL[19];对PEDV 的RT-PCR 方法检测限为4×104copies/μL[29]、实时荧光RPA 等温检测方法[30]和RT-LAMP 快速检测方法[31]灵敏度均为2 copies/μL,学者对PDCoV N 基因建立荧光RTqPCR 方法检测限为6.3 copies/μL[23],TaqMan 探针qPCR 方法检测极限2.2 copies/μL[32]。本研究中,三重qPCR 检测方法对三种病毒的最低检出限均能达到个位拷贝数,对HEV、PEDV 和PDCoV 三种病毒的最低检测限分别为6.02、6.98、6.92 copies/μL。可见,该方法灵敏度较高,且有效规避了多重反应体系中多对引物探针的交互影响,将三种病毒相互间干扰降到最低。另外,HEV、PEDV和PDCoV 三种病毒在生猪粪拭子样品中的检出率与出口猪肉罐头、罐头原料肉、冷冻猪肉样品等样品相比,阳性检出率明显提高。国外学者对不同种类的猪肉产品进行HEV 检测结果显示,香肠、猪肝制品及冻猪皮等不同产品中HEV 阳性率有一定差异,在以生猪肝为原料制备的猪肝酱中HEV 阳性检出率远高于香肠中HEV 阳性检出率[5,33-34],可见猪肉经过加工成食品后,食品中病毒载量降低,且不同猪肉食品基质和热处理、腌制等加工处理方式都会对病毒载量产生影响,这与本研究得出结论相符。而HEV 和冠状病毒等引起胃肠炎的病毒在环境中相当稳定,在无生命表面、手和干粪便的悬浮液中均可存活[35]。因此,本研究在提高猪肉及其制品检测效率的同时也保证了三种病毒的检出率,对预防和阻断HEV、PEDV 和PDCoV 三种病毒的食源性传播具有一定参考价值。

