不同益生菌对三华李发酵果汁品质及其体外消化特性的影响
杜晓仪,杨继国,徐玉娟,吴继军,余元善,邹 波,彭 健,李 璐,
(1.广东省农业科学院蚕业与农产品加工研究所/农业农村部功能食品重点实验室/广东省农产品加工重点实验室,广东广州 510610;2.华南理工大学食品科学与工程学院,广东广州 510641)
益生菌是能够定殖在人体内,并对宿主有益的活性微生物。益生菌与人体健康息息相关。当人体内的益生菌达到一定数量时,能够起到维持肠道微生态平衡、调节免疫及辅助降血脂等生理功效[1]。通过饮食来补充益生菌是目前最常见的方式之一。近年来,益生菌发酵成为一种新兴的食品加工方式,已在食品领域广泛应用。随着消费者对具有促进健康和预防疾病作用食品的需求量显著增加,益生菌发酵饮品已占据功能性饮料市场的绝大部分。目前,益生菌发酵通常多应用于乳制品加工中。然而,由于乳糖不耐症、乳蛋白过敏、半乳糖血症和高胆固醇血症的影响,越来越多的人不能或避免使用乳制品。因此,开发新型益生菌发酵基质引起了研究人员的关注。果汁具有丰富的营养物质,是益生菌生长的优良基质。相较于发酵乳制品,益生菌发酵果汁具有低胆固醇和低过敏原的特点。此外,其具备独特的水果风味,深受消费者喜爱。
三华李(Prunus salicinaLindl.cv.Sanhua)是一种岭南特色水果,香气浓郁,因其富含花青素等抗氧化物质而备受科研工作者的关注。研究表明,三华李总多酚含量显著高于荔枝、杨梅、柑橘等水果,并能够在消化后仍保留有较高的抗氧化活性[2]。然而,三华李货架期短,鲜食时口感极酸,将三华李加工成益生菌发酵果汁无疑可拓宽三华李的销售渠道。目前,用于发酵果汁的益生菌多为乳酸菌,如植物乳杆菌(Lactiplantibacillus plantarum)(LP)、鼠李糖乳杆菌(Lactobacillus rhamnosus)(LR)和发酵乳杆菌(Lactobacillus fermentum)(LF)[3-5]等是果汁发酵中常用的益生菌。果汁经益生菌发酵可生成多种生物活性物质,从而改善和提升发酵果汁产品的品质[6]。此外,有研究表明,肠膜明串珠菌(Leuconostoc mesenteroides)(LM)发酵荔枝汁的感官评分要高于植物乳杆菌发酵[7],且在贮藏过程中对果汁中的病原菌有极好的抑制效果[8]。然而,至今尚未见有关益生菌发酵三华李果汁的报道。
因此,本研究选用LM、LF、LR 和LP 四种常见益生菌对三华李果汁进行发酵。探究不同益生菌对发酵三华李果汁(fermented Sanhua plum juice,FSPJ)理化性质、活性物质和抗氧化活性的影响规律及其体外消化过程中益生菌活菌数、总酚、总黄酮、总花色苷含量和抗氧化活性的变化规律,旨在丰富三华李的加工技术和产品种类。
1 材料与方法
1.1 材料与仪器
三华李 产地广东省信宜市,采摘后的三华李放置后熟,榨汁备用;肠膜明串珠菌 Y109、发酵乳杆菌 E324、植物乳杆菌 GMC1.6655、鼠李糖乳杆菌MNP1.0996 广东省农业科学院蚕业与农产品加工研究所;MRS 肉汤培养基、技术琼脂粉、MRS 培养基 广东环凯微生物科技有限公司;复合果胶酶(30000 U/mL)睿丹生物科技有限公司;高温-α-淀粉酶(1500 U/mL)、胃蛋白酶(25000 U/mL)、胰蛋白酶(800 U/mL)、猪胆盐、芦丁、草酸、酒石酸、苹果酸、乳酸、乙酸 均为色谱纯,上海源叶生物科技有限公司;模拟消化液(模拟唾液、模拟胃液、模拟肠液)实验室自行配制。
PBJ-GO1E 型破壁料理机 江门市贝尔斯顿电器有限公司;AP-55 数显糖度计 衢州艾普计量仪器有限公司;D3024R 台式高速冷冻离心机 美国赛洛捷克SCILOGEX 公司;SW-CJ-2FD 型洁净工作台苏净集团苏州安泰空气技术有限公司;MJX-250-Z 型生化培养箱 上海博讯事业有限公司医疗设备厂;PB-10 型pH 计 德国Sartorius 公司;YXQ-LS-50SII 型立式压力蒸汽灭菌器 上海博迅实业有限公司医疗设备厂;HH-2 型数显恒温水浴锅 常州金坛精达仪器制造有限公司;P9PC 型双光束紫外可见分光光度计 上海美谱达仪器有限公司;ZQZY-88BV 型振荡培养箱 上海知楚仪器有限公司;LC-20AT 高效液相色谱仪 日本岛津公司;Ultra Scan VIS 型全自动色差仪 美国Hunter Lab 公司。
1.2 实验方法
1.2.1 三华李发酵果汁制备工艺流程 参照高畅等[9]的方法制备三华李发酵果汁,稍作修改:新鲜三华李→洗净→去核→打浆→酶解→过滤→离心→pH 调整→糖度调整→灭菌→接种发酵→三华李益生菌发酵果汁。
1.2.2 操作要点 应挑选外形良好、成熟度适中的三华李果实制备澄清三华李果汁;三华李打浆后添加0.05%复合果胶酶45 ℃酶解1.5 h;经酶解的三华李果浆用200 目纱布过滤后,过滤得到的三华李浊汁5000 r/min 离心10 min 得三华李清汁;通过饱和Na2CO3溶液和外源添加葡萄糖将果汁pH 和糖度分别调整为pH5.0 和13.50°Brix±0.50°Brix;经pH 和糖度调整的三华李果汁90 ℃灭菌10 min;将四种不同益生菌LM、LF、LR、LP 接种于灭菌MRS 肉汤培养基中,37 ℃,200 r/min 摇床培养6 h后按3%(以三华李果汁质量计)的比例分别接种于三华李果汁中37 ℃,200 r/min 摇床发酵48 h,分别得到肠膜明乳杆菌发酵三华李果汁(FSPJLM)、发酵乳杆菌发酵三华李果汁(FSPJLF)、鼠李糖乳杆菌发酵三华李果汁(FSPJLR)、植物乳杆菌发酵三华李果汁(FSPJLP);以未接种发酵的三华李果汁(37 ℃,200 r/min,48 h)作为本次实验的空白组(control group,CG)。
1.2.3 活菌数的测定 益生菌活菌数参考国标GB 4789.35-2016 进行测定。通过平板计数法确定三华李果汁发酵48 h 后和体外消化过程中(经口消化,经胃消化和经肠消化后)的益生菌活菌数量。
1.2.4 理化指标的测定
1.2.4.1 pH、可滴定酸及可溶性固形物的测定 使用pH 计对三华李果汁样品的pH 进行测定;可滴定酸的测定采用GB 12456-2021 中酸碱滴定法的pH 计电位滴定法;三华李果汁样品的可溶性固形物的测定使用AP-55 数显糖度计进行测定。
1.2.4.2 色度值的测定 使用Ultra Scan VIS 型全自动色差仪对三华李益生菌发酵果汁样品的色度值进行测定。将果汁置于无色透明的比色皿中测定果汁样品的L*值、a*值和b*值。以色度角Hue(h=tan-1(b*/a*))和总色差表示果汁的色度变化[10]。
1.2.4.3 有机酸组分的测定 参照Wu 等[11]的测定方法。高效液相色谱条件:C18色谱柱(4.6 mm×250 mm,5 μm)。流动相为0.1 mol/L(NH4)2HPO4溶液,并用磷酸调节至pH2.5,柱温30 ℃,检测器为二极管阵列检测器(PDA),检测波长为210 nm,进样量10 μL。采用外标法定量。
标准曲线:分别用纯净水溶解配制不同质量浓度的草酸、酒石酸、苹果酸、乳酸和乙酸,经0.22 μm的微孔滤膜过滤后进行HPLC 分析,得到峰面积(x)和有机酸质量浓度(y)的标准曲线。
样品处理:三华李果汁样品以1:2 的比例加入0.3%偏磷酸超声提取(400 W,15 min),过0.22 μm滤膜上机测定。
1.2.5 总酚、总黄酮及总花色苷含量的测定 采用Folin-Ciocalteu 比色法测定三华李果汁样品中的总酚含量[12]稍作修改。将果汁样品稀释50 倍,取果汁样品稀释液1 mL,加入2 mL 10%福林酚试剂,充分混匀后加入2 mL 10% Na2CO3溶液,常温避光反应1 h 后,在760 nm 处测定其吸光度。结果以没食子酸当量(mg GAE/L)表示。
采用NaNO2-Al(NO3)3分光光度法测定样品中黄酮的含量[13]稍作修改。将果汁样品稀释20 倍,取三华李发酵果汁样品稀释液3 mL,加入0.5 mL 5%NaNO2,0.5 mL 10% Al(NO3)3,静置6 min,加入2 mL 1 mol/L NaOH,振荡混匀后45 ℃水浴10 min 冷却,505 nm 测定其吸光值。结果以芦丁当量(mg RE/L)表示。
总花色苷含量的测定及缓冲溶液的配制参考William 等[14]的方法并稍作修改。取三华李果汁样品1 mL,分别加入9 mL pH1.0 缓冲溶液和9 mL pH4.5 缓冲溶液,45 ℃平衡50 min,分别于510 nm和700 nm 下测定样品在两种缓冲液下的吸光度值。总花色苷含量的测定结果以矢车菊素-3-O-葡萄糖苷当量(mg/L)表示,计算公式为:
式中,A=(A510-A700)pH1.0-(A510-A700)pH4.5;MW为矢车菊素-3-O-葡萄糖苷分子量;DF 为稀释倍数;ε为摩尔消光系数;L 为光程。
总酚、总黄酮、总花色苷的含量测定以相同处理未接菌发酵的三华李果汁作为对照组。体外消化过程中的总酚、总黄酮及总花色苷最终含量为对照组和样品组减去模拟唾液、模拟胃液和模拟肠液(用蒸馏水代替三华李发酵果汁制备)之后的测定值。
1.2.6 抗氧化活性的测定
1.2.6.1 DPPH 自由基清除活性的测定 根据Wang等[3]报道方法测定DPPH 自由基清除率并稍作修改。将三华李发酵果汁样品稀释25 倍,取1 mL 样品稀释液添加到5 mL DPPH 乙醇溶液(0.13 mmol/L)中,避光反应20 min 后在517 nm 处测吸光度。以蒸馏水代替样品稀释液为空白组,测定结果表示为DPPH 自由清除百分比,其结果计算如下:DPPH 清除率(%)=(A空白-A样品)×100/A空白。
1.2.6.2 铁离子还原能力的测定 铁离子还原能力采用鞠葛金悦等[15]报道的方法测定,三华李发酵果汁样品稀释30 倍。测定结果用Trolox 当量(g TE/L)表示。抗氧化能力的测定以相同处理未接菌发酵的三华李果汁作为对照组。体外消化过程中的最终抗氧化能力的测定为对照组和样品组减去模拟唾液、模拟胃液和模拟肠液(用蒸馏水代替三华李发酵果汁制备)之后的测定值。
1.2.7 体外模拟消化 体外模拟消化过程及模拟消化液配制方法采用Minekus 等[16]的方法。经口消化阶段,分别将5 mL CG、FSPJLM、FSPJLF、FSPJLR和FSPJLP 加入到5 mL 模拟唾液中,37 ℃,100 r/min摇床孵育2 min;经胃阶段,分别将5 mL CG、FSPJLM、FSPJLF、FSPJLR 和FSPJLP 的经口消化液加入到5 mL 模拟胃液中,使用0.6 mol/L HCl 溶液分别将其pH 调整为3.0 后,在37 ℃,100 r/min摇床孵育2 h;经肠阶段,将5 mL CG、FSPJLM、FSPJLF、FSPJLR和FSPJLP 的经胃消化液加入到5 mL 模拟肠液中,使用1 mol/L NaOH 溶液将分别将其pH 调整为7.0 后,在37 ℃,100 r/min 摇床孵育2 h。分别在消化开始前和各个消化阶段结束后进行益生菌活菌计数和取样,并将取得的样品立即置于液氮中快速冷冻后于-80 ℃进行保存。
1.3 数据处理
实验设置三个平行,数据均以平均值±标准差表示,通过SPSS statistics 27.0 软件中的邓肯检验进行显著性分析,P<0.05 表示差异显著,采用OriginPro 2021 软件绘图。
2 结果与分析
2.1 不同益生菌对三华李发酵果汁中益生菌活菌数和可溶性固形物的影响
利用果汁发酵中常用的益生菌LM、LF、LR 和LP 对三华李果汁进行48 h 发酵,四种益生菌发酵三华李果汁中的益生菌活菌数均处于107~108CFU/mL之间(图1A)。其中,FSPJLR、FSPJLF 和FSPJLM果汁中的益生菌活菌数呈递减趋势,而益生菌活菌数越多的三华李发酵果汁中的可溶性固形物含量越小(图1B),在乳酸菌发酵山楂汁中也出现类似的结果[12]。这可能是因为在三华李果汁中生长较好的益生菌,能够更加充分地利用三华李果汁中的可溶性糖类[17]。然而,FSPJLP 中益生菌活菌数和可溶性固形物的变化趋势却与其他三种益生菌发酵果汁的不同,这可能是发酵过程中菌体数量、菌龄和果汁营养成分等因素对LP 的生长造成了较大的影响[18],即三华李果汁中丰富的营养物质和发酵的环境条件可能使LP 快速增长,从而更早地进入稳定期及衰亡期,因此虽然消耗了大量的营养物质导致可溶性固形物含量下降,但经48 h 发酵后的FSPJLP 益生菌活菌数却远低于FSPJLM、FSPJLF 和FSPJLR。

图1 不同益生菌发酵三华李果汁中益生菌活菌数(A)和可溶性固形物含量(B)Fig.1 Viable probiotic counts (A) and soluble solid content (B)in Sanhua plum juice fermented by different probiotics
2.2 不同益生菌对发酵三华李果汁pH 和可滴定酸的影响
由图2 可知,与未发酵的三华李果汁相比,经益生菌发酵的三华李果汁的pH 和可滴定酸均发生了显著性变化(P<0.05)。经Pearson 检验,益生菌发酵三华李果汁的pH 与其可滴定酸含量呈显著负相关(r=-0.948,P<0.05)。与空白组相比,三华李果汁发酵48 h 后,FSPJLM 中可滴定酸含量显著升高导致其pH 下降(P<0.05),而经LF、LR、LP 发酵的三华李果汁的可滴定酸含量显著降低(P<0.05),因此,FSPJLF,FSPJLR 和FSPJLP 的pH 均显著高于未发酵三华李果汁(P<0.05)。而在Sun 等[19]的研究中,杏汁经LP 发酵后其pH 降低,这可能是由于果汁基质的糖酸组成及益生菌特性不同所致。

图2 不同益生菌发酵三华李果汁的pH 和可滴定酸含量Fig.2 pH and titratable acid content of Sanhua plum juice fermented by different probiotics
2.3 不同益生菌对发酵三华李果汁颜色的影响
不同益生菌发酵三华李果汁的色差值如表1 所示,L*表示明暗度,a*表示红绿度,b*表示黄蓝度,Hue为样品的色度角,ΔE表示总色差。其中,Hue接近于0°时,颜色偏向于红色;Hue接近于90°,颜色接近于黄色;Hue接近于180°,颜色接近于绿色;Hue接近于270°时,颜色接近于蓝色[20]。由表1 可知,不同三华李发酵果汁的Hue值由大到小为:FSPJLF>FSPJLP>FSPJLR>FSPJLM>CG,且接近于0°,这表明经益生菌发酵三华李果汁和未发酵三华李果汁均呈红色,且三华李果汁的红色度由高到低为:CG>FSPJLM>FSPJLR>FSPJLP>FSPJLF,这与a*的测定结果趋于一致。此外,四种益生菌发酵果汁中,经LM 发酵的三华李果汁的L*、a*和b*值与未发酵三华李果汁最为接近,其ΔE也最小,这可能是因为FSPJLM 的pH 低,较低的pH 有利于呈色物质(花色苷)的稳定[21]。然而,发酵过程中会产生一些褐色物质,这些褐色物质降低了三华李果汁的明亮度及黄蓝度,掩盖了果汁本身的红色度[17],从而导致发酵三华李果汁的颜色与未发酵三华李果汁出现差异(ΔE>3)。

表1 不同益生菌发酵对三华李果汁颜色的影响Table 1 Influence of different probiotic fermentations on the colour of Sanhua plum juice
2.4 不同益生菌对发酵三华李果汁有机酸组分的影响
由图3 可知,空白组主要以苹果酸(4.80 mg/mL)为主,其次是草酸(1.34 mg/mL)和酒石酸(0.34 mg/mL)。发酵48 h 后,FSPJLM、FSPJLF、FSPJLR 和FSPJLP 中的苹果酸含量显著降低(P<0.05),并产生了乳酸。FSPJLF、FSPJLR 和FSPJLP 中的乳酸含量远远高于FSPJLM。此外,LF、LR 和LP 发酵三华李果汁的过程中会产生一定含量的乙酸;与空白组相比,LM 对三华李果汁的草酸和酒石酸含量无显著影响(P>0.05),而经LF、LR 和LP 发酵三华李果汁的草酸和酒石酸含量均出现显著性变化(P<0.05)。以上结果表明LF、LR 和LP 会消耗三华李果汁中的碳源物质从而大量生成乳酸和乙酸,这与之前的报道是一致的[22]。此外,LM、LF、LR 和LP 均有转化三华李果汁中苹果酸生成乳酸或乙酸的能力,从而丰富三华李果汁的风味[23]。
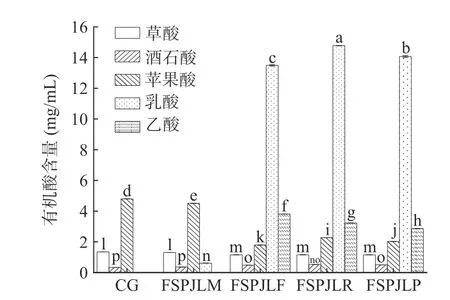
图3 不同益生菌发酵三华李果汁的有机酸含量Fig.3 Organic acid contents of Sanhua plum juice fermented by different probiotics
2.5 不同益生菌对发酵三华李果汁活性物质和抗氧化能力的影响
由表2 可知,与空白组相比,经LM 发酵得到的三华李果汁总酚含量升高,而经LF 发酵的三华李果汁总酚含量显著下降(P<0.05),LR 和LP 发酵未使三华李果汁的总酚含量发生显著变化(P>0.05)。有研究表明,益生菌发酵可产生新的酚类衍生物或增加游离形式的酚类物质从而使其总酚含量增加。然而,酚类物质易降解,且不同菌株代谢酚酸衍生物的能力具有差异性,发酵果汁中的酚类物质含量存在下降的可能性[24-25]。因此,在发酵过程中,果汁基质、发酵菌株类型以及发酵条件共同影响着酚类化合物的总含量。此外,不同益生菌发酵的三华李果汁总黄酮均呈现不同程度的下降,其中FSPJLF 总黄酮含量下降最多,发酵48 h 后其总黄酮含量仅为空白组的86.59%。FSPJLM、FSPJLR 和FSPJLP 中总黄酮含量分别下降了4.60%、5.75%和1.15%。在益生菌发酵橙汁中也观察到类似的现象,植物乳杆菌、鼠李糖乳杆菌、干酪乳杆菌和发酵乳杆菌均对橙汁中的黄酮类物质具有显著的降解作用[26]。果汁中黄酮类物质总含量的降低主要是因为乳酸菌将果汁中复杂的黄酮类物质代谢为简单的化合物[27]。
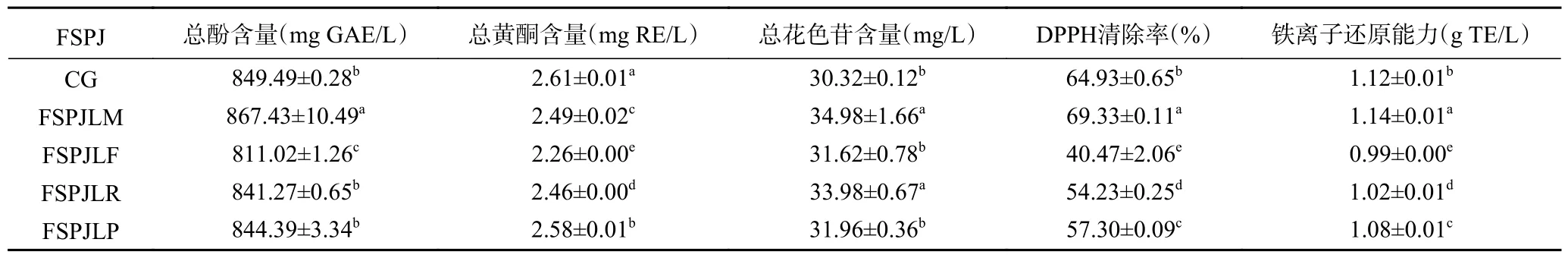
表2 不同益生菌发酵三华李果汁的活性物质含量及抗氧化活性Table 2 Active substances contents and antioxidant activities of Sanhua plum juice fermented by different probiotics
与空白组相比,发酵48 h 后,FSPJLM 和FSPJLR的总花色苷含量有所上升,而FSPJLF 和FSPJLP 的总花色苷含量无显著变化(P>0.05)。三华李发酵果汁中总花色苷含量的上升可归因于乳酸菌的代谢和生物转化[28]。其次,较低pH 下花色苷结构的稳定性较高,这可能也是FSPJLM、FSPJLF 和FSPJLR 中花色苷保留率较好的重要因素之一[20]。而FSPJLP在发酵后pH 有所上升但花色苷含量无显著性变化以及LM 发酵的三华李果汁总花色苷含量的大幅上升的可归结于微生物的转化和低pH 环境稳定花色苷结构稳定的共同作用。
随后,对不同发酵三华李果汁的抗氧化活性也进行了分析,DPPH 清除率和铁离子还原能力测定结果显示,未发酵三华李果汁和发酵三华李果汁之间的抗氧化活性均存在显著性差异(P<0.05),且发酵三华李果汁的抗氧化活性与其活性物质含量密切相关。三华李果汁抗氧化活性由高到低为:FSPJLM>CG>FSPJLP>FSPJLR>FSPJLF。将发酵三华李果汁的抗氧化活性与其总酚、总黄酮和总花色苷含量进行相关性分析(表3),不同发酵三华李果汁的总酚含量与其DPPH 自由基清除率和铁离子还原能力呈显著正相关(P<0.05),因此可以推断,不同益生菌发酵三华李果汁的抗氧化性主要受果汁中酚类物质的影响。有研究表明,乳酸菌混合发酵不同品种红枣汁的DPPH 清除率自由基与铁离子还原能力同样受其酚类物质含量的影响,并与其中咖啡酸、芦丁等分类物质含量呈显著性正相关[29]。综合以上结果发现,四种益生菌中,LM 能够有效提升三华李果汁总酚含量、总花色苷含量和抗氧化水平,且其能够较好地保留果汁中的黄酮类物质,是三华李果汁的潜在发酵剂。

表3 不同益生菌发酵三华李果汁的活性物质含量及抗氧化活性间的相关性分析Table 3 Correlation analysis of active ingredients contents and antioxidant capacity of Sanhua plum juice fermented by different probiotics
2.6 不同益生菌对发酵三华李果汁生物利用度的影响
2.6.1 体外消化过程三华李发酵果汁中益生菌活菌数的变化 未经消化的三华李发酵果汁益生初始活菌数在108CFU/mL 左右(表4)。体外消化结束后,FSPJLM 中未检测到活菌,FSPJLF、FSPJLR 和FSPJLP 中活菌数均处于106的水平,表明LF、LR和LP 在以三华李果汁为发酵基质时均能够顺利通过人体的上消化道到达结肠为人体所利用。其中,FSPJLF 和FSPJLP 经口和经胃消化后其活菌数未出现较大幅度的变化,在经肠液消化后仍具有较高的益生菌活菌数,说明三华李发酵果汁中的LF 和LP 对唾液和胃液有较好的耐受能力,且经肠消化后仍保留较高的活性。
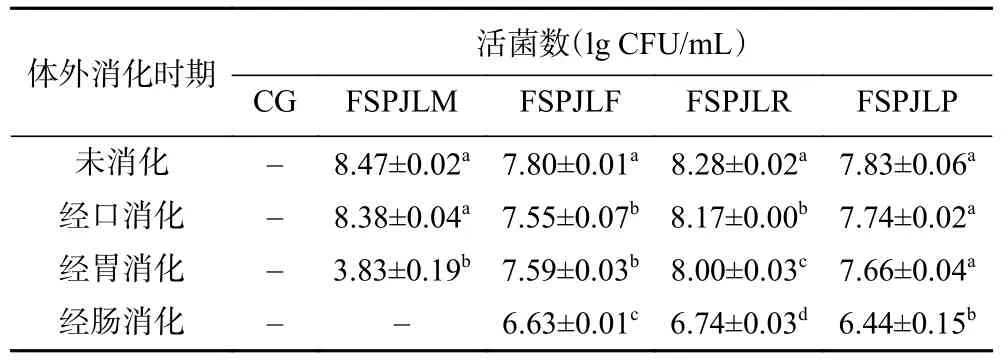
表4 不同益生菌发酵三华李果汁体外消化过程中益生菌活菌数变化Table 4 Changes of probiotics viable counts of in Sanhua plum juice fermented by different probiotics during in vitro digestion
2.6.2 体外消化过程中三华李果汁总酚、总黄酮及总花色苷含量的变化 由图4A 可知,所有三华李发酵果汁的总酚含量在体外消化过程中均呈现下降趋势。酚类物质的稳定性在体外消化过程中会受到模拟体系中多种因素的影响。有研究表明,模拟体系中的消化酶会使酚类化合物分解,不同的无机离子能够促进或抑制多酚物质的降解[30-31]。此外,总酚含量在体外模拟过程中的变化与酚类化合物同食品基质的结合状态有关[32]。当果汁中的酚类物质同沉淀物中的食品基质结合时,胃部的低pH 环境和胃蛋白酶会促进酚类物质从食品基质中的释放,从而使消化液中的酚类含量升高,而对于游离态的酚类物质,胃部pH 的变化会使酚类化合物在其胃消化过程中会发生氧化、去糖基化、水解、转化和裂解反应而被转化成与初试化合物完全不同的代谢物[33]。在本实验中,五种三华李果汁样品的总酚含量在经口消化阶段仅出现小幅度的下降,而在经胃和经肠阶段呈现出较大程度的下降,与牛至中酚类化合物在体外消化过程中变化趋势一致[34]。三华李果汁经口消化后总酚含量的下降是因为无机离子与α-淀粉酶的共同作用导致果汁中多酚在经口消化过程中轻微降解。而经胃消化阶段总酚含量的显著性下降则可能是因为三华李果汁中仅有少量的多酚化合物与蛋白质等大分子食品基质相结合,而三华李果汁中的游离态酚类物质含量较高,经胃消化后,酚类物质的降解和转化远高于酚类物质的释放,因此,由Folin-Ciocalteu 比色法测得的总酚含量呈现出显著性的下降[35]。而由于酚类化合物在肠道碱性pH 下的不稳定性以及胰蛋白酶的降解作用,在经肠消化阶段酚类化合物含量则多倾向于发生显著性的降低,在许多研究中也发现类似的结果[36-38]。
所有三华李果汁样品的总黄酮含量在经口和经肠消化阶段略有下降,而经胃消化阶段呈现大幅下降(图4B),这可归因于胃消化阶段的低pH 所导致的黄酮的大量降解,而口和肠消化阶段的环境为较温和的中性环境,对黄酮的影响较小,在类似的研究中有相似的结果[39]。
三华李果汁样品中的总花色苷含量经口和胃消化后出现上升的趋势,而经肠消化后出现显著的下降(图4C),其变化趋势与Mcdougall 等[40]的研究结果相同。这可能是因为金属离子的螯合作用使得花色苷能够保持结构的稳定而未被降解;而低pH 环境和消化酶的作用有利于花色苷的游离[41]。研究表明,胃蛋白酶的添加使黑加仑果汁中的花色苷在胃液中的释放量增大,而胰蛋白酶则使花色苷在肠液中的损失量增大[41]。此外,花色甘在模拟肠液的pH 下,主要以无色查尔酮假基碱基分子形式存在,在温度等因素的影响下,其B 和C 环之间发生裂变而致使其含量的下降。也有研究表明,有机酸(如草酸等)能够对花色苷具有护色作用,且护色效果与有机酸含量成正相关[42],在胃部pH 条件下,有机酸可以稳定存在,而当消化进行到肠部时,果汁中的有机酸在碱性条件下易与阳离子生成盐或不溶性沉淀物而失去其护色作用,这也可能是发酵三华李果汁花色苷含量在经胃阶段上升而在经肠阶段下降的原因。
2.6.3 体外消化过程中三华李果汁抗氧化性的变化
由图5 可知,五种三华李果汁样品的抗氧化性总体呈现下降的趋势,与其总酚含量在体外消化过程中的变化趋势一致,这与预期一致。其中,四种三华李果汁样品的铁离子还原能力(图5B)经口消化后均未出现显著性下降(P>0.05)。软枣猕猴桃游离酚类提取物的体外消化过程也呈现出相似的现象,其抗氧化性经口消化后并未表现出明显的下降[35]。这可能是由于经口消化阶段pH 比较温和,不会对酚类化合物稳定性产生较大的影响,此外,α-淀粉酶和无机离子对三华李发酵果汁的总酚含量及抗氧化性的影响也较小。不同三华李发酵果汁的抗氧化活性在经胃和经肠消化阶段呈现出显著性下降(P<0.05),这可能主要与pH 的降低以及酚类物质的降解有关。有研究表明,pH 会对抗氧化物质的构型产生影响,进而影响其反应性,随着pH 的升高,抗氧化物质的反应性随之降低,在肠液pH 环境(pH7.0±0.2)下抗氧化物质的反应性较低也是三华李发酵果汁经肠消化后抗氧化活性降低的原因之一[36]。

图5 不同益生菌发酵三华李果汁体外消化过程中DPPH 自由基清除率(A)及铁离子还原能力(B)的变化Fig.5 Changes of DPPH radical scavenging rate (A) and ferric ion reducing antioxidant power (B) of Sanhua plum juice fermented by different probiotics during in vitro digestion
3 结论
本研究系统解析了LM、LF、LR 和LP 四种不同益生菌对三华李果汁理化性质、活性物质、抗氧化能力和体外消化特性的影响。结果表明,经发酵48 h 后四种发酵三华李果汁中益生菌活菌数均处于107~108CFU/mL 之间。由于益生菌发酵特性的差异,经LM 发酵的三华李果汁pH 下降,可滴定酸含量升高,而其他三种三华李发酵果汁的pH 和可滴定酸含量变化趋势则与之相反。此外,四种菌均可消耗三华李果汁中的苹果酸,并合成乳酸,其中经LF、LR 和LP 发酵的三华李果汁中乳酸含量远高于FSPJLM。与此同时,FSPJLM 与未发酵三华李果汁的颜色最为相近,这可能是由于其低pH 环境较好地保留了三华李果汁中的花色苷。与未发酵三华李果汁相比,经LM 发酵的三华李果汁其总酚、总花色苷含量以及抗氧化活性均出现显著性升高,而经LF、LR、LP 发酵的三华李果汁总酚含量则略有下降,这主要是由于菌株特异性造成的。从四种益生菌发酵的三华李果汁总黄酮含量普遍下降和总花色苷含量普遍上升的趋势来看,在发酵过程中部分类黄酮物质可能被发酵菌株转化为花色苷类物质。
体外消化模拟结果显示,LM 对胃肠道消化极不耐受,FSPJLM 经体外消化后未检测到活菌;与之相反,发酵效果较差的LF 表现出良好的胃肠道耐受性。此外,发酵三华李果汁的总酚、总黄酮及抗氧化活性在体外消化过程中均呈降低的趋势。综合来看,LP 和LR 对三华李果汁具有较好的发酵特性,且其对胃肠道具有较好的耐受性,可作为益生菌发酵三华李果汁的发酵剂。

