隆中对酒业中温大曲真菌类群与理化特性相关性研究
贺子豪,马佳佳,王俊麟,刘博文,张 莹,郭 壮,王玉荣,
(1.湖北文理学院湖北省食品配料工程技术研究中心,湖北襄阳 441053;2.襄阳市酿酒生物技术与应用企校联合创新中心,湖北襄阳 441053;3.湖北隆中对酒业有限公司,湖北襄阳 441053)
作为市场消费较为广泛的香型,浓香型白酒因绵甜柔顺的口感而深受广大消费者的喜爱,其销售量约占整个白酒市场的70%[1]。白酒,因香而生,因曲而制,大曲作为白酒酿造的重要原料,在发酵过程中不仅提供代谢和降解谷物原料所需的微生物和酶[2],亦会产生多种呈香风味物质,例如酯类、醇类、有机酸类、酮类和醛类等[3]。FAN 等[4]对大曲的研究表明,大曲中微生物群系与其理化性质或风味化合物存在显著相关性;YANG 等[5]采用宏基因组学技术对中温大曲在自然发酵过程中理化性质、微生物群落和挥发性化合物的动态变化进行了研究,发现大曲的品质可以显著影响其白酒产品的感官特性,且参与风味物质合成的微生物其代谢作用各不相同。由此可见,大曲的理化特性和风味特性与白酒的品质息息相关,且大曲中微生物群系的生长代谢亦可间接影响白酒的品质。
随着Illumina MiSeq 高通量测序技术的发展,研究人员利用该项技术对大曲中拥有的微生物类群及其代谢能力进行了更为深入地了解。张清玫等[6]利用高通量测序技术揭示了不同香型中温大曲中的特征菌属为芽孢杆菌属(Bacillus)、梗霉属(Lichtheimia)和酵母属(Saccharomyces),其代谢活动有利于四甲基吡嗪和2,3-丁二醇挥发性风味物质的生成;MA 等[7]利用高通量测序技术揭示了不同产区中温大曲中主要真菌属为嗜热子囊菌属(Thermoascus)、嗜热真菌属(Thermomyces)、曲霉属(Aspergillus)、复膜孢酵母属(Saccharomycopsis)和伊萨酵母属(Issatchenkia),其代谢活动有利于己酸乙酯和壬酸乙酯等挥发性风味物质的生成;DENG 等[8]利用高通量测序技术揭示了四川地区中温大曲中主要真菌属为链格孢属(Alternaria)、根霉属(Rhizopus)和毕赤酵母属(Pichia),其代谢活动有利于异戊醛、苯甲醛、2-n-淀粉呋喃、丙基壬基内酯和苯乙醛等挥发性风味物质的生成。由此可见,中温大曲中含有丰富的真菌类群,且因酿造工艺和地域环境的不同,其真菌群落结构及代谢风味物质亦呈现出不同的差异。因此,积极探索不同来源中温大曲的真菌类群是极为必要的。
襄阳市位于湖北省西北部,居于汉水中游,既有滔滔汉水流经,又有干冷、暖湿空气交绥,属北亚热带季风气候。目前研究人员针对该地区中温大曲的研究多集中在对其微生物类群的解析,而在微生物类群与理化特性和感官特性的相关性方面研究尚少。本研究以该地区湖北隆中对酒业有限公司中温大曲为研究对象,采用MiSeq 高通量测序技术和传统纯培养技术对大曲中真菌群落结构进行解析的同时,借用电子鼻和常规检测方法对其风味品质和理化特性进行了评价,并进一步对真菌类群与风味品质的相关性进行了分析,以期为襄阳地区中温大曲品质的提升和后续工业化生产提供理论依据和参考。
1 材料与方法
1.1 材料与仪器
中温大曲 采集自湖北省襄阳市湖北隆中对酒业有限公司酿造车间的同一批次成品曲库,随机抽取样品共10 份,编号分别为LZZW1~LZZW10,返回实验室后及时粉碎后一式三份:一份暂存于4 ℃用于微生物的分离鉴定,其余两份份存于-20 ℃下用于测序、理化和感官指标及留样;马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA)北京奥博星生物技术有限责任公司;引物ITS3F/ITS4R、ITS1/ITS4和M13F(-47)/M13R(-48)均由武汉天一辉远生物科技有限公司合成;克隆载体pMD18-T 大连宝生物工程有限公司;DNeasy mericon Food Kit DNA 基因组提取试剂盒 德国Qiagen 公司;5×TransStartTMFastPfuBuffer、dNTPs Mix、FastPfuFly DNA Polymerase 北京全式金生物技术有限公司。
2500Y 高速多功能粉碎机 永康市铂欧五金制品有限公司;PEN3+EDU3 电子鼻 德国Airsense公司;AND 日本MS-70 快速水分测定仪 上海右一仪器有限公司;AW-1 水分活度仪 无锡碧波电子设备厂;K1100 全自动凯式定氮仪 山东海能科学仪器有限公司;LRH-70 生化恒温培养箱 上海力辰仪器科技有限公司;Veriti FAST PCR 仪 美国ABI 公司;DYY-12 电泳仪 北京六一仪器厂;UVPCDS 8000 凝胶成像分析系统 美国ProteinSimple 公司;Illunima MiSeq PE300 高通量测序平台 美国Illumina 公司;R930 机架式服务器 美国DELL 公司。
1.2 实验方法
1.2.1 中温大曲理化指标的测定 根据行业标准《QB/T 4257-2011 酿酒大曲通用分析方法》规定的方法测定大曲的酸度、氨基酸态氮、淀粉含量、糖化力、酯化力、发酵力、液化力和酒化力;使用快速水分测定仪测定大曲的水分含量[9];使用水分活度仪测定大曲的水分活度;使用全自动凯式定氮仪测定大曲中蛋白质含量[10]。每项指标均重复测定三次再求取平均值,以确保数据结果的准确性。
1.2.2 中温大曲风味品质的评价 准确称取15 g 大曲样品于电子鼻专用样品瓶中,室温状态下放置30 min,参照刘芳等[11]的测定方法对电子鼻参数进行设置,数据处理时选取已达到平稳状态的49、50 和51 s 三个时间点传感器响应值的平均值作为测试值。
1.2.3 基于高通量测序中温大曲真菌多样性分析使用试剂盒从中温大曲中提取微生物宏基因组DNA,参照陈怡等[12]的方法,使用引物ITS3F/ITS4R(ITS3F:5'-GCATCGATGAAGAACGCAGC -3'和ITS 4R:5'-TCCTCCGCTTATTGATATGC -3')对真菌ITS区域进行PCR 扩增,将检测合格的扩增产物寄往上海美吉生物医药科技有限公司进行Illumina MiSeq高通量双端测序。
参照WANG 等[13]的方法对测序生成的双端序列进行合并与质控,利用QIIME(v1.9.1)分析平台对保留序列进行PyNAST 校准与对齐;UCLUST 聚类并划分分类操作单元(operational taxonomic unit,OTU);ChimeraSlayer 剔除嵌合体;与RDP、Greengenes 和SILVA 数据库比对明确各分类学地位[14]。
1.2.4 酵母菌的分离鉴定 采用倍比稀释涂布法对中温大曲中疑似酵母菌进行初分离,28 ℃培养3 d,继而对具有典型酵母菌形态特征的单菌落进行三次划线纯化并备份菌落形态,经革兰氏染色后镜检并保存显微镜形态,最后将菌株进行30%甘油保藏[15]。使用消解酶-氯化苄法对分离株进行DNA 提取,并参照赵慧君等[16]的方法对合格的DNA 产物进行后续ITS 区的扩增、清洁、连接、转化和测序,将返回的序列去引物后上传至NCBI 网站(https://www.ncbi.nlm.nih.gov/)进行BLAST 比对,并下载标准菌株序列与测定的序列一起进行系统发育树的构建,进而明确各菌株分类学地位。
1.3 数据处理
使用GraphPad Prism 9 软件绘制中温大曲各理化指标的小提琴图;使用Origin 2017 软件绘制真菌门属群落结构的堆积条形图;使用R 软件绘制优势真菌属与各理化指标的冗余分析(RDA)图;使用Cytoscape 软件(v3.7.2)绘制优势真菌属与理化指标的相关性网络图;使用MEGA 7.0 软件构建分离株系统发育树。
2 结果与分析
2.1 中温大曲理化特征和风味品质的分析
理化性质的测定可映射大曲发酵时的状态和发酵后的质量,电子鼻技术的使用可对大曲所挥发的不同气体进行定性识别和定量检测[17]。本研究首先对中温大曲各理化指标进行了测定,结果如表1 所示。
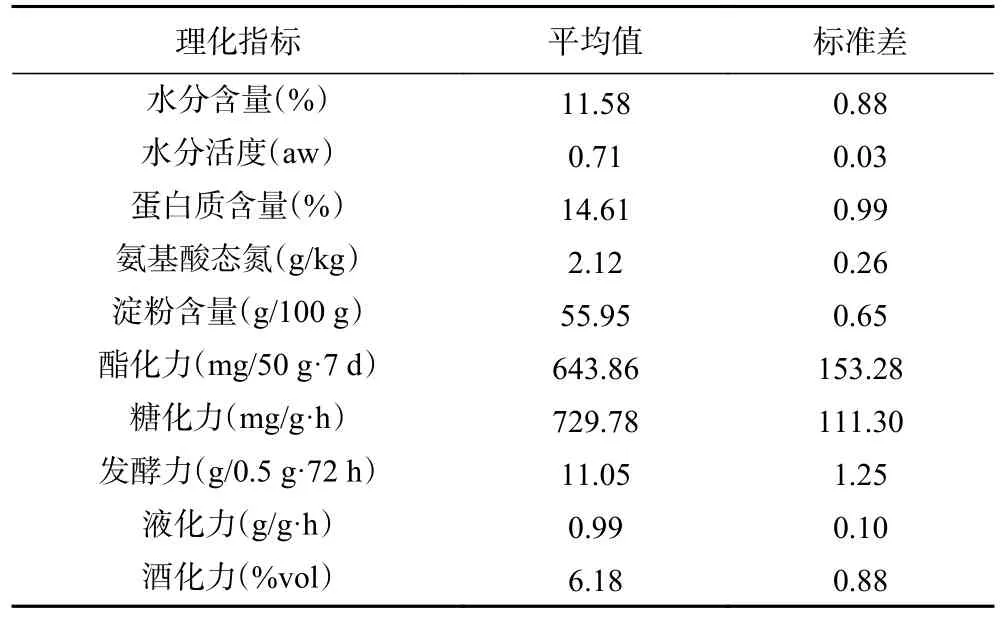
表1 中温大曲各理化指标分析Table 1 Analysis of physicochemical indexes of mediumtemperature Daqu
由表1 可知,纳入本研究的10 份中温大曲中其酯化力平均值为643.86 mg/50 g·7 d,标准差为153.28,其糖化力平均值为729.78 mg/g·h,标准差为111.30。这两项理化指标在样品中数值波动较大,且与其余8 个理化指标标准差相比明显偏高,推测其原因,这可能与大曲摆放的空间位置和储存的周围环境有关[18]。除此之外,经数据核验,所有中温大曲样品其各理化指标均符合QB/T 4259-2011《浓香大曲》要求。尉嘉眙等[19]对不同工艺类型大曲的理化指标与酿造所得酒样风味的相关性进行分析发现,大曲的酯化力与β-苯乙醇和乙醛呈显著负相关(P<0.05);而大曲的糖化力与霉菌数量呈正相关[20],可见大曲理化指标的测定结果间接反映了真菌类群的丰度与代谢[21]。电子鼻中传感器W1S、W5S 和W6S 主要用于评价空气中挥发性风味物质含量[22],因而进行了屏蔽。本研究进一步对大曲样品的风味品质进行了评价,其小提琴图见图1。

图1 中温大曲风味品质评价Fig.1 Analysis of flavor quality of medium-temperature Daqu
由图1 可知,仅有传感器W1W(对有机硫化物、萜类物质灵敏)和W2S(对乙醇灵敏)对10 份中温大曲的平均响应强度大于4,可见隆中对酒业中温大曲的挥发性物质主要体现在有机硫化物、萜类物质和乙醇上。此外,本研究样本中W1W 传感器响应值的平均值大于10,变异系数为8.98%,说明纳入本研究的中温大曲在风味指标上的差异主要表现在有机硫化物和萜类物质上。
2.2 中温大曲真菌多样性分析
基于MiSeq 高通量测序技术,本研究对各中温大曲的测序结果和α多样性指数进行了分析,结果如表2 所示。
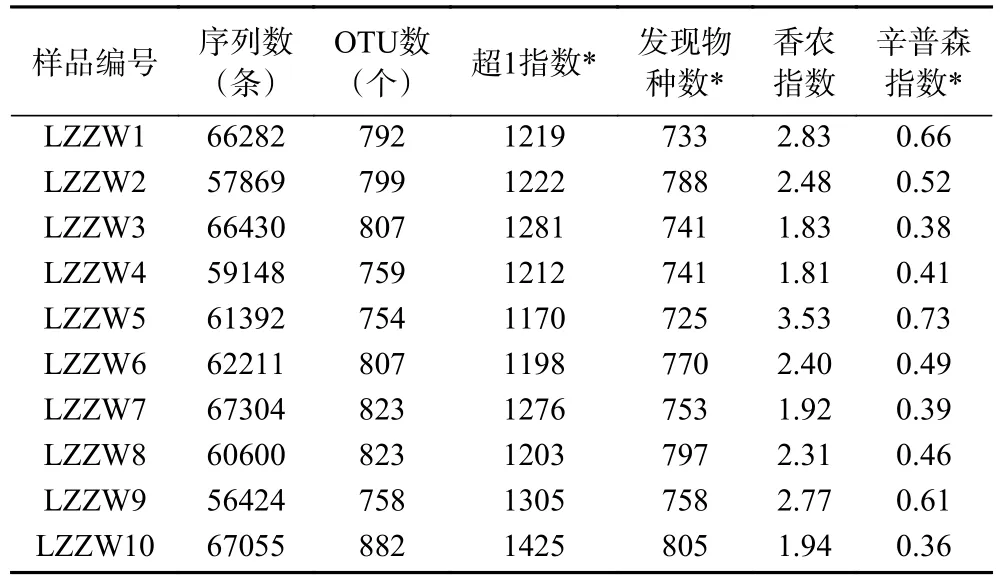
表2 不同中温大曲的真菌α 多样性统计分析Table 2 Statistical analysis of fungal α diversity of different medium-temperature Daqu
由表2 可知,纳入本研究的中温大曲共产生624715 条优质真菌ITS 序列,每份样品平均62472条,去除嵌合体OTU 后,共得到8004 个OTU。当测序深度达到56010 时,样品LZZW10 的超1 指数和发现物种数最高,分别为1425 和805;样品LZZW5 的香农指数和辛普森指数最高,分别为3.53 和0.73,由此可见,样品LZZW10 的真菌物种丰富度最高,LZZW5 的真菌群落多样性最高。
本研究进一步在门和属水平上对大曲真菌群落结构进行了解析,其中将平均相对含量>1.0%的真菌门和属定义为优势真菌门和属,其堆积条形图如图2所示。
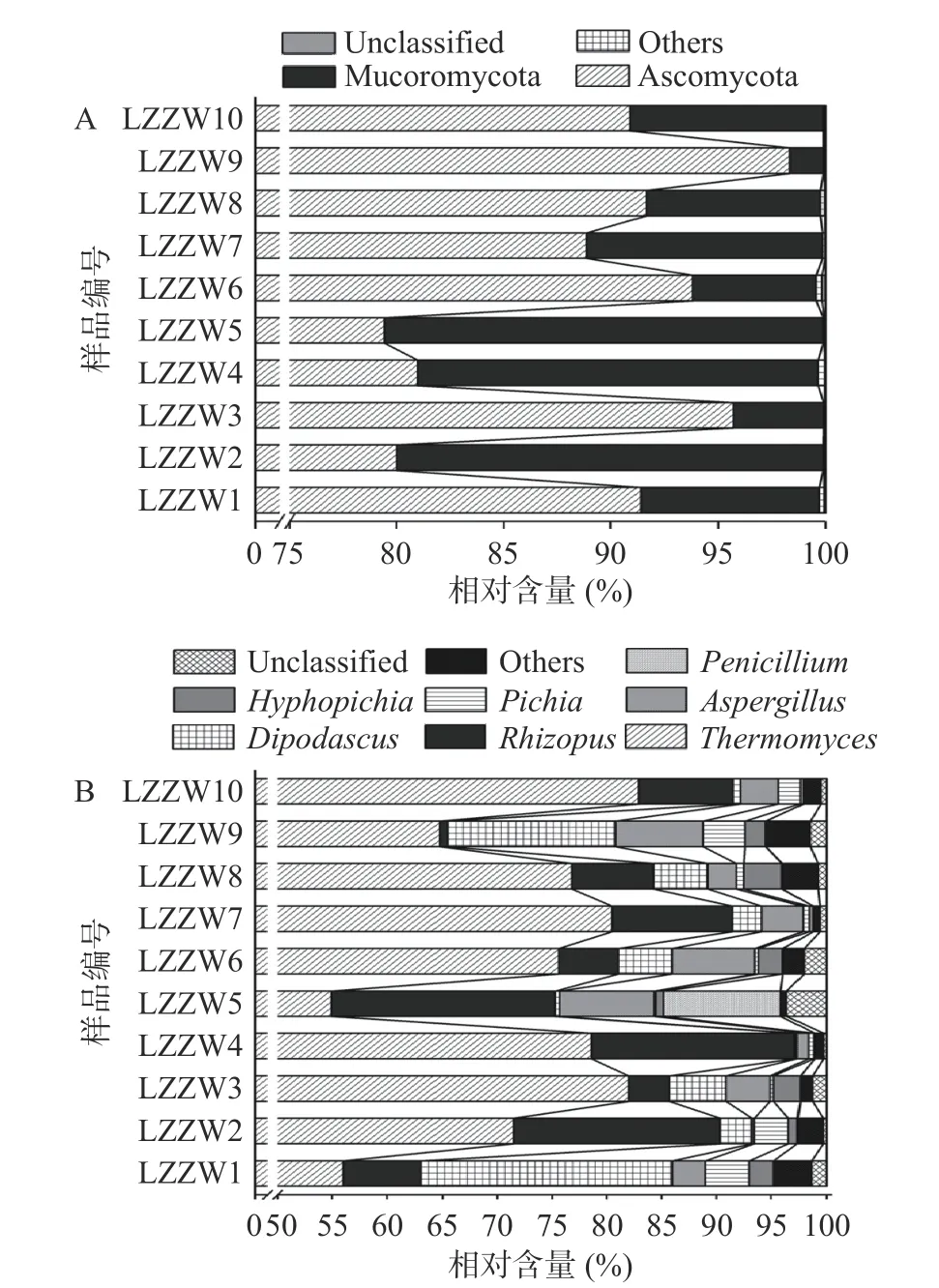
图2 基于门(A)和属(B)水平平均相对含量>1.0%的真菌群落结构分析Fig.2 Analysis of fungal community structure with average relative abundance of >1.0% based on the phylum (A)and genus (B) levels
由图2A 可知,中温大曲中存在2 个优势真菌门,分别为子囊菌门(Ascomycota)和毛霉门(Mucoromycota),其平均相对含量分别为89.11%和10.70%;由图2B 可知,中温大曲中存在7 个优势真菌属,分别为嗜热真菌属(Thermomyces)、根霉属(Rhizopus)、双足囊菌属(Dipodascus)、曲霉属(Aspergillus)、毕赤酵母属(Pichia)、丝孢毕赤酵母属(Hyphopichia)和青霉属(Penicillium),其平均相对含量分别为72.36%、10.18%、6.00%、4.22%、1.54%、1.44%和1.08%,这与LIU 等[23]对河南郑州地区中温大曲的真菌类群研究结果存在一定的相似性。
2.3 酵母菌菌株的分离鉴定分析
本研究进一步采用传统纯培养技术对中温大曲中的可培养酵母菌进行了分离,其中具有代表性的2 株酵母菌分离株其菌落形态和显微镜形态如图3所示。

图3 部分分离株的菌落形态和显微镜形态Fig.3 Colony morphology and microscopic morphology of some isolates
由图3 可知,部分菌株的菌落形态表面粗糙呈毛状,边缘为锯齿形,中间有白色突起,大菌落,颜色为不透明的白色,细胞在电子显微镜下呈椭圆状;另一部分菌株的菌落形态为圆形,表面光滑隆起,边缘规整,小菌落,颜色为不透明的白色,在显微镜下亦呈椭圆状。本研究进一步对分离得到的酵母菌分离株其基因序列进行系统发育树的构建,结果如图4所示。

图4 分离株的系统发育树Fig.4 Phylogenetic tree of isolates
由图4 可知,分离到的25 株酵母菌菌株共聚为两大支,其中有14 株酵母菌菌株聚为一支被鉴定为Saccharomycopsis fibuligera(扣囊复膜孢酵母),占总分离株的56.0%;另有11 株聚为另一支被鉴定为Wickerhamomyces anomalus(异常威克汉姆酵母),占总分离株的44.0%。
2.4 中温大曲真菌类群与理化指标及风味品质的关联分析
通过上述分析发现,理化因子数值的波动会使得中温大曲的品质和风味产生一定的差异,真菌类群的生长代谢活动亦会对大曲的风味品质造成一定的影响。为进一步探索真菌类群、理化特性和风味品质之间的联系,本研究采用RDA 和相关性网络图对三者之间的关联性进行了可视化分析,结果如图5所示。
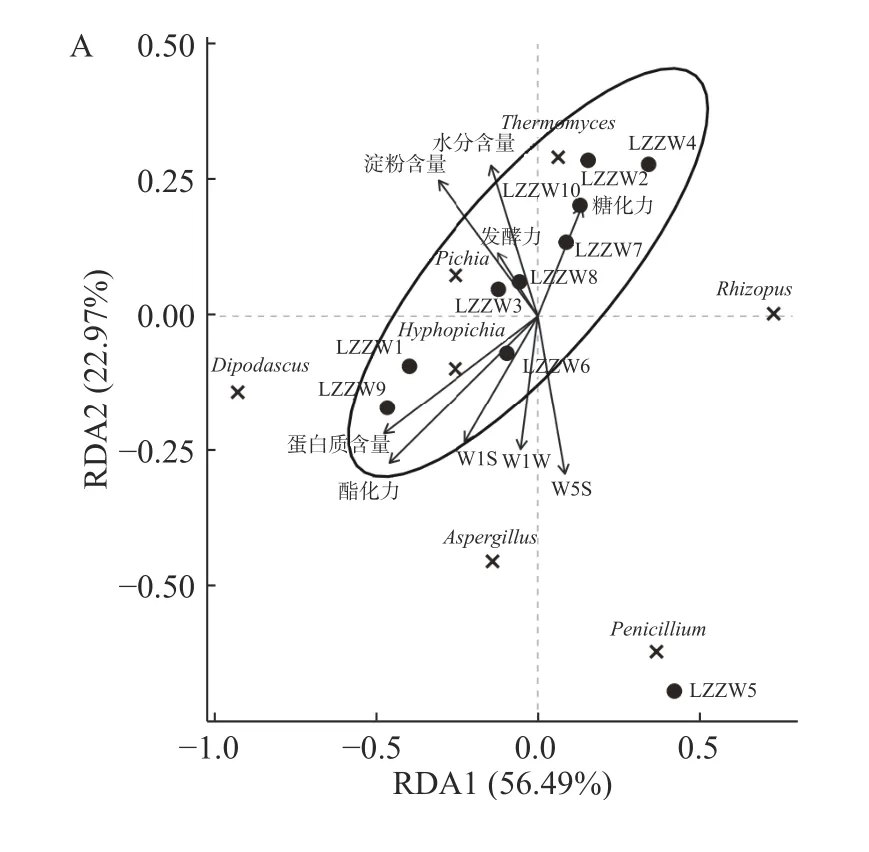
由图5A 可知,RDA1 和RDA2 的累计方差贡献率为79.46%,样品LZZW5 与其他样品之间呈离散状态,而糖化力、水分含量、淀粉含量、发酵力、蛋白质含量、酯化力和W1S 等指标与其他9 份样品之间的相关性较强。由图5B 可知,Thermomyces与酸度呈极显著负相关(P<0.01);Pichia与W2S 传感器响应值呈显著正相关(P<0.05);Penicillium与发酵力呈显著负相关(P<0.05);Hyphopichia与W5C 传感器响应值呈显著正相关(P<0.05)。
3 讨论与结论
“曲乃酒之骨”,大曲的理化特性和风味特性在一定程度上可影响白酒的品质。本研究通过对隆中对酒业中温大曲理化特性的测定结果进行分析,发现大曲在糖化力和酯化力指标上数值波动比较大。有研究指出,由于大曲中Rhizopus和Aspergillus等霉菌通过分泌水解酶来转化原料,因而其糖化力会显著影响风味化合物的代谢[24]。高蛋白酶活性可以促进发酵过程中原料中的蛋白质转化为氨基酸,进而形成提供风味化合物的α-酮酸和糠醛等化合物[25]。因而本研究进一步对大曲挥发性风味物质进行了测定,结果发现大曲挥发性风味物质主要体现在有机硫化物和萜类物质上,且通过SONG 等[26]的研究发现,有机硫化物2-甲基-3-呋喃硫醇和2-糠基硫醇对浓香型白酒的香气特征具有一定的贡献。
MiSeq 高通量测序结果显示隆中对酒业中温大曲中蕴含多种真菌类群,其优势真菌属分别为Thermomyces、Rhizopus、Dipodascus、Aspergillus、Pichia、Hyphopichia和Penicillium,且基于传培养技术发现S.fibuligera和W.anomalus为大曲中可培养的优势酵母菌。中温大曲在发酵过程中其培养温度一般控制在50~60 ℃,随着大曲发酵温度的升高,嗜热真菌类群逐渐成为优势真菌[27],ZHOU 等[28]的研究发现,Thermomyces在大曲发酵过程中会产生木聚糖酶和蛋白酶等酶类来降解原料中的糖类和蛋白质;Rhizopus、Aspergillus和Penicillium等霉菌属亦可分泌淀粉酶、蛋白酶和脂肪酶等从而对曲块原料中的大分子物质进行降解[29],这为大曲发酵后期其他微生物的生长繁殖提供了充足的营养物质。值得一提的是,Penicillium在各样品中分布明显不均,且在样品LLZW7 和LLZW10 中均未检测到该菌属的存在。有研究指出,Pichia和Hyphopichia等酵母菌属为白酒发酵过程中的重要功能微生物,在生长代谢过程中可与其他微生物相互作用产生乙酸乙酯和4-羟基-2-丁酮等风味物质[30];Dipodascus在白酒酿造过程对酸类和醇类化合物具有较强的酯化能力[31],有利于促进白酒酒体风格的形成。亦有研究指出,S.fibuligera和W.anomalus均为大曲中的优势酵母菌株,不仅能够产淀粉酶、酸性蛋白酶和β-葡萄糖苷酶等降解原料中的生物大分子进行发酵,还可产香产酯,促进白酒呈香风味物质的形成[32]。
相关性研究进一步证实了微生物在大曲中对其理化特性和风味特性的积极作用。相关性研究发现,Pichia、Hyphopichia和Aspergillus与有机硫化物和芳香类物质的生成存在显著相关性。有研究指出,霉菌属和酵母属被认为是有功能的微生物群,负责形成一系列水解酶、酒精发酵的底物和风味化合物,对于白酒风味品质的提升具有积极影响[33]。然而,在风味品质方面,本研究仅使用电子鼻仿生设备对其挥发性风味物质进行了测定,有研究指出,电子鼻检测到的不是样品中具体气味成分的组成和含量,而是其多种混合气味成分的综合信息[34],因而导致了本研究中大曲真菌类群与风味成分之间相关性较为模糊。因此,在后续相关研究中应进一步扩大对中温大曲样品的采集数量,并进一步结合宏基因组学、感官和色谱分析探究真菌类群对大曲风味品质的影响,以深入揭示中温大曲中微生物生长代谢与浓香型白酒品质之间的潜在联系,为浓香型白酒品质的提升提供数据支撑。

