水解对低盐鸭肉肌原纤维蛋白结构和功能特性的影响
何蜀峰,李孟孟,孙杨赢,2,
(1.宁波大学食品科学与工程学院,浙江宁波 315800;2.浙江省动物蛋白食品精深加工技术重点实验室,浙江宁波 315800)
鸭肉蛋白中富含人体必需的氨基酸和各种营养物质,完全符合人们对健康、营养的需求。我国鸭肉年产量巨大,但是对鸭肉的利用率非常低,利用方式仍停留在传统加工水平,如板鸭、烤鸭等,限制其在食品工业化生产中的应用。肉类中的蛋白质,根据其溶解特性可以分为三大类,即肌浆蛋白(sarcoplasmic protein)、肌原纤维蛋白(myofibrillar protein,MP)和基质蛋白(stromal protein)[1],其中,MP 是肉制品形成良好的质构和品质的重要成分。但是,MP 在低离子强度溶液中的溶解性极差,在离子强度大于0.3 mol/L 盐溶液中的溶解度较好[2],然而,离子强度过高可能会导致盐摄入量超标,导致一系列的健康危害,例如心血管和高血压[3-4]等,限制MP 在食品加工中的应用。因此,需要在符合健康安全的前提下,提高MP 在低盐溶液中的溶解性,从而提高鸭肉在食品生产中的应用。
通常来说,MP 的溶解度与其在溶液中的自组装行为有关[5]。在低盐介质中,MP 分子通过静电相互作用,有规律地自组装成不溶性的丝状聚合物,导致其溶解性较差[6]。为抑制MP 的这种自组装行为,许多方法包括物理(超声、高压均质、高静水压、研磨等)、化学(糖基化、酰基化、酸碱处理等)、酶处理和添加各种物质(多糖、多酚、氨基酸等)已被应用[7-8]。然而,超声虽然效果好,但对超声强度要求特别高,且在处理过程中会伴随热效应的产生[9];糖基化的工艺复杂,耗时长,还会导致赖氨酸/精氨酸的丢失[10]。因此,需要选择适当的方法来改善鸭肉MP 在低盐溶液中的溶解度。水解处理通过切割蛋白质内部的肽键,将大分子蛋白分解成小分子的片段[11-12],同时暴露出更多的亲水性侧链基团,提高蛋白在溶液体系中的溶解度[8]。该处理方式效率高,条件温和,效果明显,且不会导致蛋白品质劣化。
目前关于水解处理MP 主要应用于猪肉、牛肉和鸡肉中,水解处理对低盐鸭肉MP 结构和功能特性的影响效果不明确。因此,本文以鸭肉MP 为原料,探究水解技术对其结构和功能特性的影响,通过溶解度、表面疏水性和乳化性分析其性质变化,SDSPAGE、二级结构、内源性色氨酸荧光和Zeta 电位分析其结构变化,以期提高鸭肉MP 在低盐溶液中的溶解度,为鸭肉在食品生产中的应用提供理论基础。
1 材料与方法
1.1 材料与仪器
新鲜鸭肉 购买于浙江省宁波市北仑区春晓街道农贸市场;胰蛋白酶(牛胰)(2500 U/g)上海源叶公司;三(羟甲基)氨基甲烷(Tris(hydroxymethyl)aminomethane,Tris)、乙二胺四乙酸(Ethylenediaminetetraacetic acid,EDTA)、乙二醇双(2-氨基乙基醚)四乙酸(Ethylenebis(oxyethylenenitrilo)tetraacetic acid,EGTA)、KCl、K2HPO4、KH2PO4、MgCl2、NaCl、TritonX-100、溴酚蓝(Bromophenol blue,BPB)、十二烷基硫酸钠(Sodium dodecyl sulfate,SDS)、邻苯二甲醛、四硼酸钠、甲醇、二硫苏糖醇、甘氨酸标品 麦克林公司;双缩脲试剂盒(BC3185)索莱宝公司。
电子分析天平 北京赛多利斯仪器系统有限公司;SGJ-2A 磁力搅拌恒温水浴锅 上海硕光电子科技有限公司;XHF-D 高速分散器 宁波新芝生物科技股份有限公司;GL-20B 飞鸽冷冻离心机 上海安亭科学仪器厂;Bio-Rad Mini-Protein 电泳仪、XR+凝胶成像仪 美国Bio-Rad Laboratories 公司;Zeta sizer Nano ZS90 粒子分析仪 英国Malvern Instruments 公司;J-1500 圆二色光谱 日本JASCO 公司;varioskan lux 多功能酶标仪 赛默飞公司。
1.2 实验方法
1.2.1 鸭肉肌原纤维蛋白的提取 鸭肉肌原纤维蛋白的提取方法参考Li 等[13]的方法,并进行适当修改。新鲜的鸭肉剔除筋膜,在绞肉机中搅碎,加入4 倍体积的缓冲溶液(0.1 mol/L Tris、10 mmol/L EDTA,pH8.3),匀浆60 s(10000 r/min,30 s/次,每次间隔5 s),结束后将样品离心(10000×g,20 min,4 ℃),收集沉淀。接着,将沉淀分别与以下四种溶液按照(A,B,A,C,D)的顺序混合,均质(10000 r/min,30 s)并离心(10000×g,4 ℃,10 min),重复3 次(A:20 mmol/L K2HPO4/KH2PO4、1 mmol/L EGTA、2 mmol/L MgCl2、0.1 mol/L KCl,pH7.0;B:A 含有1% Triton X-100;C:0.1 mol/L KCl;D:0.1 mol/L NaCl)。最后将沉淀与4 倍体积的纯水混合均质,通过三层纱布过滤,然后离心(10000×g,4 ℃,10 min),所得沉淀即为鸭肉肌原纤维蛋白。用0.02 mol/L K2HPO4/KH2PO4的磷酸缓冲液(含0.1 mol/L NaCl)溶解所得沉淀,并用双缩脲试剂盒和酶标仪测定蛋白浓度。
1.2.2 胰蛋白酶水解处理 根据Nawaz 等[14]的方法进行水解处理,并稍加修改。首先,用0.02 mol/L K2HPO4/KH2PO4的磷酸缓冲液(含0.1 mol/L NaCl)稀释蛋白,磁力搅拌2 h 使其分布均匀,将浓度调节到25 mg/mL,调节pH7.0,按照酶:蛋白=1:100(w/w)的比例加入胰蛋白酶,搅拌均匀,于37 ℃的恒温磁力搅拌水浴锅中反应0,20,40,60 和80 min,结束后取出于4 ℃冰浴冷却灭酶,备用。
1.2.3 水解度的测定 采用邻苯二甲醛(Ortho-phthalaldehyde,OPA)进行测定,参考Church 等[15]的方法,并略作修改。在96 孔板中加入200 μL OPA 试剂(97.5 mL 100 mmol/L 的四硼酸钠(pH9.9),0.5 mL 20%的SDS,1 mL 5 mg/mL 溶解于甲醇的邻苯二甲醛,1 mL 5 mg/mL 溶解在水中的二硫苏糖醇)和5 μL 的样品(甘氨酸标品),在密封状态下,25 ℃震荡5 min,然后在37 ℃下恒温反应20 min。在激发波长340 nm,发射波长450 nm 条件下,用酶标仪测量其荧光值,并根据式(1)计算其水解度。
式中,Cs代表样品的荧光值,根据线性回归方程计算而得出的浓度(mmol/L);DF1描述样品在OPA 之前的稀释系数1;DF2描述样品在OPA 时的稀释系数2;m 是每升蛋白质的质量(g);Htot是蛋白质底物总肽键(视为7.8 mmol/g)。
1.2.4 十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDSPAGE)参考林伟伟[16]的方法,电泳条件如下:分离胶体积分数为12%,浓缩胶体积分数为5%,上样体积为5 μL,上样浓度为5 mg/mL,浓缩胶电压为80 V,分离胶电压为120 V。进行凝胶电泳,待指示剂达到底部边缘时停止电泳。然后用考马斯亮蓝染色30 min 并脱色,待底色脱尽,用凝胶成像系统扫描,并对图像进行分析。
1.2.5 溶解度的测定 参考李少博[1]的方法,并略作修改。用0.02 mol/L K2HPO4/KH2PO4的磷酸缓冲液(含0.1 mol/L NaCl)将蛋白浓度调节为10 mg/mL。取1 mL 待测蛋白溶液于2 mL 离心管内,离心(10000×g,4 ℃,15 min)。离心完成后,取上清液测定蛋白浓度。溶解度用样品离心后的上清液蛋白浓度和离心前蛋白总浓度的比值来表示,计算如式(2):
1.2.6 表面疏水性的测定 参考Li 等[13]的方法测定表面疏水性,并稍做修改。取1 mL MP 溶液(5 mg/mL),加入0.2 mL 溴酚蓝溶液(BPB,1 mg/mL),混匀。用0.02 mol/L K2HPO4/KH2PO4的磷酸缓冲液(含0.1 mol/L NaCl)作为空白对照组。所有样品在25 ℃振荡10 min 后离心(6000×g,15 min,4 ℃)。取上清,稀释10 倍,并于595 nm 处测定吸光值。表面疏水性的计算如式(3):
式中,Ac为对照吸光度;As为样品吸光度。
1.2.7 二级结构的测定 根据陈故等[17]的方法测量MP 的二级结构,并略作修改。用纯水将MP 样品稀释到0.5 mg/mL,取300 μL 样品置于0.1 cm 的石英皿中,用圆二色光谱仪进行测量。仪器参数设置如下:扫描波长范围为200~250 nm,波长宽度为1 nm,扫描速度为200 nm/min,扫描次数为3 次。使用仪器自带软件对蛋白质二级结构含量进行分析。
1.2.8 内源性色氨酸荧光的测定 内源荧光光谱的测量参考Jia 等[18]的方法,并稍加修改。用0.02 mol/L K2HPO4/KH2PO4的磷酸缓冲液(含0.1 mol/L NaCl)将蛋白稀释到0.5 mg/mL,用荧光分光光度计记录300~450 nm 处的荧光光谱。激发波长为290 nm,扫描速度为300 nm/min。用0.02 mol/L K2HPO4/KH2PO4的磷酸缓冲液(含0.1 mol/L NaCl)作为空白对照。
1.2.9 Zeta 电位的测定 Zeta 电位的测定参考陈姑等[17]的方法,并稍做修改。用纯水将蛋白稀释到0.5 mg/mL,以马尔文激光粒度分析仪的SOP 模式测定MP 溶液的Zeta 电位。
1.2.10 乳液的制备 将10 mg/mL 鸭肉MP 溶液与大豆油按8:2(v/v)的比例混合,然后于冰浴下使用高速分散器以12000 r/min 的速度均质2 min(每次30 s,共4 次),即得到乳液。将制备的乳液贮存于4 ℃条件备用。
1.2.11 乳化活性、乳化稳定性和乳析指数的测定乳化活性(emulsion activity index,EAI)和乳化稳定性(emulsion stability index,ESI)的测定参考Zhou等[19]的方法,并略作修改。待制备的乳液放置0 和10 min 后,移取50 μL 底部样品,并用十二烷基磺酸钠(SDS,0.1% w/v)稀释100 倍,测定样品在500 nm处的吸光度,分别记为A0和A10。EAI 和ESI 分别由式(4)和(5)计算:
式中,N 为稀释倍数;C 为初始蛋白质浓度;φ为油相比例,0.2;L 为光程长度,1 cm。
乳析指数(creaming index,CI)的测定参考Zhou等[19]的方法。将制备的乳液移入30 mL 的玻璃瓶中,每隔24 h 测定乳液的总高度和底层清相的高度,分别记作H0和Ht,CI 根据式(6)计算:
1.3 数据处理
本试验数据用平均值±标准偏差表示。用IBM SPSS Statistics v.26.0 软件进行统计分析,采用Duncan 多重比较进行差异显著性分析,不同处理组之间显著性差异水平设置为P<0.05。数据结果用Origin Pro 2023 绘图。每组实验做三次,每次做三次重复。
2 结果与分析
2.1 水解时间对低盐鸭肉MP 水解度的影响
水解度反映蛋白质的水解程度,其大小影响蛋白质水解过程中的功能性质。OPA 试剂可以与肽键切割释放出来的游离氨基(α-NH2)结合[20],被用来测定蛋白水解程度。如图1 所示,水解度随着水解时间的延长不断升高,胰蛋白酶在水解过程中切割肽键,从而导致鸭肉MP 的重组和游离氨基的暴露。同时,肽链结构的断裂,可能引起蛋白质空间结构的变化以及肽段侧链基团的暴露,会使蛋白的性质发生变化,如蛋白质的溶解度、乳化性等[21]。如图1 所示,随着水解时间的延长,水解度显著提高(P<0.05),但整体水解度较低,最高为5.60%。有研究表明蛋白质在水解度达5%以下,其乳化性、持油性达到最大,之后随着水解时间的延长,逐渐变小[11]。
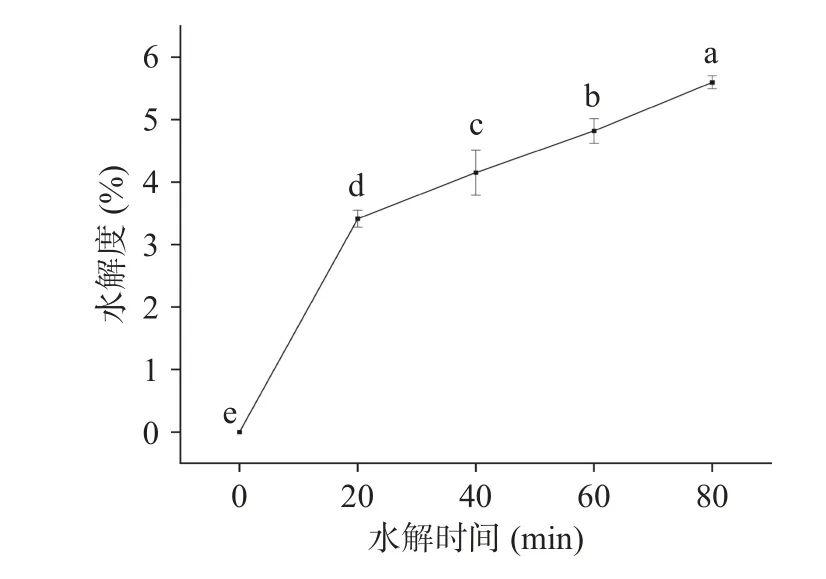
图1 水解时间对低盐MP 水解度的影响Fig.1 Effect of enzymatic hydrolysis time on hydrolysis degree of MP in low-salt condition
2.2 水解时间对蛋白质分子量分布的影响
通过十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分析水解时间对蛋白质分子量分布的影响,结果如图2 所示。未进行水解处理的鸭肉MP,具有明显的特征条带,如肌球蛋白重链(约220 kDa),肌动蛋白(Actin,约43 kDa),以及肌钙蛋白T(Troponin T,约40 kDa)[22];但是,不同水解时间后的SDS-PAGE 相对于空白处理组而言,部分特征条带发生明显变化,首先是肌球蛋白重链含量明显减少,被分解成小分子肽段,主要在48~63 kDa 附近;肌动蛋白含量没有明显变化,这是因为水解主要降解肌球蛋白重链,而不会导致肌动蛋白的降解[23-24]。但是肌钙蛋白T 在水解后条带颜色变浅,且在25~35 KDa间出现两条明显的条带;此外,肌钙蛋白I 在水解后几乎没有明显条带出现,而在约11 KDa 处观察到明显的条带。但水解组内随着水解程度的增高,蛋白条带变化不大,这可能与水解度较低有关,水解20、40、60、80 min 时的水解度分别为3.41%、4.15%、4.82%和5.60%,虽然水解度变化显著(P<0.05),但是整体水解度较小,这就导致在SDS-PAGE 结果中难以观察到明显的条带变化。总的来说,水解后鸭肉MP 发生部分降解,产生更多的小分子肽段。

图2 水解时间对低盐MP 聚丙烯酰胺凝胶电泳(SDSPAGE)的影响Fig.2 Effect of enzymatic hydrolysis time on MP polyacrylamide gel electrophoresis (SDS-PAGE)in low-salt condition
2.3 水解时间对低盐鸭肉MP 溶解度的影响
如图3 所示,MP 的溶解度随着水解的进行,呈现出先升高后趋于平缓的现象。在40 min 时,鸭肉MP 在低盐溶液中的溶解度达到60.57%,显著高于空白组(1.67%)(P<0.05);但在40 min 之后鸭肉MP的溶解度无显著变化。在0~40 min 内,胰蛋白酶切割肽链,蛋白质被分解成小分子短肽,暴露出亲水区域,促进蛋白质-水相互作用[25],提高溶解度。此外,由于肽链解离,蛋白分子间的静电斥力增强,从而提高蛋白水解产物的溶解度[26]。但是在40 min 之后无显著变化,说明就溶解度而言,水解处理40 min即可。

图3 水解时间对低盐MP 溶解度的影响Fig.3 Effect of enzymatic hydrolysis time on solubility of MP in low-salt condition
2.4 水解时间对低盐鸭肉MP 表面疏水性的影响
水解时间对MP 表面疏水性的影响如图4 所示。水解后的MP 的表面疏水性显著(P<0.05)降低,且随着水解时间的延长,表面疏水性先降低后升高。鸭肉MP 由于在低盐溶液中的溶解度极低,会引发蛋白聚集/团聚形成大分子聚集物,导致蛋白质空间结构发生变化,使得亲水侧链被埋藏在内部,而大量疏水侧链基团暴露在表面,因此未进行水解处理时其表面疏水性较大(66.36 BPB/μg)。而水解后蛋白质结构被打开,肽链解离,埋藏在内部的亲水基团暴露,溶解度显著(P<0.05)升高,同时表面疏水性降低,在40 min 时表面疏水性最低(40.85 BPB/μg)。在40 min之后表面疏水性升高,这可能和蛋白的结构展开有关[27],导致隐藏在蛋白结构内部的疏水性残基暴露在表面。总的来说,在低盐条件下,水解40 min 时鸭肉MP 的表面疏水性最低。
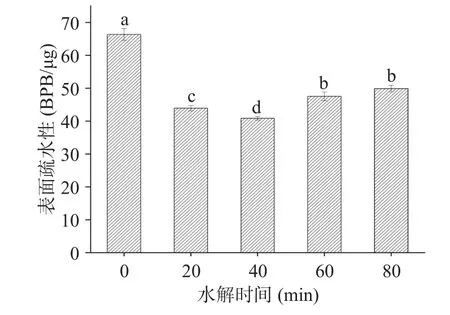
图4 水解时间对低盐MP 表面疏水性的影响Fig.4 Effect of enzymatic hydrolysis time on surface hydrophobicity of MP in low-salt condition
2.5 水解时间对低盐鸭肉MP 二级结构分布的影响
利用圆二色谱分析水解时间对MP 二级结构的影响。从图5 中可以看出,与未水解的MP 相比,二级结构含量发生明显变化。其中,水解后β-折叠的含量从6.7%增加到25.9%,而α-螺旋和β-转角的含量分别从41.2%和20.4%下降到26.7%和15.8%,说明水解处理影响蛋白的二级结构的分布。α-螺旋和β-折叠都是有序的蛋白质二级结构,β-折叠比α-螺旋更稳定[28]。α-螺旋是由肽链的羰基氧(C=O)和氨基氢(-NH2)通过分子内氢键维持,而β-折叠的稳定性取决于蛋白质分子肽链之间的氢键[29]。因此,鸭肉MP 水解后α-螺旋含量降低,这表明酶水解破坏蛋白质内部的肽链结构,蛋白质的展开,导致肽链上的分子内氢键也被破坏;同时,暴露出更多的氢键结合位点,促进分子间氢键的形成,促进α-螺旋解聚并向β-折叠转化;而β-折叠的增加意味着蛋白质之间相互作用的增强。Bai 等[30]研究表明,β-折叠对于MP 的聚集至关重要,其稳定结构可以提高蛋白凝胶特性。因此,水解处理后鸭肉MP 的二级结构改变,α-螺旋含量降低而β-折叠含量升高,分子间氢键的形成能够提高鸭肉MP 在低盐溶液中的溶解度。
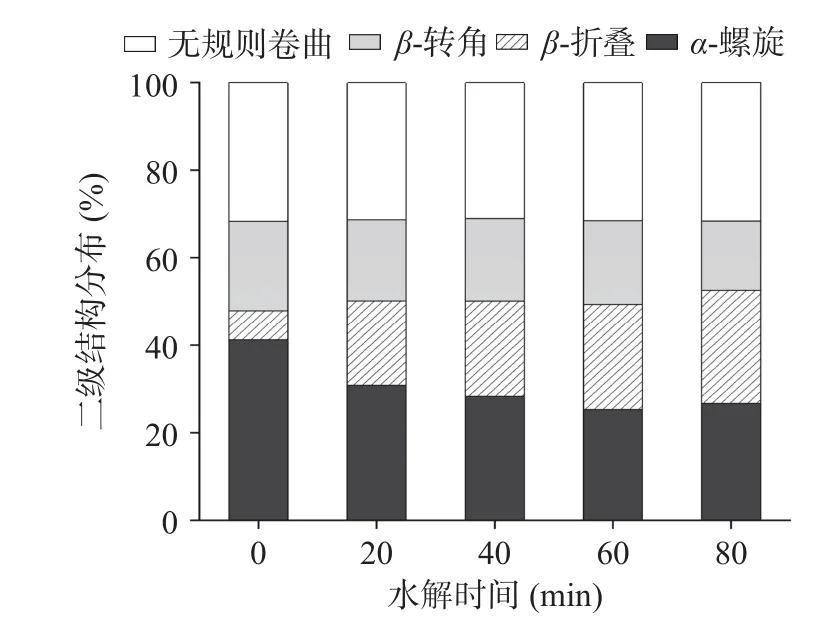
图5 水解时间对低盐MP 二级结构的影响Fig.5 Effect of enzymatic hydrolysis time on secondary structure of MP in low-salt condition
2.6 水解时间对低盐鸭肉MP 内源性色氨酸荧光的影响
样品的内源性色氨酸荧光强度会受到色氨酸在蛋白质内部的位置的影响,因此可以通过测定样品的内源性色氨酸荧光强度来反映蛋白的三级结构的变化。埋藏在蛋白质内部位点的色氨酸残基具有较高的荧光强度,而当其暴露在溶剂中时,由于荧光的淬灭会导致荧光强度的降低[31]。即色氨酸残基埋藏在蛋白质内部,样品中荧光强度越强,反之亦然[32]。色氨酸在蛋白中有三种存在形式:第一种是色氨酸在蛋白质核心的封闭结构内,密闭的结构引发静态屏蔽,导致此时的色氨酸荧光无法被检测到(静态淬灭)[33];第二种它在蛋白质核心区域,但是这个结构不封闭,通过正常的手段可以检测到;第三种色氨酸暴露到溶剂中,此时会发生正常的荧光淬灭,导致荧光强度降低。
如图6 所示,水解后的荧光强度增加,说明水解诱导蛋白质MP 三级结构发生变化;而在0~40 min的过程中,荧光强度不断升高,在40~80 min 时荧光强度又有所降低,结合图3 和图4 分析,可能有如下原因:首先,在初始状态(0 min),鸭肉MP 在低盐溶液中溶解度极低,主要表现出疏水性,在溶液中由于疏水相互作用聚集,形成不溶性聚合物,而此时在蛋白质内部的核心区域,色氨酸主要以第一种形式存在,由于静态屏蔽的存在而不能被完全检测到[34];而在0~40 min,由于酶水解的作用,鸭肉MP 的肽链被切割,蛋白质内部封闭的核心区域结构展开[35],静态屏蔽被解除,能够被检测到的色氨酸荧光增强;而在40~80 min,随着水解的继续,大分子蛋白质被分解成小分子肽段,蛋白结构可能过度展开,部分核心区域暴露到溶液环境中,发生荧光淬灭,导致荧光强度降低。同时,由于色氨酸是疏水性氨基酸,当其暴露到表面,虽然荧光发生淬灭,仍可表现出疏水性。因此,在低盐条件下,水解40 min 时的蛋白三级结构的展开程度最为适宜,再继续水解则有可能导致空间结构被破坏。
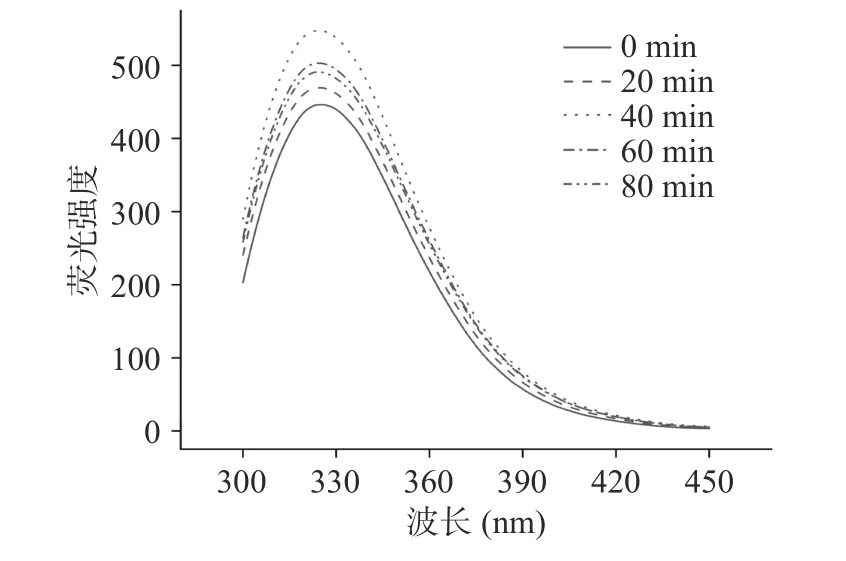
图6 水解时间对低盐MP 内源性色氨酸荧光的影响Fig.6 Effects of enzymatic hydrolysis time on endogenous tryptophan fluorescence of MP in low-salt condition
2.7 水解时间对低盐鸭肉MP Zeta 电位的影响
Zeta 电位能够反映带电生物聚合物之间的静电相互作用[36]。Zeta 电位绝对值减小,蛋白分子表面的同种电荷数量减少,蛋白分子之间的电荷斥力减弱,蛋白质容易聚集并形成不稳定的聚合物;反之,Zeta 电位绝对值增加,蛋白质分子表面同种电荷之间通过静电排斥作用,使其均匀分散在溶液中,表现出更稳定的状态[37]。如图7 所示,水解后鸭肉MP的Zeta 电位绝对值显著增加,虽然水解后各组之间的Zeta 电位绝对值无显著差异,但40 min 时明显略高于其他处理时间,这可能是因为在0~40 min 胰蛋白酶水解肽链,使得蛋白分子中的肽键断裂,暴露出更多的COO-基团,MP 表面负电荷数量增加,分子相互间的排斥力增强,能够更稳定的均匀分散在低盐溶液中;而COO-基团在增加蛋白质表面负电荷的同时,还具有良好的亲水性,能够提高MP 在低盐水溶液体系中的溶解度(图3)。然而,蛋白分子表面的电荷与其聚集/分散状态有关[38],在40 min 之后略有降低,而图6 表明水解40 min 后的结构过度展开,可能导致部分聚集,从而使Zeta 电位绝对值略有降低。总的来说,水解40 min 后的Zeta 电位绝对值最高。
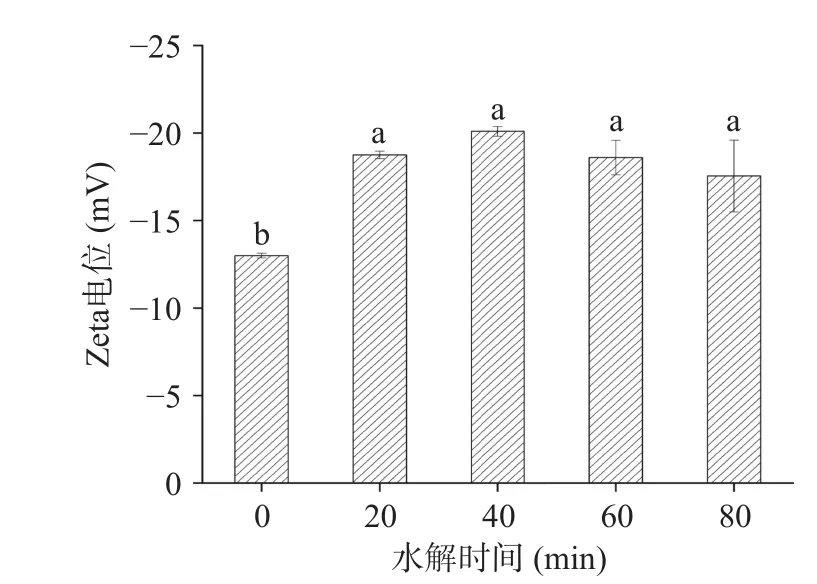
图7 水解时间对低盐MP Zeta 电位的影响Fig.7 Effect of enzymatic hydrolysis time on Zeta potential of MP in low-salt condition
2.8 乳化活性、乳化稳定性和乳析指数
乳化过程主要是蛋白油滴表面的吸附行为[39]。乳化活性(emulsion activity index,EAI)、乳化稳定性(emulsion stability index,ESI)和乳析指数(creaming index,CI)可以评估蛋白与油相结合的能力。
如图8A 所示,在低盐溶液中,水解后鸭肉MP的EAI 和ESI 显著提高;其中EAI 随着水解时间的增加呈现出先升高后降低的趋势,在40 min 时达到最高值(21.2 m2/g);结合图3 分析,溶解度的提高能够使鸭肉MP 更好的溶解在低盐溶液中,并提高其在溶液环境中的迁移速率[40-41],使其能够更快地迁移到油水界面上,提高其乳化活性。此外,水解使鸭肉MP 的分子量分布和结构明显变化(如图2,图5 和图6),大分子蛋白质解聚,肽键断裂并释放出更多的肽链,增强分子的灵活性和柔韧性[42],提高其在油水界面的吸附能力;然而,水解40 min 之后EAI 开始降低,可能是因为与大分子蛋白质相比,分子量合适的肽段具有更好的乳化性[43];而随着水解时间的延长,具有合适分子量的小肽段被分解,过小的分子量导致其乳化能力降低。因此,水解处理能够有效提高鸭肉MP 在低盐溶液中的EAI,在本实验中水解40 min 时的效果最好。

图8 水解时间对低盐MP 乳化活性、乳化稳定性和乳析指数的影响Fig.8 Effects of enzymatic hydrolysis time on emulsifying activity,emulsifying stability and creaming index of MP in low-salt condition
此外,图8A 中的ESI 表明,水解后的鸭肉MP乳液稳定性显著提高,这可能是因为在低盐条件下,水解后的鸭肉MP 具有更好的溶解度和更高的Zeta电位绝对值,溶液体系更稳定,不易出现乳析的现象[44]。图8B 是乳液贮藏0~7 天内CI 的变化,水解后乳液在贮藏期间的稳定性显著优于未水解组。总的来说,水解处理后低盐溶液中的鸭肉MP 乳化性得到改善,在40 min 时效果最好。
3 结论
在低盐条件下,水解处理后鸭肉MP 的分子量分布发生明显变化;溶解度和乳化性得到改善,均在40 min 时达到最高(分别为60.57%和21.2 m2/g),此时的水解度为4.15%;表明水解有助于改善鸭肉MP 在低盐溶液中的功能特性。此外,水解后α-螺旋含量降低,在40 min 时内源性色氨酸荧光强度最高,Zeta 电位绝对值从13.0 mV 升高到20.1 mV,表明水解后鸭肉MP 构象发生显著变化,结构展开,且在40 min 时的结构稳定性最好。本实验初步研究水解对低盐鸭肉MP 结构和功能特性的影响,为鸭肉在食品生产中的应用提供理论基础。但未将水解产物应用到实际食品生产中,水解产物对食品品质的影响还需进一步深入研究。

