miR-5188 在肝癌细胞中的作用及网络调控机制研究
全养雅 黎慧娟 陈 仕 周 艳
【关键字】 miR-5188;肝细胞癌;DIDO1;NEAT1;pri-miRNA
在亚洲肝细胞癌(HCC)的发病率居恶性肿瘤的第5 位,在中国HCC 也是一种常见的恶性肿瘤[1]。虽然近年来手术切除、射频消融、肝移植等多种治疗方法不断发展,但是HCC 治疗的远期效果仍不理想,经治愈性切除术后患者的5年复发和转移率高达70%,并且多在术后2年内复发[2]。因此,亟需探究HCC 发生和进展的分子机制,从而研发新的诊疗方案,以期改善HCC 患者的预后并提高总体生存率。miRNA 是在真核生物中发现的一类内源性的、长度为20~25 个核苷酸的非编码RNA,能通过与靶mRNA 的互补配对从而在转录后水平调控靶基因表达,导致mRNA 的降解或翻译抑制,进而参与肿瘤的发生和进展过程[3]。研究报道,miR-5188 在HCC 组织中表达上调,乙型肝炎病毒X 蛋白(HBx)可以诱导miR-5188 表达并刺激β-连环蛋白(β-catenin)核转位,从而促进HCC 的肿瘤干性[4]。由于HBV 感染并非是HCC 的充分必要条件,其他因素也可以导致HCC 发生(如丙型肝炎病毒感染等),因此内源性miR-5188 在HCC 发生和进展中的作用仍需进一步探索。本研究探讨了内源性miR-5188 在肝癌细胞中的作用及网络调控机制。
1 材料与方法
1.1 材料
实验中所用的质粒购自山东维真生物科技有限公司;小干扰RNA(siRNA)、miR-5188 mimics和miR-5188 inhibitor 均由广州瑞博生物医药科技有限公司设计并合成;正常肝细胞LO2 购自北京迈瑞达科技有限公司(货号M186652-125 mL×4);肝癌细胞HepG2 购自深圳市优里生物科技有限公司(货号BN-CC338070);DMEM 培养基购自广东环凯微生物科技有限公司(货号XB01-08);LipofectamineTM2000 转染试剂盒购自北京鼎泰博扬科技有限公司(货号11668027);MTT 试剂购自深圳市益百顺科技有限公司(货号T818538-5g);抗NONO 抗体购自广州市文睿科学仪器有限公司(货号DF7254-100);抗GAPDH 抗体购自广州德为生物科技有限公司(货号AP0066);抗PSF 抗体购自北京拜尔迪生物技术有限公司(货号bs-19683R);抗DIDO1 抗体购自广州伟然生物科技有限公司(货号DF3612-100);G 蛋白 Dyna 珠子购自深圳拓山生物科技有限公司(货号10003D);潮霉素购自生工生物工程(上海)股份有限公司(货号A600230-0250);荧光素酶检测试剂盒购自上海信裕生物科技有限公司(货号11402XY60);RNA 提取试剂盒购自广州基准科技服务有限公司(货号R4132-03);反转录试剂盒购自北京泰合通生物科技有限公司(货号4387406);RIPA 裂解液购自上海碧云天生物技术有限公司(货号P0013B)。
1.2 方法
1.2.1 细胞培养和处理 LO2 细胞和HepG2 细胞均培养于含10%胎牛血清的DMEM 培养基中,并置于37 ℃、5% CO2的环境中培养。转染前,将指数生长期的细胞接种于培养板或培养皿中,使用LipofectamineTM2000 转染试剂盒将质粒、siRNA、miR-5188 mimics 和miR-5188 inhibitor 分别转染至细胞,转染后48~72 h 收集细胞,用于后续实验。
1.2.2 细胞增殖能力检测 采用MTT 法检测细胞增殖能力。分别将指数生长期的LO2 细胞和HepG2 细胞接种至培养基中的96 孔板,孵育过夜。使用MTT 试剂(5 mg/mL)检测细胞的增殖能力,按照试剂盒说明书进行操作。
1.2.3 NONO、DIDO1 和PSF 的表达水平检测 采用蛋白质印迹法检测NONO、DIDO1 和PSF 的表达水平。于裂解缓冲液中获得HepG2 细胞裂解物,使用 BCA 蛋白测定试剂盒检测蛋白质浓度。通过SDS-PAGE 凝胶电泳分离蛋白并转膜,使用相应的抗体(抗GAPDH、NONO、DIDO1 和PSF 抗体)对其进行免疫探测。使用ECL 试剂盒检测蛋白质,使用ChemiDocTMXRS+分子成像仪获取图像。
1.2.4 PSF 与NONO 相互作用的检测 采用免疫共沉淀技术和蛋白质印迹法检测PSF 与NONO 的相互作用。免疫共沉淀的操作步骤:取2 μg 特异性抗体于4 ℃下在 200 μL 裂解缓冲液中与G 蛋白Dyna 珠子偶联2 h,用裂解缓冲液洗涤3 次后,加入300 μL 全细胞提取物(用RIPA 裂解液制备的HepG2 细胞)。将混合物于4 ℃下旋转孵育2 h,将珠子用裂解缓冲液洗涤4 次后,重新悬浮于1×SDS 上样缓冲液中,煮沸用于免疫印迹分析。
1.2.5 miR-5188、pre-miR-5188、pri-miR-5188 和长链非编码RNA NEAT1 的表达水平检测 采用实时荧光定量PCR 法检测LO2 细胞和HepG2 细胞中miR-5188、pre-miR-5188、pri-miR-5188 和长链非编码RNA NEAT1(下文简称NEAT1)的表达水平。使用RNA 提取试剂盒分离LO2 细胞和HepG2 细胞的总RNA,按照反转录试剂盒说明书将总RNA合成cDNA,以cDNA 作为模板,使用特异性引物进行扩增。PCR 的反应条件:50 ℃ 2 min,95 ℃10 min;然后95 ℃ 15 s,57 ℃ 60 s,共计40 个循环。使用Bio-Rad T100 型和Bio-Rad CFX96 型PCR 仪分别进行cDNA 合成及PCR 反应。
1.2.6 NONO/PSF 与pri-miR-5188 相互作用的检测 采用紫外交联免疫沉淀技术检测NONO/PSF与pri-miR-5188 的相互作用。将15 cm 培养皿中的贴壁细胞在冰冷的PBS 中冲洗2 次,在 254 nm波长的紫外灯(120 mJ/cm2)下交联,在1 mL Tris-HCl 裂解缓冲液中于冰上刮擦并裂解10 min,辅以蛋白酶抑制剂和RNase 抑制剂。将裂解物涡旋,然后在4 ℃下以17 000×g 离心5 min。上清液与5 μg抗NONO 抗体、抗PSF 抗体或对照同种型G 蛋白Dyna 珠子在4 ℃下旋转90 min。用于每个反应的G 蛋白Dyna 珠子(80 μL)用1 mL 裂解缓冲液冲洗2 次,并在4 ℃下用1 mg/mL 的牛血清白蛋白封闭2 h。将珠子重新悬浮于100 μL 裂解缓冲液中,然后添加至反应管中,在4 ℃下旋转孵育2 h。然后用高盐缓冲液将珠子洗涤2 次,并用裂解缓冲液洗涤3 次。免疫沉淀的样品用脱氧核糖核酸酶Ⅰ(DNase Ⅰ)处理,然后用蛋白酶K 消化。使用RNeasy MinElute 柱试剂盒纯化RNA。
1.2.7 敲除NEAT1 的细胞系构建 构建敲除NEAT1 的HepG2 细胞,以探究NEAT1 在pri-miR-5188 加工中的作用。 使用CRISPR 基因编辑工具(http://crispr.mit.edu) 设计小向导RNA(sgRNA)。将4 对 sgRNA 序列克隆到PiggyBac 质粒(PBC2)中,每对sgRNA 均应用U6 启动子。使用LipofectamineTM2000 转染试剂将含有sgRNA 的PBC2 质粒和表达Cas9 的质粒共转染至HepG2 细胞中。转染后24 h,使用潮霉素处理敲除NEAT1的细胞4 d。活细胞培养于含有10%胎牛血清且不含抗生素的新鲜DMEM 培养基中,以便在分离单个克隆之前恢复1~2 d。采用直接测序法验证敲除成功与否。
1.2.8 miR-5188 与DIDO1 靶向关系的检测 利用miRNA 靶基因预测数据库miRDB 获取miR-5188潜在的靶基因,包括DIDO1、PARP8、WDR11、SGCB、CLDN10、WASF2、SBSPON、RUFY3 和RPS6KA2 基因。采用双荧光素酶报告基因实验检测miR-5188 与DIDO1 的靶向关系。扩增DIDO1 3'非翻译区(3'-UTR)野生型(WT)片段,用于验证miR-5188 是否靶向DIDO1 mRNA 的3'-UTR。应用GeneTailorTM定点诱变系统进行miR-5188 结合位点的定点诱变(MT)。将3'-UTR-WT 或3'-UTRMT 克隆至psiCHECKTM-2 载体中用于荧光素酶检测。将载体与miR-5188 mimics 或对照序列共转染至HepG2 细胞中,并在转染后48 h 应用双荧光素酶报告基因分析系统检测HepG2 细胞中荧光素酶活性。
1.2.9 pri-miR-5188 的加工水平检测 采用双荧光素酶报告基因实验检测pri-miR-5188 的加工水平。构建pri-miR-5188 加工双荧光素酶报告系统,若pri-miR-5188 被加工,则荧光素酶因缺失Poly(A)尾而无法被翻译。将报告载体转染至HepG2细胞中,并在转染后48 h 应用双荧光素酶报告基因分析系统检测经不同处理的HepG2 细胞中荧光素酶活性。
1.3 统计学分析
应用SPSS 22.0 软件进行统计学分析。计量资料以均数±标准差(x±s)表示,2 组间比较采用Student'st检验,多组间比较采用单因素方差分析。采用一般线性模型重复测量方差分析比较MTT 测定结果的差异。P<0.05 为差异有统计学意义。
2 结果
2.1 miR-5188 靶向DIDO1 对HepG2 细胞增殖能力的影响
过表达miR-5188 后,HepG2 细胞的增殖能力增强;敲低miR-5188 表达后,HepG2 细胞的增殖能力减弱,差异均有统计学意义(P均<0.05), 见图1。 结果显示, 敲低PARP8、WDR11、SGCB、CLDN10、WASF2、SBSPON、RUFY3 或RPS6KA2 表达后,HepG2 细胞的增殖能力无显著变化;敲低DIDO1 表达后,HepG2 细胞的增殖能力增强;过表达DIDO1 后,HepG2细胞的增殖能力减弱,差异均有统计学意义(P均<0.05),见图2 和图3。过表达miR-5188 后,HepG2 细胞中DIDO1 的表达水平降低;敲低miR-5188 表达后,HepG2 细胞中DIDO1 的表达水平升高,差异均有统计学意义(P均<0.05),见图4。双荧光素酶报告基因实验检测结果显示,miR-5188 靶向DIDO1 mRNA 的3'-UTR(P<0.05),见图5。同时过表达miR-5188 和DIDO1 后,HepG2 细胞的增殖能力无显著变化,见图6。

图1 过表达或敲低miR-5188 表达对HepG2 细胞增殖能力的影响
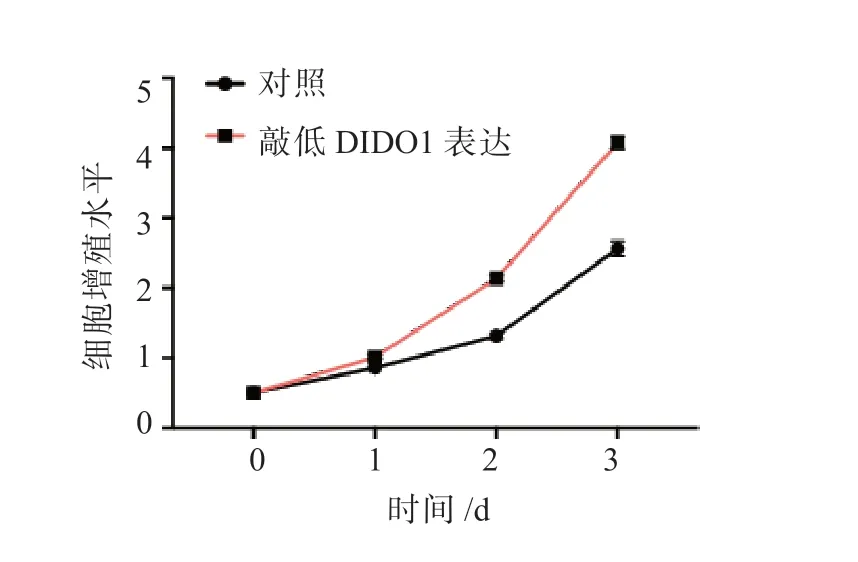
图2 敲低DIDO1 表达对HepG2 细胞增殖能力的影响
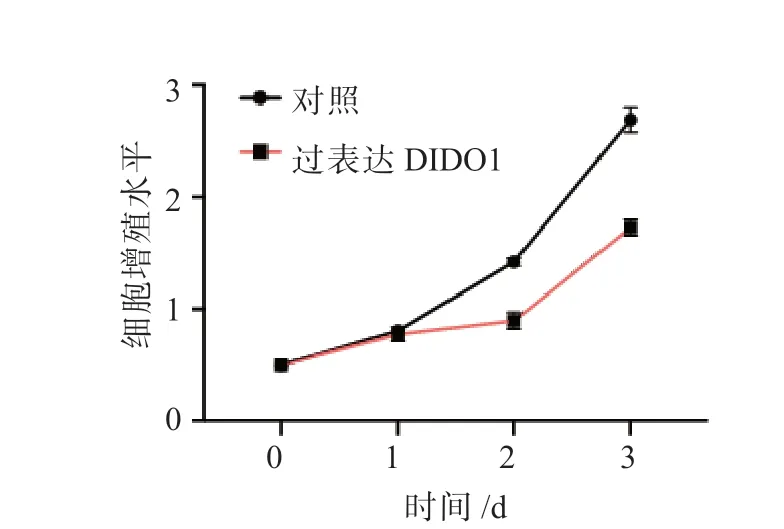
图3 过表达DIDO1 对HepG2 细胞增殖能力的影响
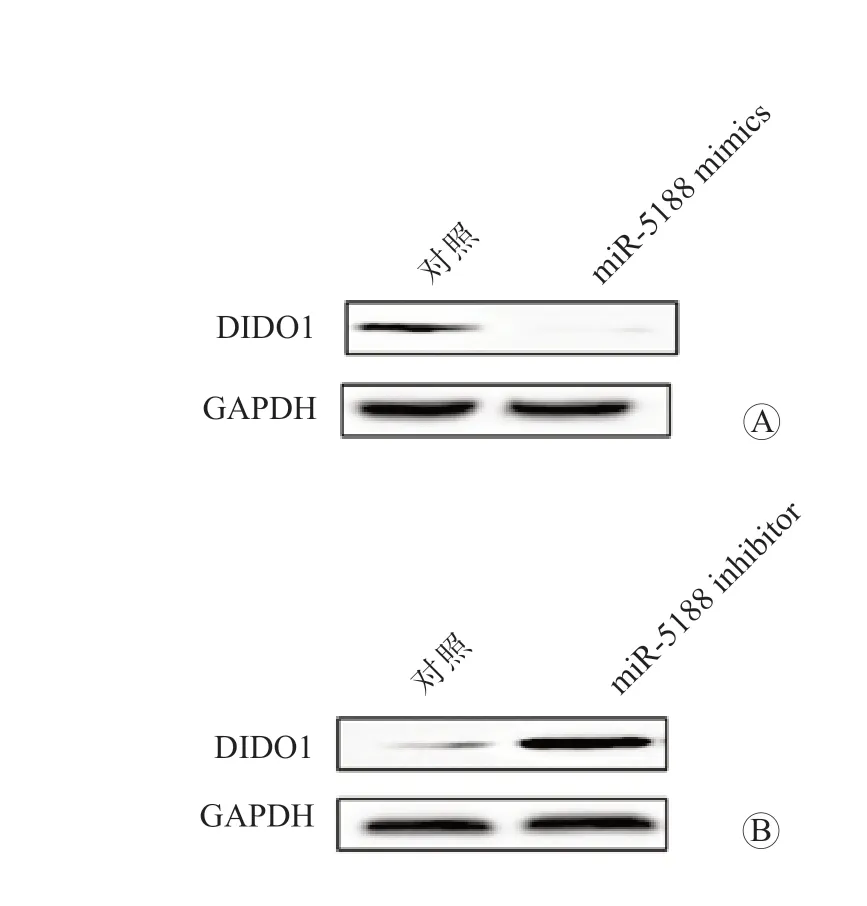
图4 过表达或敲低miR-5188 表达对HepG2 细胞中DIDO1 表达水平的影响 A 过表达miR-5188 B 敲低miR-5188 表达

图5 miR-5188 与DIDO1 3'-UTR 的靶向关系
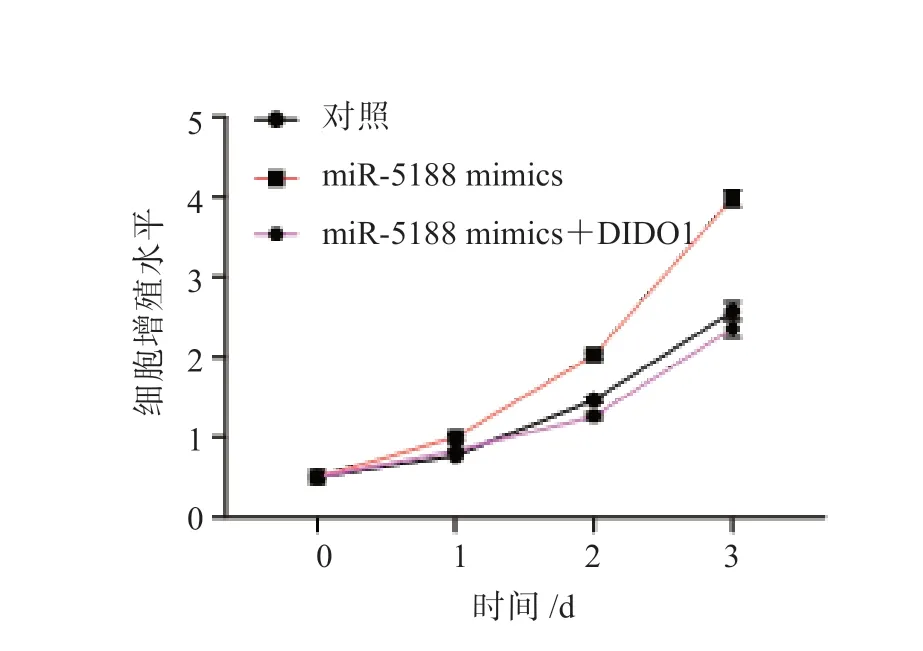
图6 过表达miR-5188 或同时过表达miR-5188 和DIDO1 对HepG2 细胞增殖能力的影响
2.2 NEAT1 介导NONO/PSF 复合体形成并促进pri-miR-5188 的加工
与LO2 细胞相比,HepG2 细胞中miR-5188和pre-miR-5188 的表达水平均显著升高,而primiR-5188 的表达水平显著降低,差异均有统计学意义(P均<0.05),见表1。与LO2 细胞相比,HepG2 细胞中NEAT1 的表达水平显著升高(P<0.05),而NONO 和PSF 的表达水平差异均无统计学意义(P均>0.05),见表1 和图7。敲低NEAT1、NONO 或PSF 表达后,HepG2 细胞中pri-miR-5188的表达水平均显著升高(P均<0.05),荧光素酶活性均显著升高(P均<0.05),见图8、9。敲除NEAT1 后,HepG2 细胞中pri-miR-5188 的表达水平升高,NONO 与PSF 的相互作用减弱,并且NONO/PSF 与pri-miR-5188 的结合减少,见图10、11 和12。
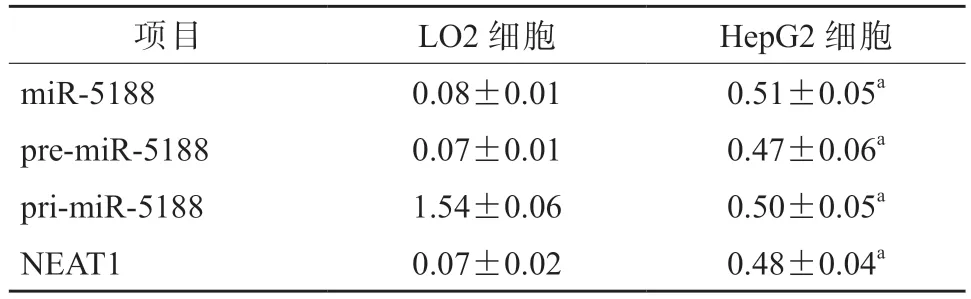
表1 LO2 和HepG2 细胞中miR-5188、pre-miR-5188、pri-miR-5188和NEAT1 的表达水平比较
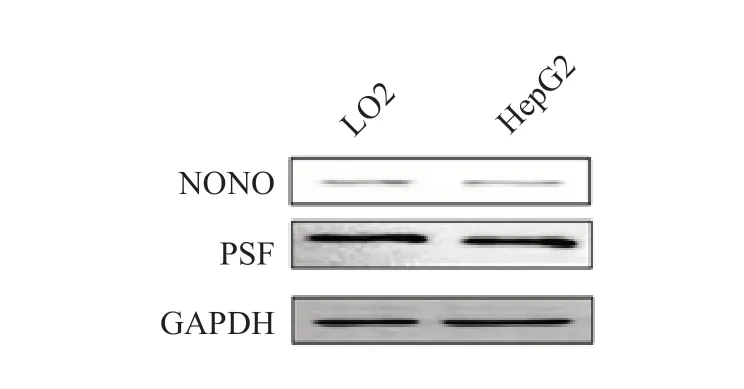
图7 LO2 细胞和HepG2 细胞中NONO 和PSF 表达的蛋白电泳图
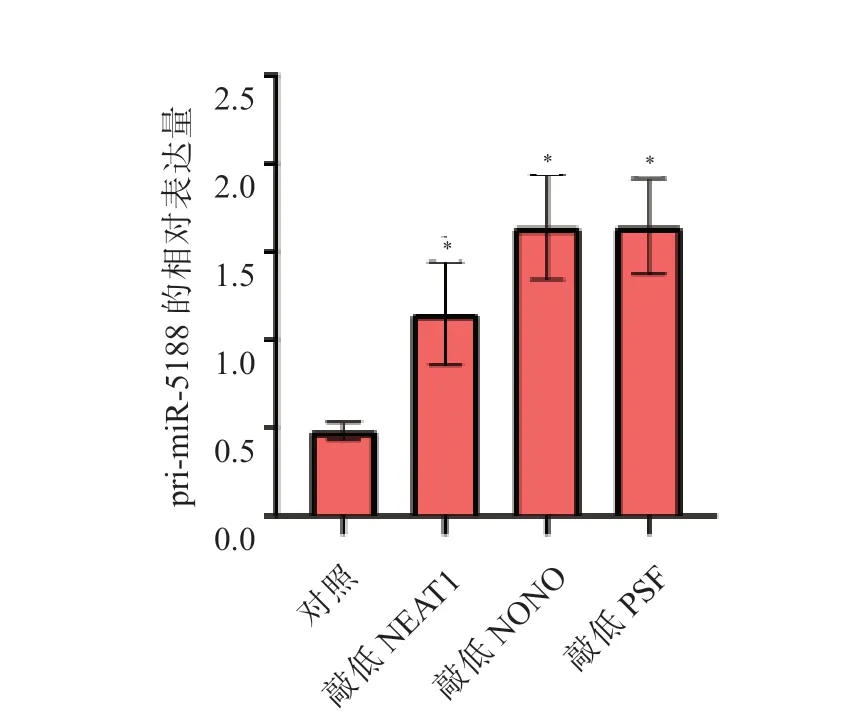
图8 敲低NEAT1、NONO 或PSF 表达后对HepG2 细胞中primiR-5188 表达的影响
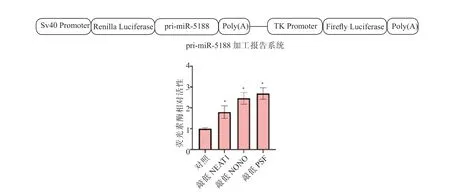
图9 双荧光素酶报告基因实验检测NEAT1、NONO 或PSF 对pri-miR-5188 的加工水平

图10 敲除NEAT1 后对HepG2 细胞中pri-miR-5188 表达水平的影响

图11 敲除NEAT1 后对HepG2 细胞中PSF 与NONO 相互作用的影响 A 蛋白质印迹法检测亲本细胞和NEAT 敲除细胞中NONO 和PSF 的表达水平 B 免疫共沉淀和蛋白质印迹法检测亲本细胞和NEAT 敲除细胞中NONO 与PSF 的相互作用
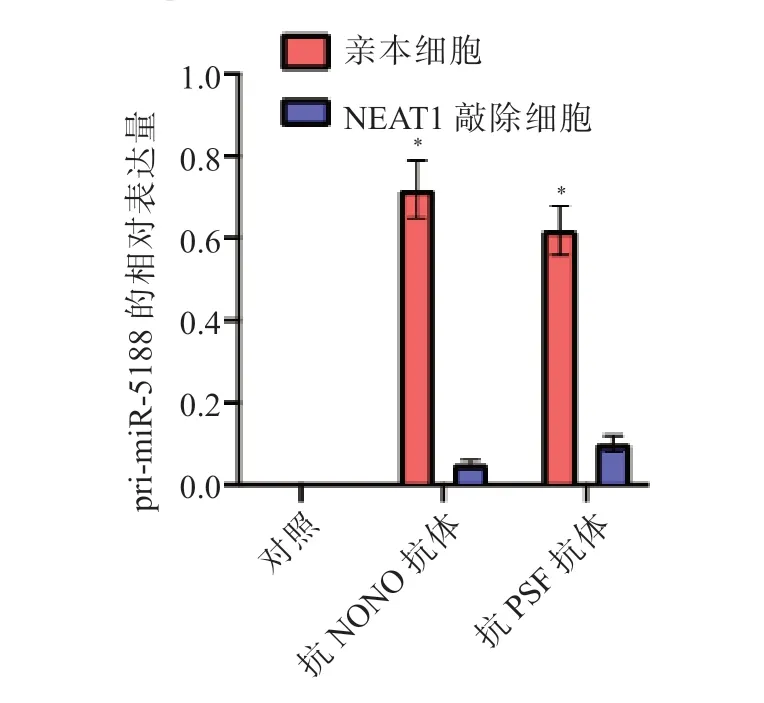
图12 敲除NEAT1 后对HepG2 细胞中NONO/PSF 与pri-miR-5188 相互作用的影响
3 讨论
本研究结果显示,过表达miR-5188 可增强HepG2 细胞的增殖能力;而敲低miR-5188 表达后,HepG2 细胞的增殖能力减弱;此外,miR-5188 靶向DIDO1 mRNA 的3'-UTR。DIDO1 首次在WOL-1细胞中被发现,其氨基酸序列包含1 个富含谷氨酰胺的区域、2 个锌指基序、1 个来自N 端核定位信号的酸性序列,以及1 个位于C 端的富含赖氨酸的序列[5-6]。在正常细胞质中,丝氨酸/苏氨酸上的DIDO1 磷酸化水平较低[7];若DIDO1 被磷酸化激活后,其会移位至细胞核以触发WOL-1 细胞凋亡[8]。由此推测,miR-5188 可能通过下调DIDO1的表达及降低肝癌细胞的凋亡水平,从而促进肝癌细胞增殖。
本研究结果显示,与LO2 细胞相比,HepG2细胞中miR-5188 和pre-miR-5188 的表达水平均显著升高,而pri-miR-5188 的表达水平显著降低。研究发现,小部分miRNA 是由自身基因编码的,约80%的miRNA 来自各种大型编码和非编码转录物[9]。这些最初的转录本被称为pri-miRNA,可被细胞核中由Drosha 和DGCR8 组成的微处理器复合物加工成pre-miRNA[10]。由Exportin 5 进行核输出后,pre-miRNA 可被Dicer 酶进一步加工为成熟的miRNA,然后进入RNA 诱导的沉默复合物而发挥生物学功能[11-13]。由此推测,提高肝癌细胞中primiR-5188 的加工水平可升高成熟miR-5188 的表达水平。本研究结果显示,敲除NEAT1 后,HepG2 细胞中pri-miR-5188 的表达水平升高,NONO 与PSF的相互作用减弱,并且NONO/PSF 复合体与primiR-5188 的结合减少。研究表明,在转录过程中和转录后,大量RNA 结合蛋白、RNA 解旋酶可在单个加工步骤中调节miRNA 的生物发生[14]。另有研究报道,NEAT1 可以促进NONO/PSF 复合体形成[15],这与本研究的结论相符。NONO/PSF 复合体可以结合大量表达的pri-miRNA,并提高Drosha-DGCR8微处理器复合物对pri-miRNA 的处理能力[14]。因此,NEAT1 可以介导NONO/PSF 复合体形成并促进pri-miR-5188 的加工。
综上所述,HepG2 细胞中NEAT1 的表达水平升高,提高了NONO/PSF 复合体对pri-miR-5188 的加工水平,增强了miR-5188/DIDO1 轴对HepG2 细胞增殖能力的正向作用。因此,miR-5188 可能可以作为HCC 的潜在治疗靶点。本研究是一项基于体外细胞水平的实验,未进行临床试验或活体动物实验,下一步将构建敲除NEAT 的小鼠模型以验证本研究结论。

