液相色谱-串联质谱法测定水产品中甲氨基阿维菌素的残留量
蓝 草,欧阳少伦,邹 游,邵琳智
(广州海关技术中心,广州 510623)
甲氨基阿维菌素是以阿维菌素主要活性成分阿维菌素B1a和阿维菌素B1b为原料,通过衍生合成、优化改进而得到的一种新型高效半合成生物源杀虫剂,其作用机理为阻断γ-氨基丁酸(GABA)受体和谷氨酸氯离子通道,干扰神经传递,导致昆虫瘫痪、死亡[1-3]。
甲氨基阿维菌素因高效、广谱、长效等优点,成为剧毒农药的替代品,广泛应用于果蔬和农作物病虫害的防治,但不合理使用会对其他非目标生物和环境造成严重危害。研究表明甲氨基阿维菌素对蜜蜂、鹌鹑、斑马鱼毒性均为高毒级,对家蚕为特高毒级[4]。此外,甲氨基阿维菌素还是一种抗寄生虫药SliceⓇ的有效成分,该药是美国唯一批准使用的化学治疗药物,被大量用于大西洋鲑鱼的养殖。甲氨基阿维菌素通过未食用的饲料以及鱼类排泄物进入到海洋环境后,极易积累在环境中,并且降解十分缓慢,其对海洋生物及环境具有较严重的危害。研究显示,甲氨基阿维菌素对与目标物种海虱在生物学上相似的水生动物(如螃蟹和龙虾)具有较强的毒性作用[5-7]。因此,欧盟、加拿大、日本等均对水产品中的甲氨基阿维菌素制定了残留限量要求,其中国际食品法典委员会(CAC)规定鲑鱼、鳟鱼肌肉和鱼片(自然比例的肌肉+皮)中甲氨基阿维菌素的最大残留限量为100μg•kg-1[8];日本规定甲氨基阿维菌素在鲑科鱼类(如鲑鱼和鳟鱼)中最大残留限量为100μg•kg-1,其他水产品中最大残留限量为0.5μg•kg-1[9]。虽然至今我国还未制定有关水产品中甲氨基阿维菌素最大残留限量的标准,但是对水果蔬菜、谷物等植物源性食品均制定了严格的限量规定,因此有必要对水产品中的甲氨基阿维菌素残留量进行风险监测和管理,以满足进出口贸易的要求。
目前对于甲氨基阿维菌素残留检测的文献报道主要适用于水果蔬菜[4,10-11]、谷物[12-13]、烟叶[1]、植物油[14]等植物源性食品,检测方法包括液相色谱法和液相色谱-串联质谱法,对于水产品中的甲氨基阿维菌素的文献报道较少。本工作提出了适用于鱼、虾、蟹、鳖和贝类等各类水产品中甲氨基阿维菌素残留检测的液相色谱-串联质谱法,以期为水产品的质量监控提供有效且简便的方法。
1 试验部分
1.1 仪器与试剂
QTRAP5500型四极杆串联质谱仪,配LC-20AD 型液相色谱仪(二元高压梯度输液泵、自动进样器、柱温箱);CPA225D 型电子天平(感量0.000 01 g)和JJ 1000 型电子天平(感量0.01 g);Zymark Turbo VapⓇLV 型吹氮浓缩仪;SiGMA 3-18K 型低温高速离心机。
甲氨基阿维菌素标准储备溶液:100 mg•L-1,准确称取甲氨基阿维菌素标准物质11.75 mg(称取标准物质的质量为按纯度折算过的质量),用乙腈溶解并定容至100 mL,混匀后于-18 ℃以下保存。
甲氨基阿维菌素标准中间溶液:1.0 mg•L-1,准确移取0.5 mL 甲氨基阿维菌素标准储备溶液于50 mL容量瓶中,用乙腈稀释并定容,于-18 ℃以下保存。
甲氨基阿维菌素标准溶液:10μg•L-1,准确移取0.5 mL甲氨基阿维菌素标准中间溶液于50 mL容量瓶中,用乙腈稀释并定容,现配现用。
甲氨基阿维菌素标准溶液系列:取适量甲氨基阿维菌素标准溶液,用80%(体积分数,下同)乙腈溶液逐级稀释,配制成质量浓度分别为0,0.01,0.02,0.05,0.1,0.2,0.5,1.0,2.0μg•L-1的甲氨基阿维菌素标准溶液系列。
甲氨基阿维菌素苯甲酸盐标准物质的纯度为96.87%;乙腈、甲醇、乙酸乙酯均为色谱纯;甲酸、正己烷为分析纯;试验用水为超纯水。
1.2 仪器工作条件
1.2.1 色谱条件
Atlantis T3 色谱柱(100 mm×4.6 mm,3μm);柱温40 ℃;流量0.6 mL•min-1;流动相A为5 mmol•L-1甲酸溶液,B 为乙腈。梯度洗脱程序:0~2.0 min 时,B 由50%升 至100%,保 持1.0 min;3.0~3.1 min时,B 由100%跳转至50%,保持3.9 min。
1.2.2 质谱条件
电喷雾电离(ESI)源,正离子(ESI+)扫描模式;多反应监测(MRM)模式;喷雾电压5 500 V;鞘气压力414 kPa,辅助气压力414 kPa;离子传输管温度600 ℃,雾化室加热温度150 ℃;碰撞气压力7.98 Pa;母离子、子离子和碰撞能量见表1。其中,“∗”代表定量离子。

表1 质谱参数Tab.1 MS parameters
1.3 试验方法
称取样品5.00 g,置于50 mL 离心管中,加入12.5 mL 乙酸乙酯,涡旋1 min,超声10 min,振荡15 min,以转速4 500 r•min-1离心5 min,收集上清液于25 mL 具塞刻度试管中。残渣中加入12.5 mL乙酸乙酯,重复提取一次,合并上清液,并用乙酸乙酯定容至25 mL。取0.5 mL 上述溶液于8 mL 吹氮浓缩管中,于45 ℃氮吹至干。残渣用80%乙腈溶液1 mL溶解,涡旋1 min,超声5 min,再加入2 mL乙腈饱和正己烷溶液,涡旋30 s,静置分层。吸取下层溶液于1.5 mL 高速离心管中,以转速12 000 r•min-1离心5 min。吸取下层清液,过0.22μm 疏水性聚四氟乙烯(PTFE)滤膜,按照仪器工作条件测定。
2 结果与讨论
2.1 色谱条件的优化
甲氨基阿维菌素的相对分子质量较大且极性较弱,采用反相C18进行分离。以甲醇和乙腈为流动相有机相,水、5 mmol•L-1甲酸溶液和0.1%(体积分数)甲酸溶液为流动相水相进行条件优化,考察了流动相对分离度、峰形及响应值的影响。结果表明,以乙腈和甲酸溶液作为流动相时,甲氨基阿维菌素峰形尖锐,响应高,见图1。因为甲氨基阿维菌素带有甲氨基,呈弱碱性仲铵盐化合物的特性,酸的加入能提高其离子化效率,从而提高灵敏度,同时酸的加入也能够改善峰形、消除拖尾,但是当甲酸添加量增加到0.1%时,可能离子含量过高与待测物产生竞争关系导致离子化效率降低,且离子化不稳定。因此,试验选择不同体积比的5 mmol•L-1甲酸溶液-乙腈的混合液为流动相。

图1 甲氨基阿维菌素的提取离子色谱图Fig.1 Extracted ion chromatogram of emamectin
2.2 质谱条件的优化
由于甲氨基阿维菌素带有甲氨基,易失去电子,形成正离子,试验采用ESI+模式进行测定。采用蠕动泵以流动注射方式将100μg•L-1的甲氨基阿维菌素标准溶液注入质谱中,在ESI+模式下,进行一级和二级质谱扫描,并对喷雾电压、雾化室加热温度等质谱参数进行优化。在最优条件下,准分子离子(m/z886.6)碰撞裂解成子离子m/z302.4,126.2,158.2,82.1,58.0,选择丰度最大的二级碎片离子(m/z158.2)作为定量离子,次强碎片离子(m/z82.1)作为定性离子,甲氨基阿维菌素的二级质谱图见图2。
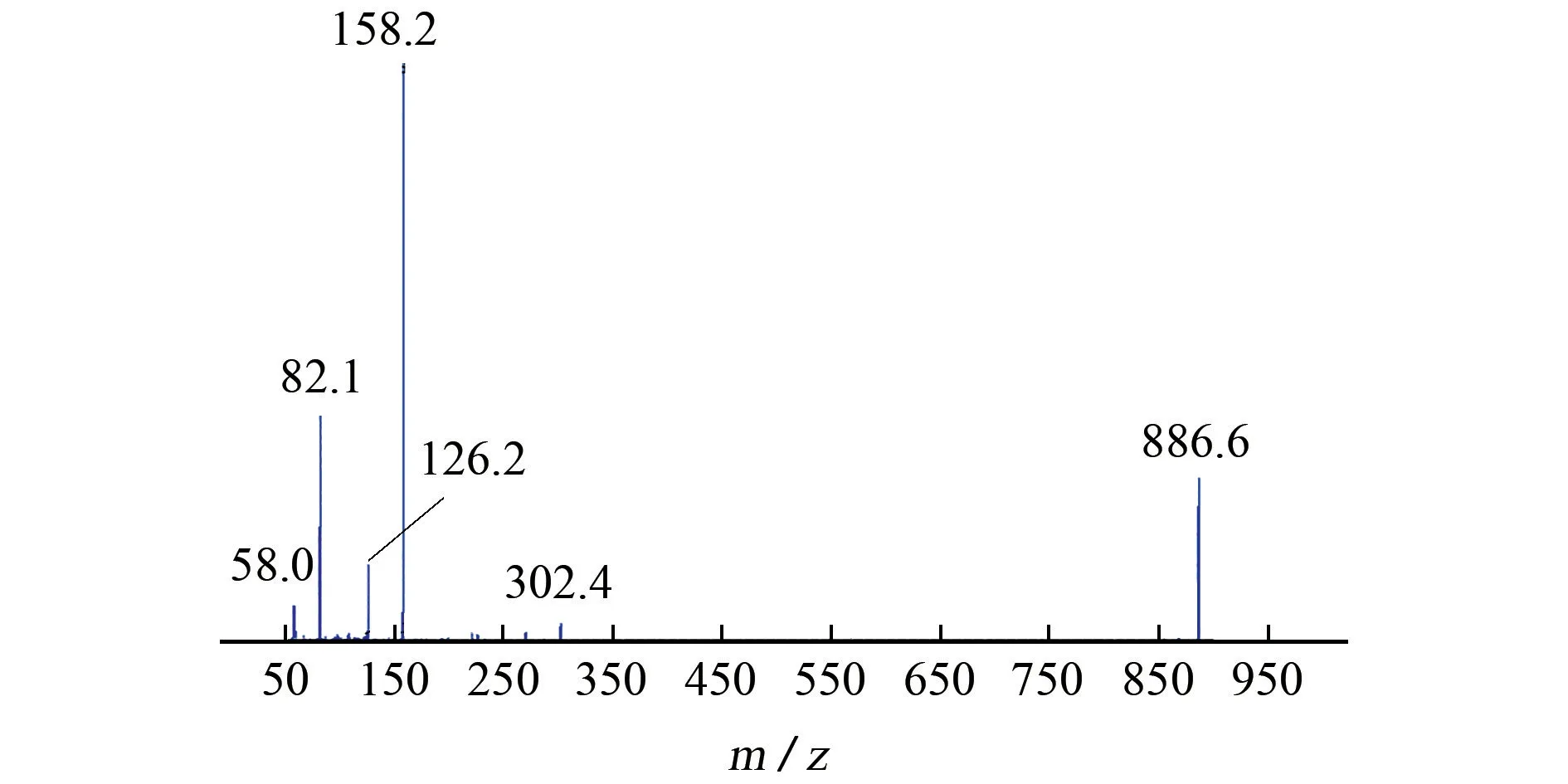
图2 甲氨基阿维菌素的二级质谱图Fig.2 Secondary mass spectrum of emamectin
2.3 样品前处理条件的优化
2.3.1 滤膜
在前处理条件优化过程中发现将标准溶液通过0.22μm 疏水性尼龙66滤膜,待测物有近30%的损失。为了降低滤膜的吸附率,试验分别考察了滤膜材料和过滤介质对吸附率的影响。结果表明:尼龙66滤膜对甲氨基阿维菌素有较强的吸附作用,无论如何改变过滤介质均有20%以上的吸附率;亲水性PTFE滤膜在最优条件下也约有7%的吸附率;而疏水性PTFE滤膜在80%乙腈溶液为过滤介质时,吸附率小于2%,满足检测要求。因此,试验采用80%乙腈溶液作为定容液,并选择0.22μm 疏水性PTFE滤膜进行过滤。
2.3.2 提取条件
甲氨基阿维菌素属于弱极性化合物,极易溶于有机溶剂,因此试验分别选用甲醇、乙腈、乙酸乙酯作为提取溶剂,考察了不同提取溶剂对鲑鱼加标样品中甲氨基阿维菌素的提取效果。结果表明:乙酸乙酯能够有效地将待测物从基质中提取出来,提取效率最高,因此选择乙酸乙酯作为样品的提取溶剂。试验发现超声步骤的加入有利于待测物甲氨基阿维菌素的提取,但是超声5 min以上时,回收率无明显的提高,为了保证充分提取,选择先超声10 min,再振荡15 min的提取方式。
2.3.3 净化方式
由于水产品中脂肪含量较高且甲氨基阿维菌素脂溶性较强,脂肪对其影响较大,因此脱脂净化步骤至关重要。
试验考察了中性氧化铝柱、Captiva EMR-Lipid脱脂柱和混合阳离子交换MCX 柱对样品的净化效果,结果发现,采用中性氧化铝柱和Captiva EMRLipid脱脂柱脱脂时,甲氨基阿维菌素回收率较低。
因此,试验进一步对比了乙腈饱和正己烷溶液液液萃取法和MCX 固相萃取柱净化法对不同基质的净化效果。结果发现:采用乙腈饱和正己烷溶液液液萃取法时,0.5μg•kg-1浓度水平下待测物的回收率为85.0%~100%,选择离子色谱图中无杂峰,且乙腈饱和正己烷溶液的使用量对结果无显著影响,本着节约溶剂的原则,试验采用2 mL乙腈饱和正己烷溶液;通过优化过柱条件,采用混合阳离子交换MCX 柱时,0.5μg•kg-1浓度水平下待测物的回收率为83.0%~95.0%,选择离子色谱图中同样无杂峰。虽然两种净化方式均能达到较好的净化效果,但是乙腈饱和正己烷溶液液液萃取法操作更简便,溶剂消耗量少,因此试验选择乙腈饱和正己烷溶液液液萃取法进行净化。
2.4 基质效应
试验根据UCLÉS S等报道的标准曲线法[15]评估方法基质效应(ME),按照ME=(1-空白基质工作曲线斜率/纯溶剂标准曲线斜率)×100%来计算。当|ME|在20%内时表明基本无基质效应;当|ME|为20%~50%时表明具有弱基质效应,当|ME|大于50%时表明具有强基质效应[16-17]。
结果显示,提取液不经乙酸乙酯稀释,仅通过优化流动相和净化方式无法消除待测物甲氨基阿维菌素的基质效应。因此,在保证灵敏度的情况下,通过样品稀释来降低基质效应,5 g样品不经稀释直接上机时和稀释50倍后(相当于0.1 g样品)上机时的基质效应对比见表2。

表2 5 g样品与0.1 g样品的基质效应对比Tab.2 Comparison of matrix effects between 5 g and 0.1 g of samples
结果表明,对于6种不同的基质,稀释50倍之后基质效应均明显降低,说明采用样品稀释法能有效地消除对甲氨基阿维菌素的基质效应。
2.5 标准曲线和测定下限
按照仪器工作条件测定甲氨基阿维菌素标准溶液系列,以甲氨基阿维菌素的质量浓度为横坐标,对应的峰面积为纵坐标绘制标准曲线。结果表明,甲氨基阿维菌素的质量浓度在0.01~2.0μg•L-1内与对应的峰面积呈线性关系,线性回归方程为y=6.659×104x+5.085×102,相关系数为0.999 9。
按照10倍信噪比计算测定下限(10S/N),结果为0.5μg•kg-1,参照CAC对甲氨基阿维菌素在自然比例的带皮鱼肌肉中的最大残留限量100μg•kg-1,本方法的测定下限满足检测要求。
2.6 精密度与回收试验
分别以鲑鱼、罗非鱼、虾、蟹、鳖和贝类为研究对象进行加标回收试验,每个浓度水平做6个平行试验,计算回收率和测定值的相对标准偏差(RSD),结果见表3。

表3 精密度和回收试验结果(n=6)Tab.3 Results of tests for precision and recovery(n=6)
由表3可知:在不同基质和不同浓度水平下,甲氨基阿维菌素的回收率为84.3%~99.9%,测定值的RSD 为2.3%~6.6%,均满足药物残留检测要求,说明方法适用性强,准确度高,重现性好。
2.7 样品分析
按照试验方法对进口鲑鱼、进口罗非鱼及市售的蟹、贝类、鳖、虾等6类共50个样品进行测定,结果发现1个进口鲑鱼中检出甲氨基阿维菌素,检出量为20.7μg•kg-1(见图3),其余水产品中均未检出甲氨基阿维菌素。

图3 鲑鱼样品的色谱图Fig.3 Chromatogram of the salmon sample
本工作提出了液相色谱-串联质谱法测定水产品中甲氨基阿维菌素残留量的方法,采用乙腈饱和正己烷溶液液液萃取法处理样品,样品稀释法消除方法基质效应。方法经济、简便、高效且准确,能较好满足水产品中甲氨基阿维菌素的测定要求。

