KRAS、NRAS及BRAF基因突变状态对结直肠癌术后辅助化疗患者预后的影响
谭晶,高波
(驻马店市中心医院 病理科,河南 驻马店 463000)
以手术为主、化疗为辅的综合治疗是目前结直肠癌的常见治疗方法,先通过外科手术将肿瘤病灶及周围部分肠管切除,再通过术后辅助化疗消除患者体内残余癌细胞,可缓解因肿瘤导致的腹痛、便秘等不适症状,挽救患者生命[1-2]。但有研究指出,结直肠癌患者术后残留的部分具有Mex3a蛋白活性的肿瘤干细胞,可通过保持潜伏状态来躲避化疗药物,并于化疗结束后某段时间内自动激活,导致肿瘤复发或转移,不利于结直肠癌患者的预后[3]。随着研究的深入,发现具有Mex3a蛋白活性的肿瘤干细胞需通过相关信号传导通路来完成细胞增殖[4]。而KRAS、NRAS及BRAF基因是肿瘤细胞增殖过程信号通路上的激酶[5]。因此,或可通过研究上述基因的突变状态来预估结直肠癌患者复发或转移,通过采取分子靶向药物提前干预,阻断与肿瘤生长和转移相关信号传导通路,抑制肿瘤细胞复发或转移,改善预后。
1 对象与方法
1.1 研究对象
收集驻马店市中心医院于2019年3月至2021年12月收治的65例结直肠癌患者病例资料进行回顾性研究。65例患者中男42例,女23例;年龄51~68岁,平均(60.32±3.21)岁;原发部位直肠19例,左半结肠27例,右半结肠19例;组织学类型腺癌48例,其他17例。纳入标准:(1)符合《中国结直肠癌诊疗规范(2017版)》[6]中相关诊断标准,且经病理学检查确诊;(2)临床分期Ⅱ~Ⅲ期;(3)接受结直肠癌外科手术治疗;(4)术后已完成4个周期的辅助化疗;(5)术后接受KRAS、NRAS及BRAF基因检测;(6)临床病历及随访资料完整。排除标准:(1)术后化疗未按时参加或曾中途中断;(2)合并其他恶性肿瘤;(3)手术与化疗未全程于医院完成;(4)术前已接受放疗。本研究经驻马店市中心医院医学伦理委员会批准通过。
1.2 方法
1.2.1一般资料收集
设计一般资料调查表,通过查阅电子病历统计所有患者性别、年龄、体重、肿瘤直径、原发部位、组织学类型、大体类型、临床分期、肿瘤分化程度、手术方式。
1.2.2基因突变检测
取经福尔马林固定石蜡包埋的结直肠癌标本,通过艾德FFEP DNA/RNA核酸提取试剂提取DNA,通过荧光PCR法检测标本中KRAS、NRAS及BRAF基因突变情况,检测区段为KRAS(外显子2、外显子3、外显子4)、NRAS(外显子2、外显子3)、BRAF(外显子15),检测试剂盒为人类KRAS/NRAS/BRAF基因突变联合检测试剂盒,其中扩增程序图分为3个阶段,第一阶段1个循环,温度为95 ℃,时间5 min;第二阶段共15个循环,以温度95 ℃循环25 s,64 ℃循环20 s,72 ℃循环20 s;第三阶段共31个循环,以温度93 ℃循环25 s,60 ℃循环35 s,72 ℃循环20 s。在第三阶段温度60 ℃时,采集信号并记录循环数阈值值,若信号出现明显扩增曲线且ct值<26,则检测结果为KRAS、NRAS及BRAF基因突变型,其余为野生型。
1.2.3结直肠癌化疗后预后判定
通过查阅随访资料,统计所有患者化疗结束后1 a内是否复发或转移,将复发及转移病例纳入预后不良组,其余病例纳入预后良好组。
1.3 统计学方法
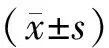
2 结果
2.1 预后情况
术后1 a,65例结直肠癌术后辅助化疗患者中预后良好55例(84.62%);预后不良10例(15.38%)。
2.2 一般资料
两组性别、原发部位、组织学类型、肿瘤分化程度等一般资料对比,差异无统计学意义(P>0.05)。详见表1。

表1 两组一般资料对比
2.3 KRAS、NRAS及BRAF基因突变情况
65例患者中KRAS基因突变24例(36.92%);NRAS基因突变5例(7.69%);BRAF基因突变4例(6.15%)。不同预后KRAS、NRAS及BRAF基因突变状态对比,差异有统计学意义(P<0.05)。见表2。

表2 不同预后患者KRAS、NRAS及BRAF基因突变情况
2.4 KRAS、NRAS及BRAF基因突变状态对结直肠癌术后辅助化疗患者预后的影响
将KRAS、NRAS及BRAF基因突变状态作为自变量,赋值情况见表3;将结直肠癌术后辅助化疗患者预后作为因变量(预后良好=0,预后不良=1)。logistic回归分析结果显示,KRAS、NRAS及BRAF基因突变型可影响结直肠癌术后辅助化疗患者预后(P<0.05)。见表4。

表3 自变量赋值情况

表4 KRAS、NRAS及BRAF基因突变状态对结直肠癌术后辅助化疗患者预后的影响
3 讨论
越来越多的研究表明,癌症的产生、复发和转移与患者某些基因异常突变密切相关[7-8]。基因突变状态的检测可便于医者更为深入地了解癌症的产生和繁殖过程,为个性化治疗方案的制定和实施提供有力依据。结直肠癌中KRAS、NRAS及BRAF基因是癌细胞繁殖过程中最常见的3种突变基因。本研究结果显示,KRAS和NRAS基因突变型与结直肠癌术后化疗不良预后有关。分析原因,可通过产生RAS蛋白来抑制肿瘤细胞的繁殖和生长[9],当KRAS基因发生突变后,RAS蛋白上的酶活性被降低,可通过反复刺激靶分子使KRAS基因处于永久激活状态,打破细胞的正常生长规律,并使细胞内部信号传导紊乱、细胞大量增殖并最终诱发结直肠癌复发或转移,不利于预后[10-11]。此外,随着研究的深入,发现KRAS基因和NRAS基因突变还可使肿瘤相关启动子出现异常甲基化改变[12]。而基因异常甲基化改变会通过降低患者体内正常细胞基因的甲基化水平,升高抑癌基因的甲基化水平来激活结直肠癌体内原癌基因,并促进肿瘤细胞产生、增殖、分化和转移,最终导致肿瘤病灶再次出现[13]。因此,对于KRAS和NRAS基因突变型结直肠癌患者,可于术后化疗过程中联合贝伐珠单抗、瑞格非尼等可抑制肿瘤细胞增殖、阻断原癌基因表达的分子靶向药物,以降低结直肠癌术后化疗复发转移风险,改善预后。
BRAF基因可通过使下游信号蛋白中的丝氨酸或苏氨酸基团磷酸化来将外部信号介导入细胞内部,抑制异常的细胞增殖[14]。本研究结果显示,BRAF基因突变型的结直肠癌术后化疗患者,复发转移率非常高,提示BRAF基因突变状态影响结直肠癌患者的预后。分析原因,BRAF基因突变后激酶活性被增强至以前的几百倍,持续性激活RAF/丝裂原活化蛋白激酶信号通路后引起化疗后残留的少许肿瘤细胞无限增殖、分化和代谢,形成复发或转移病灶,不利于结直肠癌患者的预后[12,15]。此外,作为最常见的原癌基因,BRAF基因突变型可通过激活激活RAF-MEK-ERK信号转导通路来阻断正常细胞间的信号传递链,并诱发正常细胞转变为癌细胞,是肿瘤发生、浸润或转移的重要驱动因素[16]。因此,对于BRAF基因突变型的结直肠癌患者,癌细胞可能会在短时间内出现转移、扩散,如不采取措施及时中断BRAF基因活性,即使经手术和化疗杀灭体内所有癌细胞,化疗后也有较高复发或转移率。可通过应用相关靶向药物、扩大手术范围、缩短随访时间等方式来降低术后复发或转移率,改善预后。
4 结论
KRAS、NRAS及BRAF基因突变型可对结直肠癌术后辅助化疗患者不良预后产生影响,临床根据NRAS和BRAF基因突变状态采取适当措施干预,改良预后。

