基于蛋白质组学研究红花黄色素抗阿尔茨海默病的作用机制
张梦玉,侯加卫,2,王春辉,郑艳杰,胡艳丽
(1石河子大学药学院,新疆 石河子 832002;2 中山大学医学院解剖系, 广东 深圳 518100)
阿尔茨海默(Alzheimer′s disease, AD)是一种发生在中枢神经系统的退行性疾病,主要临床表现为学习记忆及认知功能障碍,并伴随着精神行为异常和生活能力下降[1]。
AD病因复杂,发病机制尚未完全阐明,存在多种假说,包括β-淀粉样蛋白级联假说、胆碱能假说、tau蛋白异常磷酸化假说等[2-3],目前用于治疗AD的药物以胆碱酯酶抑制剂及N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid,NMDA)受体阻断剂为主,虽然可以减轻AD的症状,但不能延缓疾病的进程,提示仅根据单一靶点很难达到理想的治疗效果。中药防治AD有其独特的优势,往往通过作用于多靶点,多代谢途径达到治疗目的。因此寻找合适的抗AD中药成为药物研发的热点。红花黄色素(Safflower yellow, SY)是传统中药红花的水溶性提取物。研究证明,SY具有多种药理作用,如抗氧化、抗炎、抗衰老和神经保护[4]。课题组前期研究发现,SY可以改善多种AD模型动物的学习和记忆能力[5-6]。但由于AD发病机制的复杂多样性,传统研究方法难以明确SY治疗AD的有效靶点和潜在分子机制。因此,本研究通过建立Aβ1-42诱导的AD大鼠模型,应用串联质谱标签(tandem mass tags, TMT)标记技术进一步阐明SY的抗AD作用机制。
1 材料与方法
1.1 实验试剂
红花黄色素(云南通海杨氏天然产物公司);Aβ1-42(Sigma);TMT标记试剂盒(Thermo Fisher);胰酶(Promega);乙腈(Fisher Chemical);三氟乙酸(Sigma);甲酸(Fluka);碘代乙酰胺(Sigma);二硫苏糖醇(Sigma);尿素(Sigma);三乙基碳酸氢铵(Sigma); 蛋白酶抑制剂(默克公司);BCA试剂盒(上海碧云天);RPL34兔多克隆抗体(Biorbyt);MAP-6D1鼠单克隆抗体(Santa);MVD鼠单克隆抗体(Santa);PVDF膜(Amersham);特超敏ECL化学发光试剂盒(上海碧云天);SuperSignalTMWest Femto Trial Kit(Thermo Fisher)
1.2 溶液配制
Aβ1-42寡聚体的制备:将Aβ1-42加入六氟异丙醇中,室温放置60 min使其溶解。将溶液放置冰盒上10 min,移入通风柜,开盖挥发,形成透明的Aβ肽膜。将Aβ肽膜溶于适量的生理盐水中,振荡混匀形成5 mmol·L-1的溶液,将其放置于-20 ℃保存。使用时用生理盐水稀释至500 μmol·L-1,37 ℃孵育1周使其变成Aβ寡聚体后备用。
1.3 实验动物
SD大鼠(200~220 g,n=36,雌雄各半)购自新疆维吾尔自治区疾病预防控制中心。将其置于室温且24 h明暗交替的环境中,并可自由饮用水和食物。所有动物程序均已获得石河子大学动物伦理委员会的批准[2016]院化审动实字(067)号No.A2016-067。
1.4 实验仪器
DMS-2型Morris水迷宫(中国医学科学院);CMA450体温维持仪和CMA微量注射泵(CMA/MICRODIALYSIS AB);大鼠脑立体定位仪(美国BAS4100);Axio Imager A2倒置荧光显微镜(德国Zeiss公司);CM1860型冰冻切片机(德国莱卡);EC3TM 510 Imaging System Manual Platform(英国Ultra-Violet);垂直电泳仪(北京六一);半干电转印系统(美国BIO-RAD);Orbitrap Fusion Lumos质谱仪(美国Thermo Fisher);4530R型低温高速离心机(德国Eppendorf);PY-120水平脱色摇床(北京鼎国生物)
1.5 实验方法
将36只SD大鼠雌雄对半随机分为3组,分别为假手术组(Sham)、Aβ1-42模型组(Model)、Aβ1-42模型+SY 30 mg·kg-1组(SY 30 mg·kg-1)。大鼠术前12 h禁食禁水。根据文献方法对各组大鼠进行造模[5]。造模一周后给假手术组和模型组大鼠灌胃生理盐水,药物治疗组灌胃SY 30 mg·kg-1每日1次,连续给药4周,直至行为学实验结束。
1.5.1 水迷宫实验
平台位于水面以下约1 cm处,水温保持在(22±2)℃。实验期间,室内照明条件保持不变,环境保持安静。在前五天进行定位试验,平台位于东南象限的中心,每天从相邻象限和相对象限入水,记录每只大鼠寻找平台的潜伏期;如未找到平台,记录逃避潜伏期为60 s。第六天进行空间探索实验,移开平台,大鼠从选定象限下水。记录每只大鼠穿越平台次数和目标象限停留时间。
1.5.2 Golgi染色
快速取出大鼠大脑并在FD Rapid GolgiStain TM试剂盒(PK401,FD NeuroTechnologies,Columbia,USA)中孵育以进行染色,并根据试剂盒的说明在不同时间更换染色试剂。6周后,组织切片用试剂盒染色。通过激光共聚焦显微镜拍摄树突棘的形态,并通过Image J软件测量树突棘的长度和密度(即每10 μm树突棘的数量)[7]。
1.5.3 蛋白质提取
迅速取出大鼠脑组织,分离海马后用生理盐水洗净并保存在-80 ℃下。从3个组中各取出3个样品,并将适量的组织样品放入用液氮预冷却的研钵中,将组织充分研磨成粉末。向组织样品中加入细胞裂解缓冲液(含8 mol·L-1尿素,1%蛋白酶抑制剂),进行超声裂解。离心后取上清液,通过BCA试剂盒测定总蛋白质浓度。
1.5.4 胰酶酶解
加入二硫苏糖醇至蛋白溶液使其终浓度为5 mmol·L-1,在56 ℃下,还原30 min。之后加入碘代乙酰胺,室温避光孵育。最后将样品蛋白溶液的尿素浓度稀释至低于2 mol·L-1。以1∶50(胰酶:蛋白)的质量比例加入胰酶,37 ℃酶解过夜。再以1∶100(胰酶:蛋白)的质量比例加入胰酶,继续酶解。
1.5.5 TMT标记
用Strata X C18(Phenomenex)对胰酶酶解的肽段除盐,然后对其进行真空冷冻干燥。将肽段以0.5 mol·L-1三乙基碳酸氢铵进行溶解,根据TMT试剂盒操作说明书标记肽段。
1.5.6 LC-MS/MS分级
通过高pH反向HPLC对肽进行分类。色谱柱为Agilent 300 Extend C18(粒径5 μm,内径4.6 mm,长度250 mm)。肽首先以8%至32%乙腈(pH 9.0)的梯度在60 min内分离成60个馏分。然后将60个馏分合并成18个馏分,然后真空干燥。用液相色谱流动相将肽段溶解后,使用EASY-nLC 1000超高效液相系统进行分离。由超高效液相系统分离的肽段被注入NSI离子源中进行电离,然后进入Orbitrap Fusion LumosTM 质谱仪进行分析。
1.5.7 生物信息学分析
使用在线分析工具分析差异蛋白。通过InterProScan进行基因本体(Gene Ontology, GO)注释,其中包括:生物过程(Biological Process),细胞组成(Cellular Component)和分子功能(Molecular Function),从不同角度阐释蛋白的生物学作用。通过KAAS和KEGG Mapper进行了KEGG通路注释和富集。
1.5.8 Western Blot蛋白验证
提取各组大鼠海马组织总蛋白,用BCA试剂盒测定蛋白质浓度,将蛋白质热变性并进行SDS-PAGE凝胶电泳。将蛋白质移至PVDF膜上,室温下封闭1 h。PVDF膜与以下抗体在4 ℃下过夜:兔抗RPL34多克隆抗体(1∶500,orb226233)、鼠抗MAP-6D1单克隆抗体(1∶1 000,sc-515352)、鼠抗MVD单克隆抗体(1∶1 000, sc-376975)。次日,PVDF膜与相应二抗孵育,将ECL试剂均匀覆盖PVDF膜,使用EC3TM 510成像系统对条带进行可视化。
1.6 数据分析
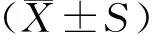
2 结果
2.1 SY显著提高AD模型大鼠的学习和记忆能力
SY治疗行为测试和神经化学分析的实验时间表如图1a所示。
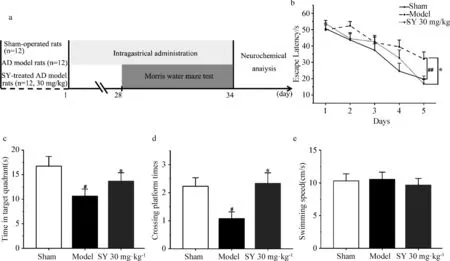
a.实验时间表;b.逃避潜伏期(s);c.目标象限停留时间(s);d.穿越平台次数 与假手术组相比,#P<0.05,##P<0.01;与模型组相比,*P<0.05。图1 Morris水迷宫实验中SY对AD模型大鼠学习记忆的影响
为了确定SY对Aβ1-42诱导的AD模型大鼠学习和记忆缺陷的影响,3组大鼠在灌胃4周后进行Morris水迷宫实验。如图1b所示,在定位航向实验中,与假手术组相比,AD模型组大鼠逃避潜伏期显著延长(P<0.01),表明模型组大鼠学习能力受损。SY治疗后AD模型大鼠的逃避潜伏期明显缩短(P<0.05)。在第六天进行的空间探索实验中,如图1c,d所示,模型组大鼠的目标象限停留时间和穿越平台次数显著减少(P<0.05),表明模型组大鼠的记忆能力明显受到损伤。SY治疗后AD大鼠目标象限停留时间及穿越平台次数显著增加(P<0.05)。不同组大鼠的游泳速度没有显著差异(图1e)。实验结果表明,SY提高了AD模型大鼠的学习和记忆能力。
2.2 SY减轻Aβ1-42诱导的AD模型大鼠海马树突棘结构损伤
Golgi染色用于显示树突棘的形态学细节(图2a)。结果表明,与假手术组相比,模型组大鼠海马中树突棘的密度(每10 μm)和树突棘的平均长度显著降低(P<0.01,图2b,图2c)。与模型组相比,SY治疗组大鼠海马中树突棘的密度(每10 μm)和树突棘的平均长度显著增加(P<0.01)。表明SY能减轻Aβ1-42诱导的AD模型大鼠海马树突棘结构损伤。
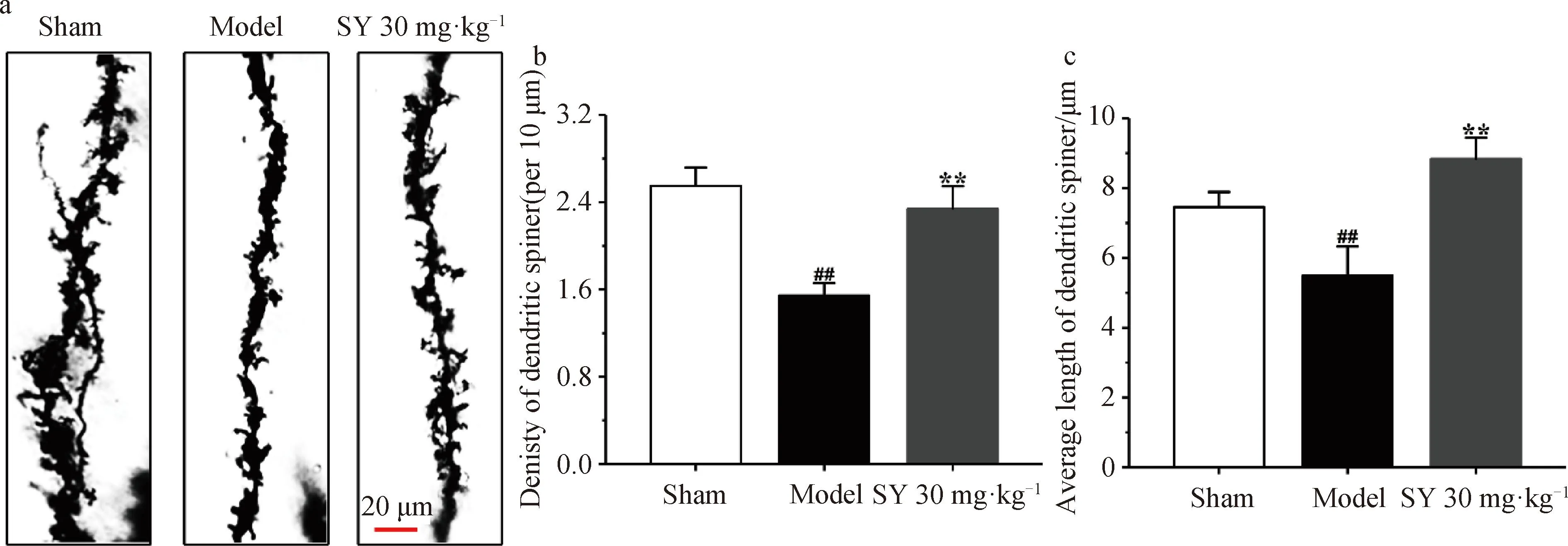
a. 树突棘的结构; b. 树突棘密度(每10 μm); c. 树突棘长度 与假手术组相比,#P<0.05,##P<0.01;与模型组相比,*P<0.05。图2 SY对Aβ1-42诱导的AD模型大鼠海马树突棘结构损伤的影响
2.3 差异蛋白的鉴定
如图3a所示,通过质谱分析共得到1 206 558张二级谱图。质谱二级谱图经蛋白理论数据搜库后,得到可利用有效谱图数为283 893。通过谱图解析共鉴定到109 446条肽段,其中特异性肽段为98 768。一共鉴定到5 933个蛋白,其中4 555个可定量。当蛋白质的倍数变化>1.2或<0.83并且P<0.05时,认为蛋白质差异表达。

a. 谱图结果的基本统计数字; b.“SY治疗/模型”比较组和“模型/假手术”比较组中差异蛋白数量分布的直方图; c. “SY治疗/模型”比较组中差异蛋白的层次聚类分析的热图; d. “模型/假手术”比较组中差异蛋白的层次聚类分析的热图; e. 维恩图显示“SY治疗/模型”比较组和“模型/假手术”比较组中差异蛋白的数量。图3 差异蛋白的鉴定
“SY治疗/模型”比较组中20种蛋白的表达上调,38种蛋白的表达下调。在“模型/假手术”比较组中,32种蛋白的表达上调而22种蛋白的表达下调(图3b)。
层次聚类分析的热图进一步提供了部分差异蛋白质变化的可视化分析,结果表明,这些蛋白质具有很好的区分性(图3c, 图3d)。如图3e所示,“模型/假手术”比较组和“SY治疗/模型”比较组之间有9个共同的差异蛋白,包括α-硫丹(Alpha-endosulfine,Ensa)、60S核糖体蛋白L34(60S ribosomal protein L34,Rpl34)、微管相关蛋白6的结构域-1(MAP6 domain-containing 1,Map6d1)、二磷酸甲羟戊酸脱羧酶(Diphosphomevalonate decarboxylase,Mvd)、类蛋白C10(Protein C10-like,LOC100911713)、核糖-5-磷酸-3-差向异构酶(Ribulose-5-phosphate-3-epimerase,Rpe)、含亮氨酸的重复蛋白(F-box and leucine-rich repeat protein 4,Fbxl4)、RGD1561552蛋白(RGD1561552 protein,RGD1561552)和锌指蛋白(Zinc finger, ZZ-type-containing 3,Zzz3)。9个差异蛋白的详细信息如表1所示。
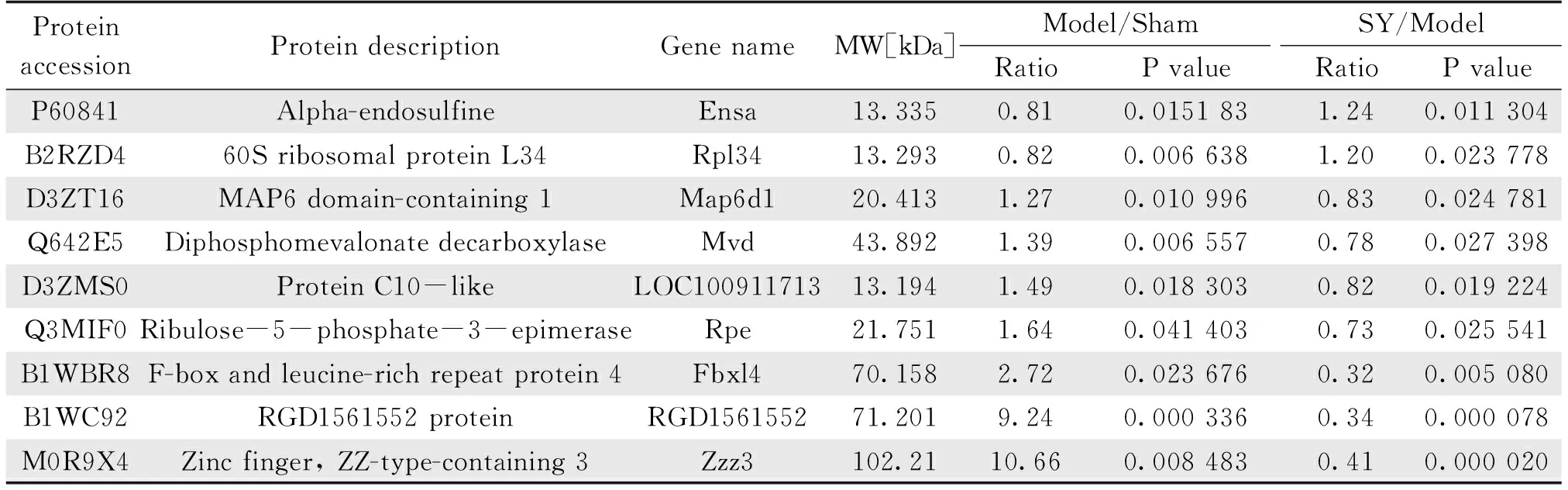
表1 “模型/假手术”比较组和“SY治疗/模型”比较组海马中9个共同的差异蛋白
2.4 GO富集分析
为了了解两个比较组中差异蛋白的功能,本研究对差异蛋白进行了GO富集分析。气泡图中l列出最显著富集的前20个分类的结果。对于“模型/假手术”比较组中的差异蛋白,如图4a,图5a,图6a所示,核小体、DNA包装和转录抑制复合物是富集程度最高的3个细胞成分;组蛋白结合、蛋白结合、桥联和离子通道调节活性是最丰富的3种分子功能;蛋白质激活级联、蛋白质-DNA复合物组装和核小体组织是3个最丰富的生物学过程。此外,富集在细胞成分的GO分析包括“核糖体”,富集在分子功能的GO分析包括“核糖体的结构成分”,并且核糖体与神经系统疾病密切相关。
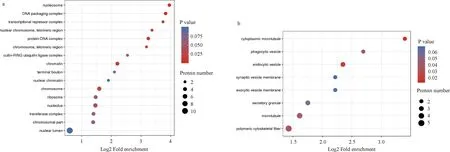
a. “模型/假手术”比较组;b. “SY治疗/模型”比较组。图4 细胞成分中差异蛋白的GO富集气泡图,气泡图中列出最显著富集的前20个分类的结果
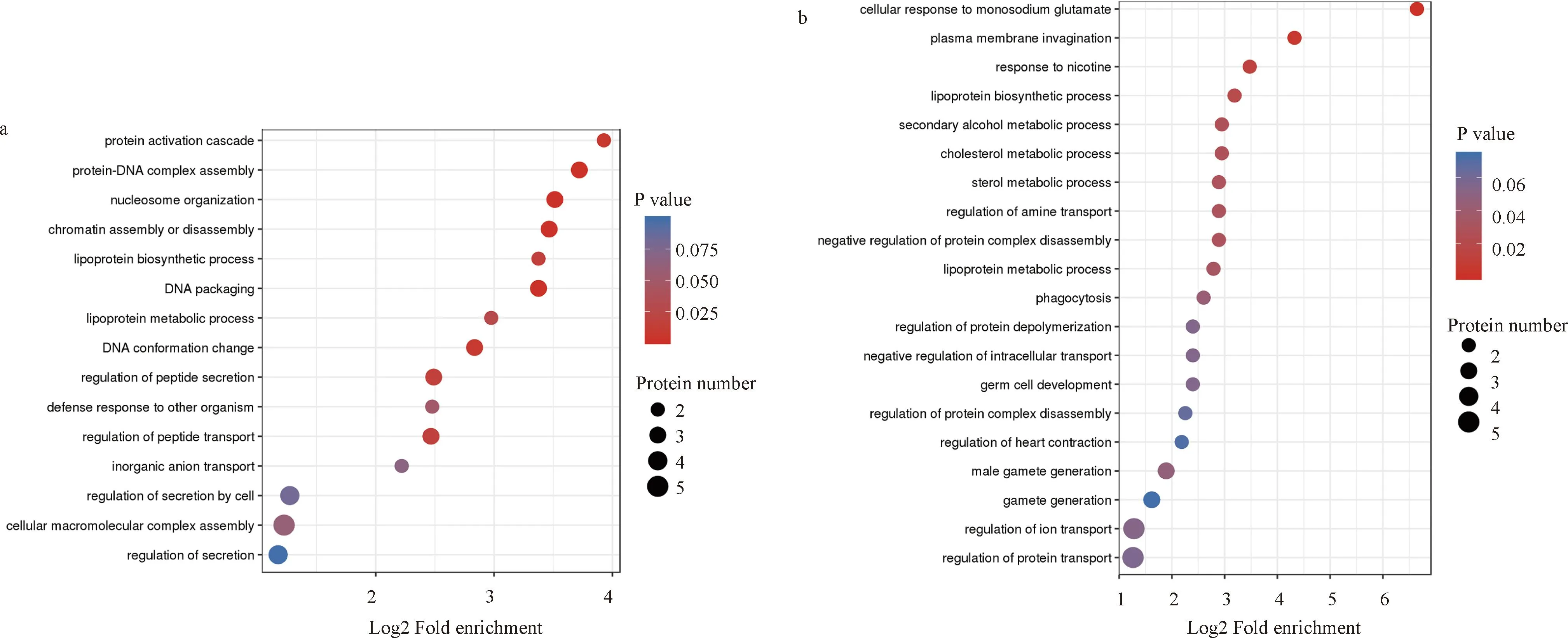
a.“模型/假手术”比较组;b. “SY治疗/模型”比较组。图6 生物学过程中差异蛋白的GO富集气泡图,气泡图列出最显著富集的前20个分类的结果
对于“SY治疗/模型”比较组中的差异蛋白,如图4b,图5b,图6b所示,细胞质微管,吞噬囊泡和内吞囊泡是富集程度最高的3个细胞成分;氧化还原酶活性、突触融合蛋白结合和药物结合是富集程度最高的3种分子功能;细胞对谷氨酸钠的反应、质膜内陷和对尼古丁的反应是3个最丰富的生物过程。
2.5 KEGG通路富集分析
通过KEGG通路富集分析,如表2所示。在“模型/假手术”比较组中,显著富集的通路包括核糖体、补体和凝血级联以及系统性红斑狼疮(P<0.05)。在“SY治疗/模型”比较组,差异蛋白富集的KEGG途径有细胞外基质(extracellular matrix,ECM)-受体相互作用、程序性坏死、帕金森病、内质网中的蛋白质加工、癌症和核糖体途径;然而,只有“ECM-受体相互作用”具有显著性(P<0.05)。虽然“核糖体”在“SY治疗/模型”比较组中并不具有显著性,但是“模型/假手术”比较组和“SY治疗/模型”比较组中的差异蛋白均富集在该通路上。

表2 差异蛋白所关联的KEGG通路
2.6 蛋白互作(PPI)网络分析
将两组的差异蛋白分别提交到STRING网站,生成蛋白相互作用网络。在“模型/假手术”比较组的差异蛋白中,有19个蛋白质被映射到网络中,并形成6个相互作用域,如图7a所示。在“SY治疗/模型”比较组中的差异蛋白中,有16种蛋白质被映射到网络中,并形成5个相互作用域,如图7b所示。其中“模型/假手术”比较组的域1和“SY治疗/模型”比较组的域2都具有Rpl34,并且这两个域中的差异蛋白都参与了“核糖体”途径。

a. “模型/假手术”比较组; b. “SY治疗/模型”比较组 (蓝色是下调的蛋白质,红色是上调的蛋白质)。图7 差异蛋白的蛋白互作网络
2.7 Western Blot验证
基于文献挖掘,发现在这9个共同的差异蛋白中,Mvd、Map6d1和Rpl34与AD的发病机理密切相关。因此,选择Mvd,Map6d1和Rpl34作为重要的差异蛋白,通过Western blot进行验证。
如图8所示,模型组的Mvd和Map6d1水平明显高于假手术组(P<0.05;P<0.01),模型组Rpl34水平明显低于假手术组(P<0.05)。与模型组相比,SY治疗组的Mvd和Map6d1水平显著降低(P<0.05),而Rpl34的水平显著升高(P<0.05)。Western blot结果与基于TMT的定量蛋白质组学分析结果一致。
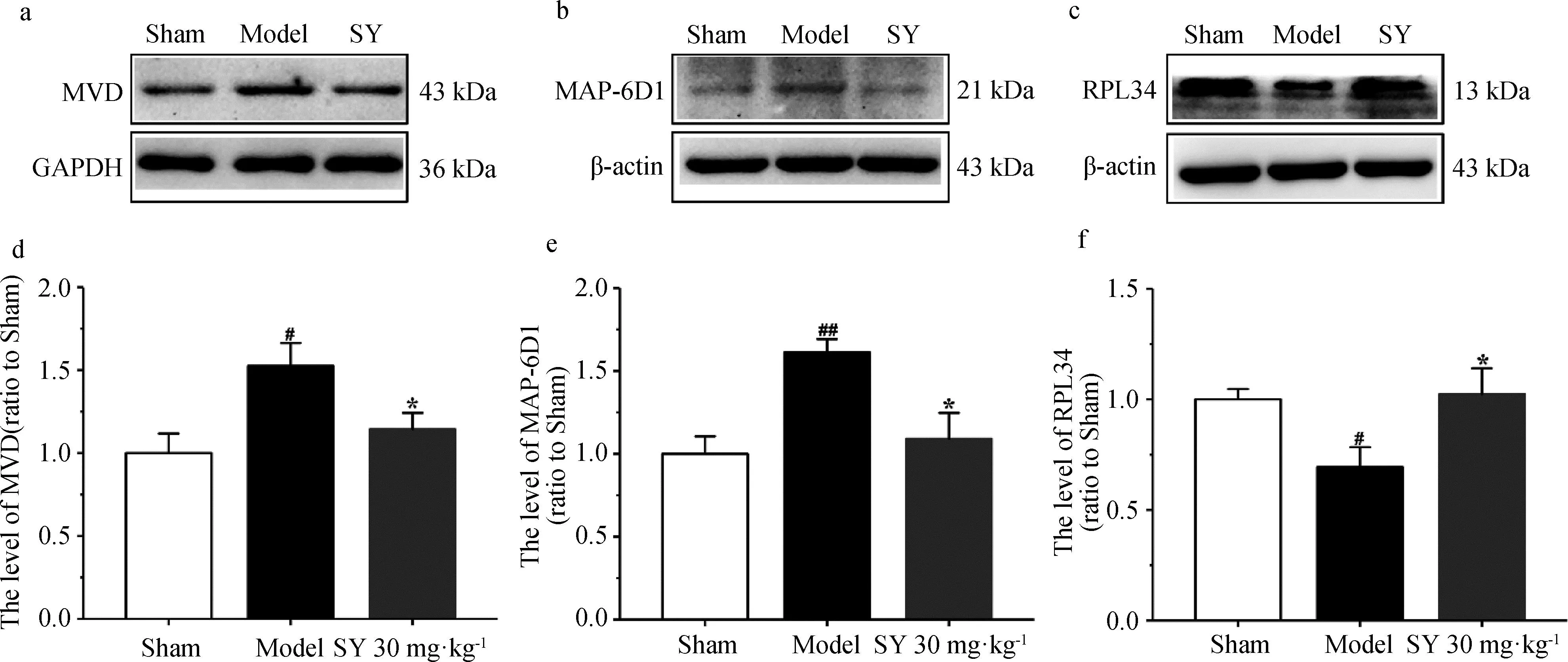
与假手术组相比,#P<0.05,##P<0.01;与模型组相比,*P <0.05。图8 通过Western Blot验证差异蛋白MVD, MAP-6d1, RPL34
3 讨论
Aβ级联假说表明,Aβ在大脑中的过度积累是AD病理变化的核心[8]。基于Aβ假说,本研究采用双侧海马注射Aβ1-42建立AD大鼠模型,其既能模拟AD的学习记忆能力异常,又能表现出神经毒性、炎症反应、突触损伤等AD典型病理特征。
目前,Morris水迷宫实验已成为AD基础研究中评估动物学习和记忆的经典方法。实验结果显示双侧海马注射Aβ1-42可显著延长模型大鼠的逃避潜伏期并且减少平台穿越次数和目标象限停留时间,严重影响了模型组大鼠的学习和记忆能力。SY治疗后的AD模型大鼠逃避潜伏期显著缩短,平台穿越次数和目标象限停留时间显著增加,表明SY改善了AD模型大鼠的学习和记忆能力。在学习和记忆过程中,突触可塑性常常伴随着形态变化,如树突棘的形成、脱落、扩张和萎缩。Golgi染色是常用的观察树突棘的形态的方法节[9]。Gogli染色结果表明Aβ1-42诱导的AD模型大鼠的树突棘的密度和长度明显降低,SY治疗后AD模型大鼠的树突状棘的密度与长度显著增加。
然而,Aβ如何诱导神经损伤,SY如何发挥其抗AD作用?为了全面确定有效的靶点和潜在的分子机制,本研究基于TMT标记技术进行了定量蛋白质组学实验。“SY治疗/模型”比较组中鉴定出58个差异蛋白,“模型/假手术”比较组鉴定出54个差异蛋白。在两个比较组中,有9个共同的差异蛋白,包括Ensa、Rpl34、Map6d1、Mvd、LOC100911713、Rpe、Fbxl4、RGD1561552和Zzz3。随后对差异蛋白进行了一系列的生物信息学分析。
(1)“核糖体”可能参与了Aβ1-42诱导的神经损伤。研究表明,核糖体的生物合成受转录后甲基化修饰的影响,进而影响蛋白质合成,尤其是突触相关蛋白质的翻译,并且核糖体结构和功能的稳定性与神经退行性疾病密切相关[10]。本研究发现,在“模型/假手术”比较组中差异蛋白的GO功能富集分析结果中包括“核糖体”以及“核糖体结构成分”并且KEGG通路富集分析包括“核糖体”通路。在“模型/假手术”比较组的蛋白质-蛋白质相互作用网络分析中,线粒体核糖体蛋白L21(Mitochondrial ribosomal protein L21, Mrpl21)、60S核糖体蛋白L6(60S ribosomal protein L6, Rpl6)、60S核糖体蛋白L26(60S ribosomal protein L26, Rpl26)、Rpl34和肽基tRNA水解酶2(Peptidyl-tRNA hydrolase 2, Ptrh2)形成了一个相互作用域,它们均参与了“核糖体”通路。以上结果提示“核糖体”可能参与了Aβ1-42诱导的神经损伤。
(2)“补体和凝血级联”可能参与Aβ1-42诱导的神经损伤。大量研究表明补体和凝血级联在AD的病理中起重要作用,如一些补体调节因子会引起炎症和神经变性,在凝血级联反应中,血脑屏障和血管损伤导致纤维蛋白原沉积,并伴有血管成分炎症和神经元功能障碍[11-13]。本研究也有类似的发现,“模型/假手术”比较组中差异蛋白的KEGG通路富集分析也包括“补体和凝血级联”。结果提示“补体和凝血级联”可能与Aβ1-42诱导的神经损伤有关。
(3)“ECM-受体相互作用”可能与SY的神经保护作用有关。有研究表明,神经干细胞和ECM之间的特异性相互作用是由跨膜分子介导的,主要是整合素、蛋白多糖、CD36或其他细胞表面相关成分,这些相互作用直接或间接地控制神经干细胞的活动[14-15]。 神经干细胞可以产生多种细胞因子,如脑源性神经营养因子、神经生长因子和胶质源性神经营养因子,促进突触的发生,调节其可塑性[16-17]。因此,ECM-受体相互作用可能通过对神经干细胞的调节而在神经保护中发挥重要作用。在本研究中,“SY治疗/模型”比较组中差异蛋白的KEGG通路富集分析也涉及到“ECM-受体相互作用”。提示SY的神经保护作用可能与ECM-受体相互作用有关。
Rpl34、Mvd和Map6d1可能是SY发挥神经保护作用的重要分子靶点。Rpl34是核糖体60S亚基的结构成分,参与核糖体的翻译功能,核糖体结构和功能的稳定性与神经退行性疾病密切相关。研究发现,Rpl34基因敲除通过抑制JAK/STAT3信号通路来抑制脑胶质瘤细胞的增殖和迁移[18]。Rpl34有望成为治疗神经相关疾病的潜在靶点。Mvd是胆固醇合成中重要的限速酶之一,其表达水平影响胆固醇合成速率,Aβ会影响类固醇合成相关基因Mvd的表达[19]。Map6d1是一种微管细胞骨架结构,参与微管解聚的负调控。微管聚合与解聚的动态平衡所调节神经干细胞的正常增殖分化对中枢神经系统具有重要意义,而Map6d1表达水平紊乱会影响微管的正常聚合和解聚[20-21]。在本研究中,模型组的Rpl34水平明显低降低,Mvd和Map6d1的水平明显升高。而SY治疗组Rpl34水平显著升高,Mvd和Map6d1水平显著降低。
结论如下:SY可明显改善Aβ1-42诱导的AD模型大鼠学习和记忆能力,减轻树突棘的形态学损伤。“核糖体”和“补体和凝血级联”可能参与Aβ1-42诱导的神经损伤,同时SY可能通过影响ECM受体相互作用发挥神经保护作用。此外,Rpl34、Mvd和Map6d1可能是SY神经保护作用的分子靶点。

