半夏提取物通过AMPK/FOXO3a 信号通路对哮喘大鼠气道平滑肌细胞增殖、凋亡的影响
黄丽萍 郭腾飞 张文青 (东莞职业技术学院卫生健康学院,东莞 523000)
哮喘是一种异质性疾病,其特征为气道嗜酸性炎症和支气管组织结构变化,称为气道重塑[1]。气道重塑包括许多过程,如上皮细胞破坏增加、气道平滑肌数量增多及皮下纤维化加重[2]。因此,气道平滑肌细胞(airway smooth muscle cells,ASMCs)凋亡减少可能参与哮喘重塑过程[3]。半夏提取物(extract of pinellia,EP)是从天南星科植物半夏的干燥块茎中提取的产物,具有镇咳、祛痰、平喘、抗菌、抗炎、抗肿瘤作用[4]。研究报道,EP 灌胃能够治疗卵白蛋白致敏小鼠变态反应性哮喘,同时抑制肺组织中TNF-α、IL-4 等炎症因子分泌[5]。但EP 对哮喘大鼠ASMCs 增殖、凋亡的影响尚不清楚。因此,本研究主要探讨EP 对哮喘大鼠ASMCs 增殖、凋亡的影响,为哮喘治疗提供新方向。
1 材料与方法
1.1 材料 雄性SD大鼠购自广东至远生物医药科技有限公司,生产许可证号:SCXK(粤)2021-0057,均在温控和光控制环境中饲养,所有动物实验均遵循3R原则,经东莞职业技术学院动物伦理委员会批准(D210104)。EP 购自南京道斯夫生物科技有限公司;AMPK 抑制剂Compound C 购自上海意杰生物科技有限公司;MTT 检测试剂盒、细胞凋亡检测试剂盒、ECL 化学发光试剂盒均购自碧云天生物有限公司;IL-6、TNF-α ELISA 检测试剂盒购自上海一基生物试剂有限公司;兔源一抗CyclinD1、PCNA、Bax、Caspase-3、Cleaved-Caspase-3、AMPK、p-AMPK、叉头框蛋白O3a(FOXO3a)、p-FOXO3a、β-actin 及辣根过氧化物酶标记的羊抗兔二抗均购自北京索莱宝生物科技有限公司。
1.2 方法
1.2.1 哮喘模型建立 参照文献[6]构建哮喘模型。大鼠适应性培养1周后,第1天和第8天腹腔注射含100 μg 1%卵清蛋白和200 mg氢氧化铝的溶液1 ml 致敏,第15 天起每天给予大鼠1%卵清蛋白激发液雾化吸入激发气道30 min,1 次/d,持续4 周,大鼠出现呼吸急促、烦躁不安、腹肌抽搐等症状为造模成功。对照组大鼠用生理盐水进行致敏与雾化。
1.2.2 大鼠ASMCs 培养及鉴定 根据亓玉心等[7]方法分离大鼠ASMCs,组织贴壁法纯化细胞,将ASMCs 在含20%胎牛血清的DMEM 培养基中培养。取第5 代对数生长期ASMCs,使用小鼠单克隆抗体α-肌动蛋白(α-actin)鉴定ASMCs。药物处理前24 h,ASMCs 达到70%汇合时转移到无血清DMEM 培养基中进行生长同步。根据参考文献及预实验结果,将ASMCs 分为对照组(含正常大鼠血清的培养液)、模型组(含致敏大鼠血清的培养液)、EP 组(含致敏大鼠血清和300 mg/L EP 的培养液)、Compound C 组(含致敏大鼠血清和10 mmol/L Compound C 的培养液)、EP+Compound C 组(含致敏大鼠血清、300 mg/L EP 和10 mmol/L Compound C 的培养液),37 ℃、5%CO2培养48 h后用于后续实验[8-9]。
1.2.3 MTT 检测细胞增殖活性 将2×103个细胞接种于96 孔板,孵育48 h,每孔加入20 μl MTT(5 mg/ml),37 ℃孵育4 h,每孔加入150 μl 二甲基亚砜溶解结晶体。酶标仪检测490 nm波长处吸光度。
1.2.4 流式细胞术检测细胞凋亡 收集细胞并用PBS 洗涤,加入5 μl Annexin V-FITC 和 5 μl PI,室温避光孵育30 min,流式细胞术检测细胞凋亡。细胞凋亡率(%)=(凋亡细胞数/总细胞数)×100%。
1.2.5 ELISA检测细胞上清中炎症因子IL-6、TNF-α水平 收集上清,严格按照IL-6、TNF-α ELISA 检测试剂盒说明书操作稀释,加样,加入酶标抗体37 ℃孵育1 h,洗涤,加入显色剂37 ℃避光孵育15 min,终止反应,测定各孔吸光度,检测各组上清中IL-6、TNF-α水平。
1.2.6 Western blot 检测蛋白表达 RIPA 裂解缓冲液提取总蛋白,BCA 法检测蛋白浓度,电泳、转膜、封 闭,加 入 一 抗CyclinD1(1∶2 000)、PCNA(1∶2 000)、Bax(1∶2 000)、Caspase-3(1∶1 000)、Cleaved-Caspase-3(1∶1 000)、p-AMPK(1∶2 000)、AMPK(1∶1 000)、p-FOXO3a(1∶2 000)、FOXO3a(1∶1 000)、β-actin(1∶1 000) 4 ℃孵育过夜,加入HRP 偶联的羊抗兔二抗37 ℃孵育2 h,ECL 化学发光试剂盒观察蛋白显色情况,Image J 软件分析目的蛋白灰度值。
1.3 统计学分析 采用Graph Pad Prism 6.0 软件进行统计学分析,数据均表示为±s。单因素方差分析用于多组间比较,进一步两组间比较采用SNK-q检验,P<0.05表示差异有统计学意义。
2 结果
2.1 大鼠ASMCs 培养及鉴定 ASMCs 生长至85%汇合时,细胞呈长梭形,且平行生长,呈现明显的“蜂窝状”生长(图1A)。免疫荧光染色显示,98%细胞的细胞质中出现绿色荧光的肌丝,α-actin 呈阳性表达,证明所培养细胞为ASMCs(图1B)。
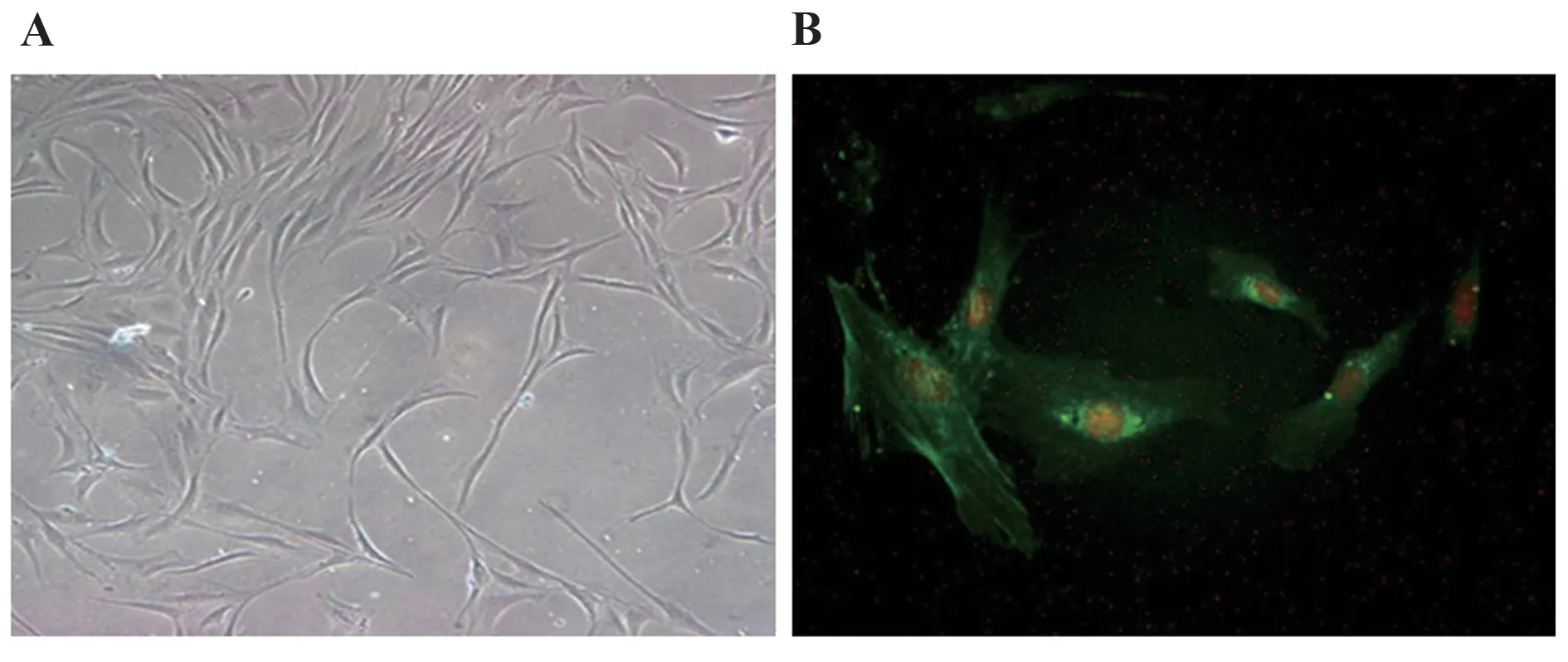
图1 大鼠ASMCs的培养(A)及鉴定(B)Fig.1 Culture (A) and identification (B) of ASMCs in rats
2.2 各组细胞增殖活性比较 与对照组比较,模型组OD490升高(P<0.05);与模型组比较,EP组OD490降低,Compound C 组OD490升高(P<0.05);与EP 组比较,EP+Compound C组OD490升高(P<0.05,表1)。
表1 各组细胞增殖活性比较(±s,n=6)Tab.1 Comparison of proliferation activities of cells in each group (±s, n=6)

表1 各组细胞增殖活性比较(±s,n=6)Tab.1 Comparison of proliferation activities of cells in each group (±s, n=6)
Note:Compared with control group, 1)P<0.05; compared with model group, 2)P<0.05; compared with EP group, 3)P<0.05.
OD490 0.35±0.02 0.82±0.071)0.52±0.042)1.14±0.092)0.78±0.053)Groups Control Model EP Compound C EP+Compound C
2.3 各组细胞凋亡率比较 与对照组比较,模型组细胞凋亡率降低(P<0.05);与模型组比较,EP 组细胞凋亡率升高,Compound C 组细胞凋亡率降低(P<0.05);与EP 组比较,EP+Compound C 组细胞凋亡率降低(P<0.05,图2、表2)。
表2 各组细胞凋亡率比较(±s,n=6)Tab.2 Comparison of apoptosis rates of cells in each group (±s,n=6)

表2 各组细胞凋亡率比较(±s,n=6)Tab.2 Comparison of apoptosis rates of cells in each group (±s,n=6)
Note:Compared with control group, 1)P<0.05; compared with model group, 2)P<0.05; compared with EP group, 3)P<0.05.
Apoptosis rate/%18.86±2.21 6.27±1.381)14.35±1.672)2.35±0.682)8.62±1.233)Groups Control Model EP Compound C EP+Compound C
2.4 各组细胞增殖、凋亡相关蛋白表达比较 与对照组比较,模型组CyclinD1、PCNA 蛋白表达显著升高,Bax、Caspase-3、Cleaved-Caspase-3 蛋白表达显著降低(P<0.05);与模型组比较,EP 组CyclinD1、PCNA 蛋白表达显著降低,Bax、Caspase-3、Cleaved-Caspase-3 蛋白表达显著升高,而Compound C 组CyclinD1、PCNA 蛋白表达显著升高,Bax、Caspase-3、Cleaved-Caspase-3 蛋白表达显著降低(P<0.05);与EP 组比较,EP+Compound C 组CyclinD1、PCNA 蛋白表达显著升高,Bax、Caspase-3、Cleaved-Caspase-3 蛋白表达显著降低(P<0.05,图3、表3)。
表3 各组细胞增殖、凋亡相关蛋白表达比较(±s,n=6)Tab.3 Comparison of expressions of proliferation-related proteins and apoptosis-related proteins in each group (±s,n=6)
Note:Compared with control group, 1)P<0.05; compared with model group, 2)P<0.05; compared with EP group, 3)P<0.05.
Cleaved-Caspase-3/β-actin 1.07±0.11 0.42±0.031)0.79±0.062)0.21±0.012)0.54±0.043)Groups Control Model EP Compound C EP+Compound C CyclinD1/β-actin 0.41±0.02 0.88±0.071)0.57±0.042)1.15±0.122)0.84±0.053)PCNA/β-actin 0.52±0.03 0.93±0.081)0.66±0.042)1.22±0.082)0.89±0.063)Bax/β-actin 0.69±0.04 0.28±0.021)0.54±0.052)0.12±0.012)0.36±0.023)Caspase-3/β-actin 1.36±0.21 0.69±0.071)1.08±0.122)0.37±0.032)0.81±0.063)
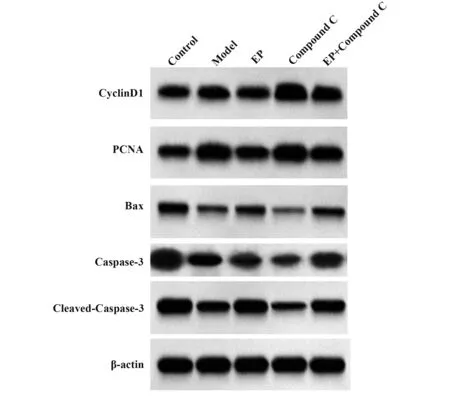
图3 Western blot 检测各组细胞CyclinD1、PCNA、Bax、Caspase-3、Cleaved-Caspase-3蛋白表达Fig.3 CyclinD1, PCNA, Bax, Caspase-3 and Cleaved-Caspase-3 protein expressions in each group detected by Western blot
2.5 各组细胞上清中炎症因子IL-6、TNF-α 水平比较 与对照组比较,模型组IL-6、TNF-α 水平显著升高(P<0.05);与模型组比较,EP 组IL-6、TNF-α 水平显著降低,Compound C组IL-6、TNF-α水平显著升高(P<0.05);与EP 组比较,EP+Compound C 组IL-6、TNF-α水平显著升高(P<0.05,表4)。
表4 各组细胞上清炎症因子IL-6、TNF-α 水平比较(±s,n=6,pg/ml)Tab.4 Comparison of IL-6 and TNF-α levels in cell supernatants of each group (±s,n=6,pg/ml)

表4 各组细胞上清炎症因子IL-6、TNF-α 水平比较(±s,n=6,pg/ml)Tab.4 Comparison of IL-6 and TNF-α levels in cell supernatants of each group (±s,n=6,pg/ml)
Note:Compared with control group, 1)P<0.05; compared with model group, 2)P<0.05; compared with EP group, 3)P<0.05.
TNF-α 62.35±4.41 255.14±18.321)93.36±7.182)327.73±29.242)187.42±15.623)Groups Control Model EP Compound C EP+Compound C IL-6 186.67±16.67 329.42±30.371)215.55±21.022)467.73±42.212)269.94±18.793)
2.6 各组细胞AMPK/FOXO3a 通路相关蛋白表达比较 与对照组比较,模型组p-AMPK/AMPK、p-FOXO3a/FOXO3a水平显著降低(P<0.05);与模型组比较,EP 组p-AMPK/AMPK、p-FOXO3a/FOXO3a水 平 显 著 升 高,Compound C 组p-AMPK/AMPK、p-FOXO3a/FOXO3a 水平显著降低(P<0.05);与EP组比较,EP+Compound C组p-AMPK/AMPK、p-FOXO-3a/FOXO3a水平显著降低(P<0.05,图4、表5)。
表5 各组细胞AMPK/FOXO3a 通路相关蛋白表达比较(±s,n=6)Tab.5 Comparison of AMPK/FOXO3a pathway related protein expressions in each group (±s,n=6)
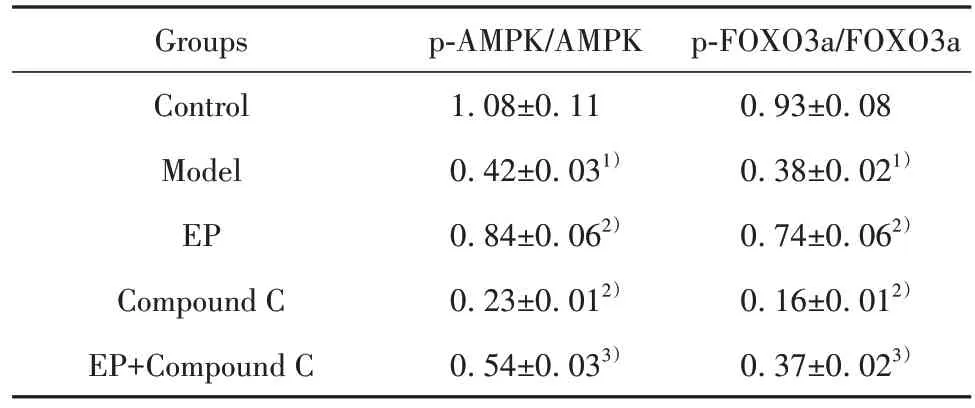
表5 各组细胞AMPK/FOXO3a 通路相关蛋白表达比较(±s,n=6)Tab.5 Comparison of AMPK/FOXO3a pathway related protein expressions in each group (±s,n=6)
Note:Compared with control group, 1)P<0.05; compared with model group, 2)P<0.05; compared with EP group, 3)P<0.05.
p-FOXO3a/FOXO3a 0.93±0.08 0.38±0.021)0.74±0.062)0.16±0.012)0.37±0.023)Groups Control Model EP Compound C EP+Compound C p-AMPK/AMPK 1.08±0.11 0.42±0.031)0.84±0.062)0.23±0.012)0.54±0.033)

图4 Western blot 检测各组细胞AMPK/FOXO3a 通路相关蛋白表达Fig.4 Western blot analysis of AMPK/FOXO3a pathway related protein expressions in each group
3 讨论
哮喘是一种呼吸道炎症性疾病,可能由接触过敏原或其他环境刺激物引起,导致支气管收缩、喘息和呼吸急促[10]。哮喘的主要病理特征为气道重塑,而ASMCs 作为气道重塑的主要成分,可通过自身膨胀和增殖直接参与气道壁增厚,还通过表型转化、迁移功能改变、炎症因子和细胞外基质分泌促进气道重塑[11-12]。据报道TNF-α、IL-6等炎症因子介导哮喘气道炎症过程[13-14];ASMCs 异常增殖为哮喘气道重塑发生奠定了基础[15]。本研究利用含致敏大鼠血清的培养液培养ASMCs,结果显示,与对照组比较,模型组TNF-α、IL-6 水平显著升高,细胞增殖活性升高,凋亡率降低,再次证实哮喘模型大鼠构建成功。增殖标志基因PCNA、CyclinD1 可反映细胞增殖能力强弱,其表达与增殖能力呈正相关[16-17];Bax、Cleaved-Caspase-3是重要的促细胞凋亡基因[18]。炎症进展与细胞凋亡关系重大,细胞凋亡率升高意味细胞数量减少,却增加细胞内Cleaved-Caspase-3 表达,而Cleaved-Caspase-3 表达升高活化Bcl-2 家族蛋白,从而使促炎细胞分泌增强,抑制炎症发生[19]。因此,本课题组推测TNF-α、IL-6 水平降低可能与凋亡增强导致的细胞数量减少及相关蛋白失调有关。本研究发现,与对照组比较,模型组细胞PCNA、CyclinD1 蛋白表达及TNF-α、IL-6 水平升高,而Bax、Cleaved-Caspase-3蛋白表达降低,再次证明模型组细胞增殖与凋亡异常,也验证了本研究前期推测。
中医药已广泛用于各种疾病治疗并显示出良好疗效。半夏主要含类黄酮、甾醇、糖苷和不饱和脂肪酸等活性成分,研究报道,半夏通过下调MMP2和IL-4表达改善卵清蛋白诱发的哮喘[20];EP 可通过上调AQP5 表达减轻肺水肿,通过抑制炎症因子TNF-α 表达实现[21]。EP 对哮喘大鼠ASMCs 增殖、凋亡的影响尚不清楚。本研究显示,与模型组比较,EP 组细胞TNF-α、IL-6 水平、增殖活性降低,凋亡率升高,提示EP 可抑制哮喘大鼠ASMCs 炎症反应及增殖,促进细胞凋亡。
AMPK/FOXO3a 在细胞增殖、凋亡中发挥重要调控作用。如澳洲茄碱通过激活AMPK/FOXO3a 轴抑制急性单核细胞白血病增殖[22];黄芩清热除痹胶囊含药血清通过激活AMPK 直接磷酸化FOXO3a 增强其转录活性,改善类风湿关节炎患者氧化应激状态[23];AMPK 通过磷酸化其下游靶标FOXO3a 抑制哮喘炎症反应[24]。本研究显示,模型组细胞p-AMPK/AMPK、p-FOXO3a/FOXO3a水平显著降低,而EP 干预后细胞p-AMPK/AMPK、p-FOXO3a/FOXO3a水平显著升高,提示EP 可能通过激活AMPK/FOXO3a 通路抑制哮喘大鼠ASMCs 增殖,促进细胞凋亡。为验证该推测,本研究利用AMPK 抑制剂Compound C 进行干预,结果发现,与模型组比较,Compound C 组 细 胞p-AMPK/AMPK、p-FOXO3a/FOXO3a 水平显著降低,细胞增殖活性及炎症因子TNF-α、IL-6 水平显著升高,细胞凋亡受抑制;与EP组比较,EP+Compound C 组细胞上述指标呈相同趋势,证明推测正确,即EP 可能通过激活AMPK/FOXO3a 通路抑制哮喘大鼠ASMCs 增殖,促进细胞凋亡。
综上,EP 可能通过激活AMPK/FOXO3a 通路抑制哮喘大鼠ASMCs 增殖,促进细胞凋亡。但EP 可能通过调控其他通路发挥对哮喘大鼠ASMCs 的增殖抑制及凋亡促进作用,有待进一步探究。