芒果苷通过MMP9调控巨噬细胞M2极化对胰腺癌的作用及其机制研究
崔连鸷 赵丹宁 孙洪帅 翟 悦 潘 悦 野丽莉 (吉林省肿瘤医院检验科,长春 130012)
胰腺癌作为一种恶性程度极高的消化系统肿瘤,严重危害人类健康[1]。胰腺癌发生发展与免疫微环境紊乱密切相关,因此探究胰腺癌免疫微环境调控并针对其开发新的治疗药物对胰腺癌临床治疗具有重要意义[2]。巨噬细胞是免疫微环境的重要组成,研究表明,M0巨噬细胞在IL-4和IL-13激活下形成M2 巨噬细胞,M2 巨噬细胞表面标志物有CD206、CD163、CD204 等,还可分泌IL-10、TGF-β 和Arg-1 等因子;肿瘤研究中,肿瘤相关巨噬细胞(tumor-associated macrophages,TAM)是癌症发生发展的重要影响因素,M2 巨噬细胞既能抑制炎症,又能促进肿瘤增殖,通过TGF-β/Smads 信号通路发挥作用,分泌TGF-β,不仅促进Smad2/3 磷酸化,且显著增强Smad4 表达[3-5]。研究表明,M2 型TAM 在胰腺癌组织中表达升高,与胰腺癌发生发展及预后关系密切[6]。因此抑制M2 型巨噬细胞是治疗胰腺癌的重要因素。MMP9(明胶酶B/92 kD Ⅳ型胶原酶)与M2 型TAM 密切相关,同时也是治疗胰腺癌的重要靶点,可通过调控M2 型TAM 对肿瘤起治疗作用[7-8]。芒果苷作为一种天然化合物,药理活性广泛,对多种疾病均具有治疗作用,尤其对多种肿瘤均具有良好的治疗效果[9],但其对胰腺癌的作用及机制尚不清楚。因此,本研究拟阐明芒果苷对胰腺癌的治疗效果,并探讨其对MMP9 及M2 型TAM 的调控作用,探究其作用机制。
1 材料与方法
1.1 材料 4~5 周龄C57BL/6 雄性健康小鼠,体质量20~22 g,购自辽宁长生生物技术股份有限公司,许可证号:SCXK(辽)2020-0001,伦理审批号:DUTFM230719-02。Pan02 小鼠胰腺癌细胞购自中国科学院上海细胞库;RPMI1640 培养基、胎牛血清、RIPA 缓冲液购自Biosharp;芒果苷购自Sigma 公司(实验级);蛋白印迹分析试剂购自北京百欧泰生物科技有限公司;TGF-β、IL-10、Arg-1 ELISA 试剂盒购自康肽生物科技有限公司;逆转录试剂盒购自TaKaRa(Code:RR047A);qRT-PCR 试 剂 盒 购 自Novoprotein公司;荧光标记DAPI购自索莱宝科技有限公司;免疫组化试剂购自海氏海诺医疗科技有限公司;其他生化试剂均为进口分装或国产分析纯。
1.2 方法
1.2.1 腹腔巨噬细胞提取 脱臼处死小鼠,浸泡于75%乙醇,在超净台中剪开皮毛,完全暴露腹腔,乙醇棉球擦拭腹腔表面,用镊子夹起腹膜,吸取冷PBS注入腹腔,手指大力揉腹部,镊子夹起腹膜再用针管吸出灌洗液,灌洗液中的巨噬细胞即被采集[10]。
1.2.2 小鼠胰腺癌皮下移植瘤模型构建 取Panc02 细胞悬液(4×107个/ml),每只小鼠于右背侧近腋部皮下接种200 μl 细胞悬液,共接种20 只,待肿瘤体积长至100 mm3时,随机将小鼠平均分为2组:模型组(生理盐水200 μl,腹腔注射)、芒果苷组(5 mg/kg,腹腔注射),每天给药1 次。待1 周后肿瘤成瘤,隔天用游标卡尺测量肿瘤长径和宽径,肿瘤体积按V=0.5×长径×宽径2计算,接种肿瘤4 周后处死所有小鼠,剥取肿瘤并拍照称重,观察芒果苷对肿瘤生长的抑制作用[11]。
1.2.3 蛋白质印迹分析 用RIPA 缓冲液(RIPA∶PMSF为1∶50)将Panc02细胞和小鼠胰腺组织裂解,细胞置于冰上快速充分研磨1 min;肿瘤组织放于液氮后置于破碎机研磨充分破碎,冰上放置15 min,4 ℃、11 000 r/min 离心15 min,吸取上清于新的离心管,加入含β-巯基乙醇的上样缓冲液后95 ℃金属浴加热10 min,制备SDS-PAGE 浓缩胶和分离胶进行电泳,转PVDF 膜(300 mA),TBST 洗膜,脱脂牛奶封闭,一抗4 ℃孵育过夜,回收一抗后TBST溶液清洗3次,二抗孵育1 h 后回收,清洗,配制显影液,均匀孵于PVDF 膜,显影仪中显影。检测M2型巨噬细胞极化 相 关 蛋 白pSMAD2、SMAD2、pSMAD3、SMAD3、SMAD4表达。
1.2.4 ELISA 取共培养的巨噬细胞培养液及小鼠血清为样本,分别设空白孔、待测样品孔,按试剂盒步骤检测M2 巨噬细胞标志物TGF-β、Arg-1 和IL-10水平,酶标仪测量450 nm处各孔光密度(OD)。
1.2.5 qRT-PCR 将小鼠胰腺组织剪去绿豆粒大小组织块,Trizol 法提取RNA。将总RNA 溶液稀释成1 μg/μl,按逆转录试剂盒说明书进行逆转录,按照qRT-PCR 试剂盒操作说明进行qRT-PCR 反应,检测小鼠胰腺组织MMP9 mRNA表达。
1.2.6 免疫荧光 将小鼠胰腺组织切片根据免疫荧光说明书制作,荧光显微镜观察MMP9 与巨噬细胞表达情况(100倍),采集分析图像。
1.2.7 免疫组织化学分析 Ki67 为肿瘤细胞增殖标志物,根据免疫组化说明书制作小鼠胰腺组织切片,显微镜观察Ki67 与MMP9 表达(100 倍),采集分析图像。
1.2.8 巨噬细胞与Panc02 小鼠胰腺癌细胞共培养
采用巨噬细胞-Panc02 细胞共培养体系,利用Transwell 共培养模型,下室为巨噬细胞,上室为Panc02 细胞。共培养体系分为3 组:CON 组、Model组、芒果苷(MGF)组,CON 组下室为腹腔提取的M0巨噬细胞,Model 组与MGF 组下室为20 ng/ml IL-4诱导24 h 得到的M2 巨噬细胞。将Panc02 细胞培养于共培养体系上室,孵育24 h,MGF 组加入芒果苷(10 μg/ml) 37 ℃继续培养。给药24 h 后,每孔加入10 μl 0.5%MTT 溶液(5 mg/ml),活细胞线粒体中的琥珀酸脱氢酶可将MTT 还原为水不溶性的蓝紫色结晶甲瓒并沉积在细胞中,而死细胞无此功能。恒温孵育4 h,孵育完结后吸上清,每孔加入150 μl DMSO,DMSO 可溶解细胞中的甲瓒,酶标仪测定吸光度,即可反映细胞存活数,摇床上低速振荡10 min,使结晶甲瓒充分溶解于DMSO,酶标仪测定490 nm处各孔吸光度。
1.3 统计学处理 使用 Prism 8.0 软件(Graph Pad Software Inc,San Dieg,CA)进行统计学分析,数据表示为±s,采用双尾t检验或单向方差分析数据,进行事后检验,P<0.05为差异有统计学意义。
2 结果
2.1 芒果苷治疗胰腺癌的体内效果评价 构建小鼠胰腺癌皮下移植瘤模型,与模型组相比,芒果苷治疗后胰腺癌体积减小,生长变慢(图1A、B);为验证芒果苷对胰腺癌的治疗效果,免疫组化检测两组小鼠胰腺癌组织中肿瘤细胞增殖标志物Ki67 表达,结果显示,芒果苷组显微镜下棕色明显减少(图1C),说明肿瘤细胞增殖明显减弱,芒果苷对胰腺癌有良好的治疗效果。

图1 芒果苷对小鼠胰腺癌的体内治疗作用Fig.1 Therapy effect of mangiferin on pancreatic cancer in vivo
2.2 芒果苷对胰腺癌中M2 型巨噬细胞表达的影响 为验证芒果苷可抑制胰腺癌M2 型巨噬细胞极化,ELISA 检测两组小鼠血清中M2型巨噬细胞标志物TGF-β、Arg-1、IL-10 表达,免疫荧光检测小鼠肿瘤组织中M2 型巨噬细胞特征性标志物CD206 表达,结果显示,芒果苷组小鼠胰腺癌组织中M2 型巨噬细胞标志物TGF-β、Arg-1、IL-10表达降低(图2A);荧光显微镜下显示,芒果苷组绿色荧光明显减弱(图2B),说明芒果苷抑制胰腺癌M2 型巨噬细胞表达。

图2 芒果苷对小鼠胰腺癌M2型极化巨噬细胞表达的影响Fig.2 Effect of mangiferin on expression of M2 polarized macrophages in pancreatic cancer
2.3 芒果苷对MMP9及下游M2巨噬细胞极化相关信号通路表达的影响 为验证芒果苷抑制胰腺癌中MMP9 表达,分别采用免疫荧光、免疫组化、qRTPCR 检测对照组和芒果苷组小鼠胰腺癌组织中MMP9 表达,结果显示,与模型组相比,荧光显微镜下绿色明显减少,显微镜观察免疫组化切片棕色明显减少,qRT-PCR 结果同样显示MMP9 含量明显降低(图3A~C)。采用蛋白印迹分析检测两组小鼠胰腺癌组织M2 型巨噬细胞极化相关蛋白pSMAD2、SMAD2、pSMAD3、SMAD3、SMAD4及MMP9表达,结果显示其表达均降低(图3D)。提示芒果苷通过抑制MMP9 及其下游M2 型巨噬细胞极化相关通路抑制胰腺癌中巨噬细胞M2型极化。
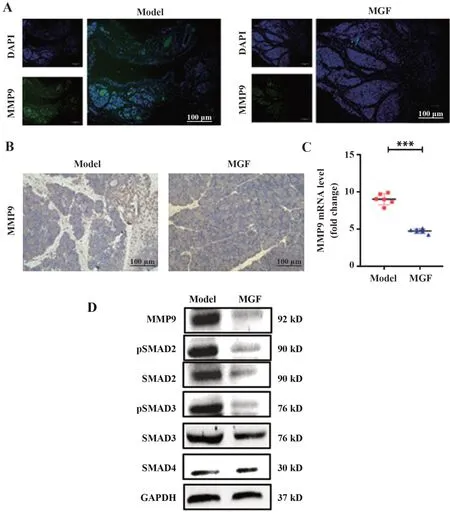
图3 芒果苷对小鼠胰腺癌中MMP9及下游信号通路表达的影响Fig.3 Effect of mangiferin on MMP9 expression and its downstream in pancreatic cancer
2.4 芒果苷体外治疗胰腺癌的效果评价 为验证芒果苷体外通过抑制巨噬细胞M2 型极化治疗胰腺癌,构建M2极化巨噬细胞-胰腺癌细胞共培养模型,结果显示,与M0巨噬细胞共培养相比,M2型极化巨噬细胞可促进胰腺癌细胞增殖(图4A);ELISA 检测共培养中巨噬细胞培养液M2 型巨噬细胞标志物TGF-β、Arg-1、IL-10表达,结果表明,加入芒果苷后,3 种标志物表达明显降低(图4B);免疫荧光检测共培养模型M2型极化巨噬细胞中MMP9表达,结果显示,芒果苷给药后,荧光显微镜下绿色明显减少(图4C);蛋白印迹分析检测共培养模型中M2 型巨噬细胞极化相关蛋白pSMAD2、SMAD2、pSMAD3、SMAD3、SMAD4 及MMP9 表达,结果显示其表达均显著降低(图4D)。表明芒果苷体外可通过抑制MMP9 及下游M2 巨噬细胞极化及相关信号通路治疗胰腺癌。
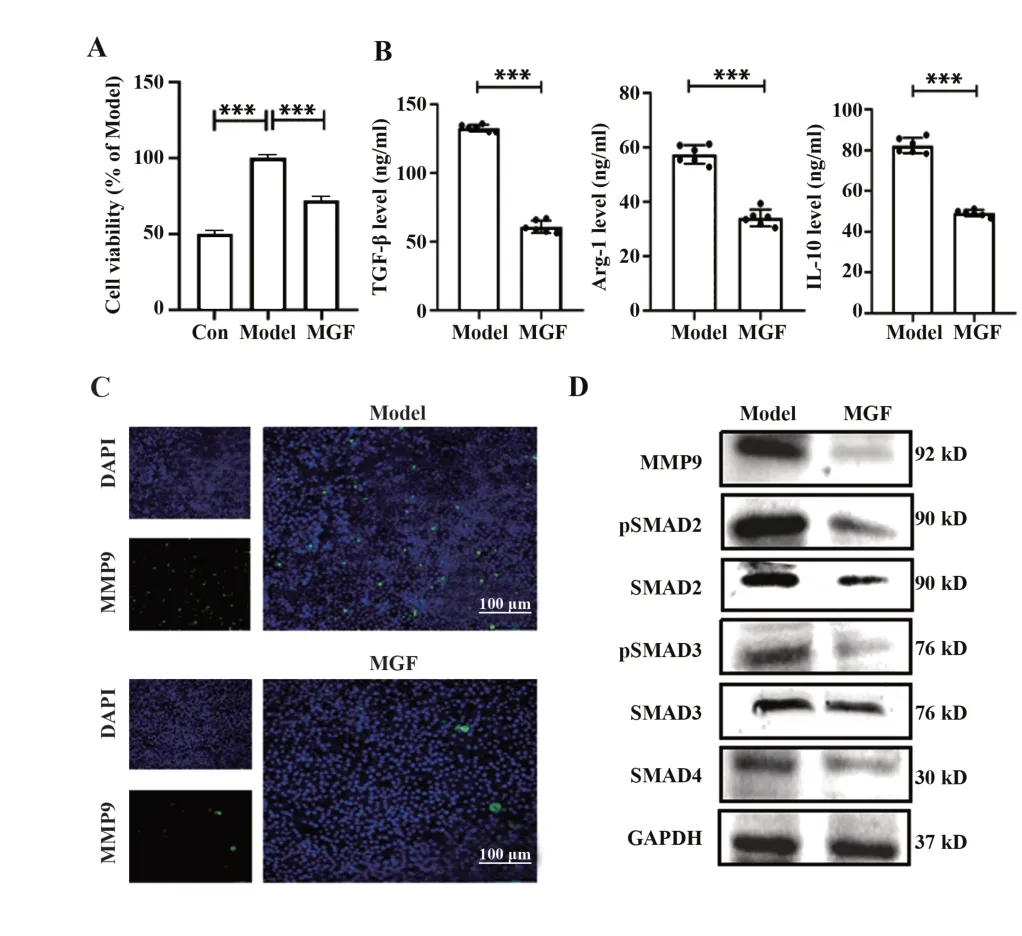
图4 芒果苷体外调控M2巨噬细胞对胰腺癌的影响Fig.4 Effect of mangiferin on M2 polarized macrophages induced pancreatic cancer in vitro
3 讨论
胰腺癌作为消化道恶性肿瘤,患者发现即晚期,失去治疗机会,且胰腺癌化疗后极易产生耐药,临床治疗效果有限。大量研究表明胰腺癌与免疫微环境密切相关,是一个发病机制复杂的慢性病[12-13]。TAM 是肿瘤免疫微环境中主要的免疫细胞,可参与胰腺癌发生发展调控,包括胰腺癌细胞增殖、侵袭、免疫逃逸及化疗耐药等,在胰腺癌靶向治疗中显示出一定治疗潜力[14]。研究表明,在胰腺癌中M2型TAM 占主要地位,且M2巨噬细胞数量越多,胰腺癌患者总生存期越低[15]。因此,抑制胰腺癌中M2型TAM 是治疗胰腺癌的关键靶点[16]。本研究也表明,在巨噬细胞-胰腺癌细胞共培养体系中,M2型极化巨噬细胞可促进胰腺癌细胞增殖。因此,可通过抑制巨噬细胞M2型极化治疗胰腺癌。
巨噬细胞极性调控是一个非常精密的过程,有多种调控因子参与[17]。MMP9 在多种肿瘤中高表达,在肿瘤发生发展甚至转移耐药中均起重要调控作用[18]。而MMP9 与免疫微环境密切相关,尤其是M2 型TAM,M2 型TAM 可分泌MMP9 促进肿瘤发生发展,而MMP9 高表达也可调控其下游信号通路诱导巨噬细胞M2型极化[19]。因此MMP9是调控M2型TAM 的关键靶点。本研究也表明,在M2 型极化的巨噬细胞中MMP9 高表达,而抑制MMP9 表达,其下游M2 型巨噬细胞极化相关信号通路中pSMAD2、SMAD2、pSMAD3、SMAD3、SMAD4 等低表达,进而抑制胰腺癌中巨噬细胞M2 型极化,对胰腺癌起治疗作用。因此,MMP9 是胰腺癌中调控M2 型TAM的治疗靶点,具有临床应用潜力[20]。
天然化合物是抗肿瘤药物的重要来源,天然化合物具有来源广泛、药理活性好、安全性高等特点,在肿瘤化疗中占有重要作用[21]。芒果苷作为一种黄酮类化合物,对中枢系统疾病、免疫相关疾病、心脑血管及肿瘤等多种疾病具有很好的治疗效果[15]。芒果苷作为一个多靶点药物,其下游调控靶点众多,TGF-β、CASPS3、JNK 及EGFR 等均为芒果苷的治疗靶点,但芒果苷治疗胰腺癌的靶点尚不清楚[22]。本研究表明,芒果苷对胰腺癌具有良好的治疗效果,且可抑制M2 型巨噬细胞极化,MMP9 可能为芒果苷调控胰腺癌免疫微环境的主要靶点,芒果苷可抑制MMP9 及其下游M2 型巨噬细胞极化相关通路表达。表明在胰腺癌中,芒果苷以MMP9 作为治疗靶点,调控M2 型TAM,最终治疗胰腺癌,因此芒果苷在胰腺癌治疗中具有良好应用前景。
综上,芒果苷是治疗胰腺癌的潜在候选药物,对胰腺癌具有良好的治疗作用,其治疗机制以MMP9 为靶点,通过抑制MMP9 及其下游M2 型巨噬细胞极化相关通路最终抑制巨噬细胞M2 型极化起治疗作用。提示MMP9 可作为胰腺癌的治疗靶点,且芒果苷是该靶点的治疗药物,具有一定临床应用前景。