TRIB3 激活Wnt/β-catenin 信号通路对喉癌TU686 细胞体外生长增殖及移植瘤小鼠外周免疫抑制分子表达的影响①
程忠强 蒋成义 王 伟 强化龙 詹晓东 袁润生
(蚌埠医学院第一附属医院耳鼻咽喉头颈外科,蚌埠 233003)
Tribbles 假激酶3(Tribbles homolo 3,TRIB3)作为假性激酶,由于结构上缺乏ATP 结合位点及催化残基,不具备激酶相关活性,但作为衔接蛋白或支架蛋白调节细胞有丝分裂,阻滞细胞周期,调控多种信号通路[1-2]。在多种恶性肿瘤中TRIB3 高表达可促进细胞的生长增殖,如在脑胶质瘤中TRIB3 可通过激活β-catenin 信号通路促进胶质瘤细胞增殖[3];在结直肠癌中可通过TRIB3/β-catenin 信号通路促进细胞增殖,阻断信号通路后可增强化疗敏感性[4]。
在正常组织中,β-catenin 与轴蛋白、酪氨酸激酶1α 等形成破坏复合体,Wnt/β-catenin 信号通路处于抑制状态[5]。在喉癌中,Wnt/β-catenin 信号通路处于激活状态,β-catenin 等破坏复合体无法聚合,则聚合于细胞核或细胞质中,从而促进下游相关基因如Cyclin-D1 及C-myc 表达,发挥促进细胞增殖等作用,多种喉癌的治疗措施均可以Wnt/β-catenin 为靶点抑制肿瘤生长[6]。但在治疗过程中,免疫抑制是导致治疗失败的主要原因,肿瘤细胞分泌多种免疫抑制分子使肿瘤细胞发生免疫逃逸,故降低免疫抑制分子表达也是治疗的有效手段之一[7]。在基因表达谱数据动态分析数据库中发现TRIB3在头颈部肿瘤中表达异常,如鼻咽癌中TRIB3表达明显升高,并通过激活β-catenin 信号通路促进细胞的增殖及迁移[8]。但目前尚未在喉癌中证实其作用。为此本研究拟明确喉癌中TRIB3 的表达状态,通过构建敲低TRIB3表达的体内、体外模型,研究TRIB3对喉癌的作用,并观察其对外周免疫抑制分子表达的影响,以期成为喉癌治疗的新靶标。
1 资料与方法
1.1 资料
1.1.1 实验细胞系及组织 喉癌TU686 细胞及人永生化表皮细胞系HaCat购自上海生命科学研究院细胞资源中心。20 例喉癌患者的肿瘤组织及对应癌旁组织来自蚌埠医学院第一附属医院,所有组织标本于液氮中保存。本研究经蚌埠医学院第一附属医院伦理委员会批准(伦科批字[2023]第53号),所有相关患者均签署知情同意书。
1.1.2 实验动物 6周龄雄性BALB/c 裸鼠12只购自河南省医学实验动物中心[SCXK(豫)2021-0018],饲养于蚌埠医学院第一附属医院SPF级动物房中,室温(22±2) ℃,自由进食饮水,12 h/12 h 明暗环境节律。动物实验由蚌埠医学院第一附属医院伦理委员会批准(伦科批字[2023]第53号)。
1.1.3 主要试剂 胎牛血清(批号:BC20220530)购自南京Bio Channel 公司;TRIB3 抗体(批号:ab75774)、Wnt抗体(批号:ab63934)、Cyclin-D1抗体(批号:ac853)、C-myc 抗体(批号:ab51156)、βcatenin 抗体(批号:ab0023)、p-β-catenin 抗体(批号:ab4030)、GAPDH 抗体(批号:ab181602)购自美国Abcam 公司;辣根过氧化物酶(HRP)标记的二抗(批号:23002492)购自武汉三鹰技术有限公司;TRIB3 siRNA 购自广州锐博公司;CCK-8 试剂盒(批号:2022060721)购自上海圣尔生物有限公司;流式细胞学试剂盒(批号:E0015-1643)购自美国eBioscience 公司;Trizol 试剂(批号:RR420A)、TB Green Premix Ex Taq Ⅱ(Tli RNase HPlus)(2×)(批 号:RR390A)、反转录试剂盒(5×Prime Script RT Master Mix)(批号:RR037A)购自日本TaKaRa 公司;TRIB3及GAPDH 引物购自上海生工生物;IL-4(批号:20210513)、IL-6(批号:20200823)、IL-10(批号:20210609)、TGF-β(批号:20220115)、前列腺素(prostaglandin E2,PGE2)(批号:20220309) ELISA试剂盒购自武汉基因美生物有限公司;TRIB3 低表达慢病毒包装质粒购自上海吉凯化学技术有限公司。其余所用实验试剂均购自国产相关试剂公司。
1.1.4 主要仪器 Western blot 电泳仪购自美国Bio-Rad公司;Western blot成像系统购自美国Alpha-Innotech 公司;荧光定量PCR 仪及恒温培养箱购自赛默飞有限公司;流式细胞仪购自美国BD 公司;超净工作台购自美国Sigma 公司;倒置显微镜购自德国Leica公司。
1.2 方法
1.2.1 体外实验
1.2.1.1 细胞培养及转染 TU686 及HaCat 细胞培养于含10%胎牛血清的RPMI1640中,置于37 ℃、含5%CO2的细胞培养箱中培养。细胞转染实验:将TU686 细胞均匀接种于6 孔板中,分为阴性对照组(NC组)及敲低TRIB3组(sh-TRIB3组),待细胞增至70%时弃去培养上清,PBS 清洗后各孔加入无血清1640 培养基继续培养;将250 μl Opti-MEM 无血清培养基与160 pmol 的siRNA 或NC-RNA 充分混匀至1.5 ml EP 管中;另取一只1.5 ml EP 管,将250 μl Opti-MEM 无血清培养基与5 μl Lipofectamine 2000混匀,室温静置5 min;再将上述两个EP管中的内容混合,室温静置30 min。将混匀的液体加入上述6孔板内,6 h后PBS清洗,更换完全培养基。
1.2.1.2 Western blot 检测蛋白表达 将喉癌组织、癌旁组织及经1.2.1.1 转染后的细胞分别加入蛋白酶抑制剂和PMSF,离心取上清,加入上样缓冲液,充分混匀后煮沸变性,-20 ℃冰箱冷冻。配制10%SDS-PAGE 凝胶,待胶凝之后放置于电泳液中,加入20 μl细胞总蛋白,设置电压120 V分离80 min,随后设置80 V 分离60 min,取出玻璃板,按照目标蛋白的分子量取胶,使用转膜夹及转膜液将胶上的蛋白转至PVDF 膜,将其放置于5%BSA 溶液中脱色封闭,TBS 清洗10 min×3 次,脱脂牛奶封闭4 h,清洗后放入对应一抗中,4 ℃孵育过夜,次日取出后条带摇床清洗,随后二抗4 ℃孵育1 h,洗膜。将膜均匀涂抹AB(1∶1)显影液,放入显影系统,使用凝胶成像系统曝光拍照。
1.2.1.3 实时荧光定量PCR 利用Trizol 试剂提取喉癌、癌旁组织及经1.2.1.1 转染后的细胞总RNA,将总RNA 反转录为cDNA。利用实时荧光定量PCR仪进行扩增,取2 μl cDNA为模板,配制25 μl Real-time PCR 反 应 体 系 进 行 扩 增:2×Super Real Premix 12.5 μl;正、反向引物(10 μmol/L)各0.75 μl;RNase-free ddH2O 9 μl。扩增条件为:94 ℃ 预变性5 min,94 ℃ 40 s,54 ℃ 30 s,72 ℃ 30 s,35 个循环。TRIB3-F:5'-GCTTTGTCTTCGCTGACCGTGA-3',TRIB3-R:5'-CTGAGTATCTCAGGTCCCACGT-3';内参GAPDH-F:5'-GTCTCCTCTGACTTCAACAGCG-3',GAPDH-R:5'-ACCACCCTGTTGCTGTAGCCAA-3'。
1.2.1.4 CCK-8 实验检测增殖能力 将1.2.1.1转染处理的细胞消化后接种于96孔板,待细胞贴壁后分别于0 h、24 h、48 h 及72 h 在各孔中加入10 μl CCK-8 试剂,继续培养2 h 后,将96 孔板置于酶标仪上测定450 nm处吸光度值。
1.2.1.5 细胞集落实验 将1.2.1.1 转染处理的细胞消化后,以10 000 个/孔接种于6 孔板,使用完全培养基培养,7 d后倒置显微镜观察细胞集落形成情况并拍照。
1.2.1.6 细胞周期检测 将1.2.1.1 转染处理的细胞消化后收集至EP管中,PBS清洗后,1 500 r/min离心5 min,去除上清,每管加入2 ml 预冷的75%乙醇,振荡混匀,置于-20 ℃冰箱固定过夜,1 500 r/min离心5 min 后去除上清,PBS 清洗重悬,加入5 μl 碘化丙啶及RNA 酶,室温孵育30 min,流式细胞仪检测。
1.2.2 体内实验
1.2.2.1 移植瘤小鼠模型构建 12只雄性BALB/c裸鼠适应性喂养后,随机分为Control sgRNA 组和TRIB3 sgRNA 组。设计构建TRIB3 低表达(TRIB3+ShNC)及对照(Vector+shNC)的TU686细胞系,100 μl PBS悬浮后(3×106个细胞/皮下瘤)注入腋窝,期间观察小鼠生存状态,注射5 周后,眼球取血处死小鼠,去除瘤体,称重并测量瘤体体积。
1.2.2.2 ELISA 检测外周免疫抑制分子含量 将1.2.2.1 收集的血液离心取上清。按照试剂盒说明书检测两组血清中免疫抑制因子IL-4、IL-6、IL-10、TGF-β、PGE2含量。
1.3 统计学分析 所有数据应用SPSS19.0软件进行统计学分析。计量资料用±s表示,两组间比较釆用t检验,Pearson 分析比较蛋白表达的相关性。P<0.05表示差异有统计学意义。
2 结果
2.1 TU686 细胞及喉癌组织中TRIB3 表达 与正常细胞相比,喉癌TU686 细胞中高表达TRIB3(图1A、B);与癌旁组织相比,喉癌组织中TRIB3 蛋白及mRNA 表达升高,差异有统计学意义(P<0.01,图1C、D)。

图1 TU686细胞及喉癌组织中TRIB3表达Fig.1 Expression of TRIB3 in TU686 cells and laryngeal carcinoma tissue
2.2 TU686 细胞中敲低TRIB3 后结果验证 与正常细胞相比,喉癌TU686 细胞中高表达TRIB3。与NC 组 相 比,转 染TRIB3 siRNA 后TU686 细 胞 中TRIB蛋白及RNA表达量明显减少(P<0.01,图2)。
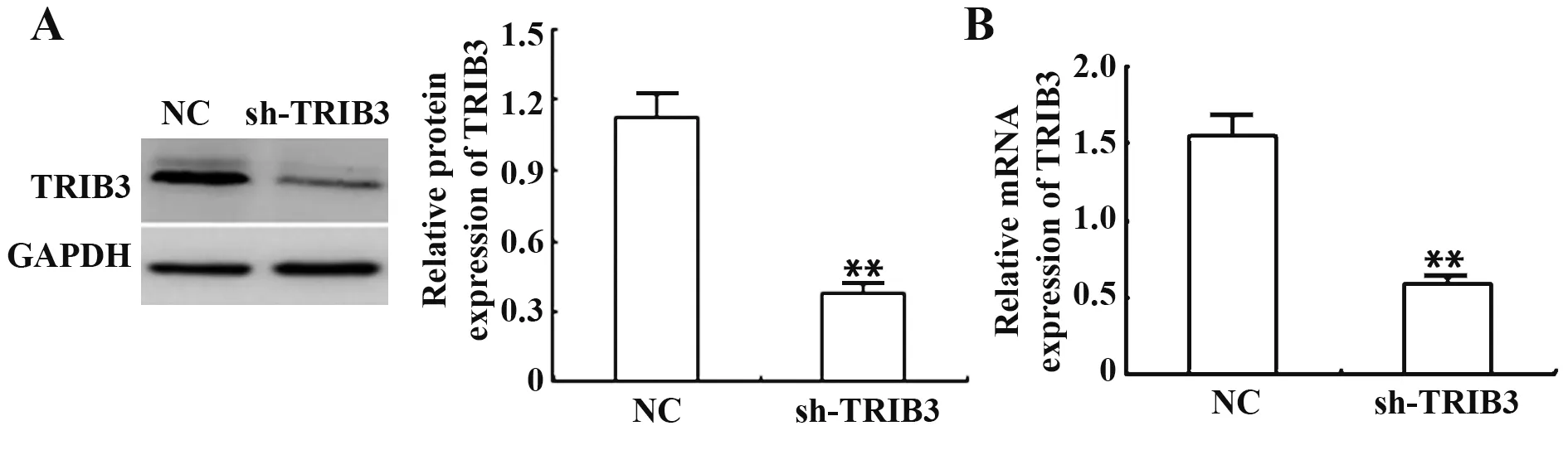
图2 TU686细胞中敲低TRIB3后结果验证Fig.2 Verify the results after TRIB3 knockdown in TU686 cells
2.3 敲低TRIB3 对TU686 细胞生长增殖的影响CCK-8 实 验 结 果 显 示,与NC 组 相 比,sh-TRIB3 组TU686细胞增殖活力显著降低(P<0.01,图3A)。集落克隆实验结果显示,sh-TRIB3 组细胞的集落克隆能力显著降低(P<0.01,图3B)。细胞周期实验结果表明,与NC 组相比,sh-TRIB3 组细胞S 期细胞数占比较低,生长被阻滞于G1/S期(图3C)。
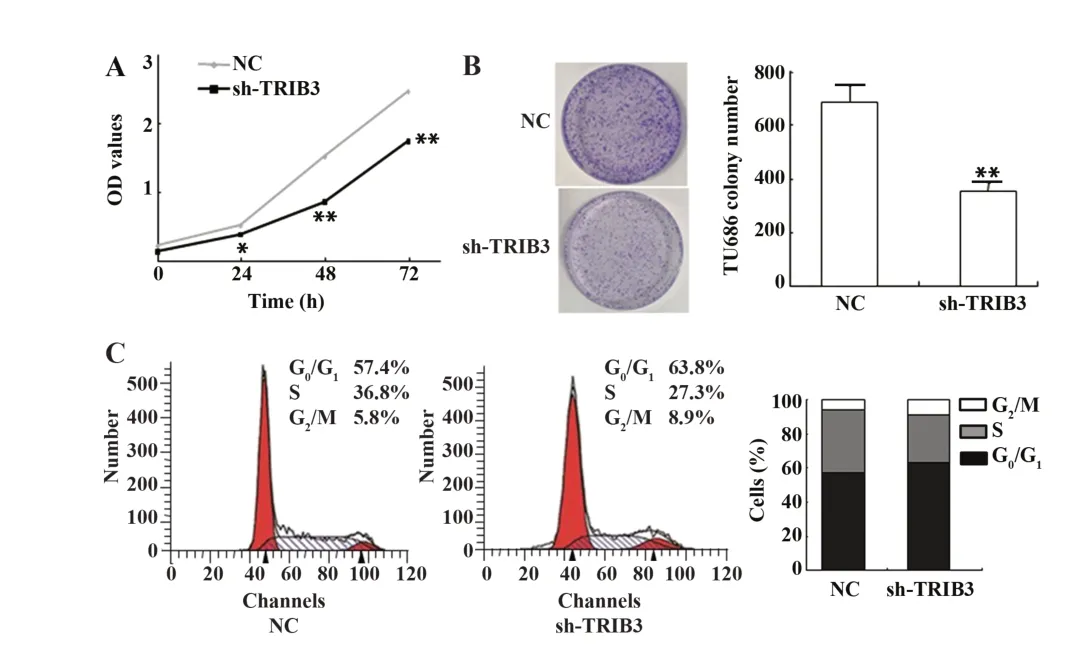
图3 敲低TRIB3对TU686细胞增殖能力的影响Fig.3 Effect of TRIB3 knockdown on proliferation ability of TU686 cells
2.4 敲低TRIB3 后对Wnt/β-catenin 信号通路相关蛋白的影响及其相关性分析 与NC 组相比,sh-TRIB3 组TU686 细胞中Wnt、β-catenin 及其下游效应蛋白Cyclin-D1 及C-myc 表达明显下降,p-βcatenin 表达明显上升(P<0.05 或P<0.01,图4A)。相关性研究显示,TRIB3 表达与Wnt、β-catenin、p-βcatenin 及其下游效应蛋白Cyclin-D1 表达呈明显相关性(P<0.05,图4B)。

图4 敲低TRIB3 对Wnt/β-catenin 信号通路相关蛋白的影响及其相关性分析Fig.4 Effects of TRIB3 knockdown on Wnt/β-catenin signaling pathway related proteins and correlation analysis
2.5 裸鼠移植瘤模型验证敲低TRIB3 对肿瘤生长及生存期的影响 如图5 所示,与Control sgRNA 组相比,体内敲低TRIB3 后瘤体生长速度减慢,注射5周后,肿瘤的体积及重量均明显降低(P<0.05)。
2.6 裸鼠移植瘤模型检测敲低TRIB3 对外周免疫抑制分子表达的影响 与Control sgRNA 组相比,敲低TRIB3 后小鼠血清中IL-4、IL-6、IL-10、TGF-β、PGE2含量均明显降低(P<0.05,表1)。
表1 各组小鼠外周血免疫抑制分子蛋白水平(±s,n=6, pg/ml )Tab.1 Levels of immunosuppressive molecular protein in peripheral blood of mice in each group (±s,n=6, pg/ml )
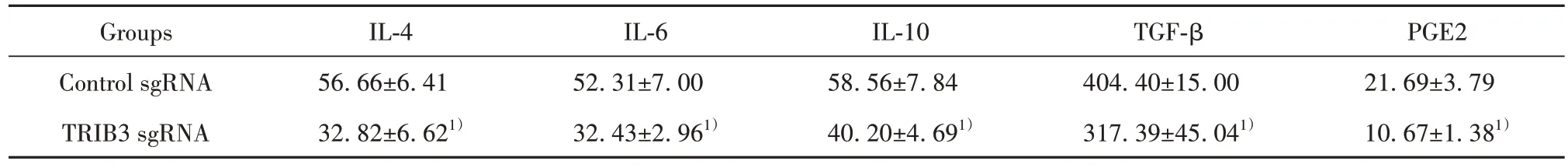
表1 各组小鼠外周血免疫抑制分子蛋白水平(±s,n=6, pg/ml )Tab.1 Levels of immunosuppressive molecular protein in peripheral blood of mice in each group (±s,n=6, pg/ml )
Note:Compared with Control sgRNA group, 1)P<0.01.
PGE2 21.69±3.79 10.67±1.381)Groups Control sgRNA TRIB3 sgRNA IL-4 56.66±6.41 32.82±6.621)IL-6 52.31±7.00 32.43±2.961)IL-10 58.56±7.84 40.20±4.691)TGF-β 404.40±15.00 317.39±45.041)
3 讨论
蛋白激酶在人体中的主要作用是催化磷酸基从ATP 转移到其底物,500 多种人类激酶组中约有10%已被认为是假性激酶[9]。TRIB3是TRIB家族成员,由于缺乏与ATP 亲和位点及激酶活性的保守催化单元,故并无激酶活性,因此也被认为是假性激酶的一种,但可能通过竞争相同的肽底物和控制其生物活性调节其他激酶[10]。TRIB3表达于人体各个器官,在骨髓、外周血白细胞和甲状腺中均有极高的表达水平[11]。TRIB3 负责调节众多生理功能,包括细胞的压力反应、细胞的分化和增殖、脂质和葡萄糖的代谢、上皮细胞向间充质细胞的转变[12]。在恶性肿瘤中,TRIB3 可通过激活经典的信号转导通路,或作为折叠蛋白,结合靶蛋白的E3 连接酶影响靶蛋白泛素化,进而调控细胞生长[13]。研究显示TRIB3 在各种恶性肿瘤中均表达升高,可能是肿瘤形成过程中的关键因素,目前在肺癌、结直肠癌和乳腺癌中研究较多,但结果不一。研究表明,在乳腺癌中TRIB3 可同时作为致癌因素及抗癌因素,如TRIB3 mRNA 高表达表明乳腺癌预后较差,而TRIB3 蛋白高表达则有利于预后[14-15]。但在其他肿瘤中尚未发现此种预示作用。
在头颈部恶性肿瘤中,TRIB3 在鼻咽癌及口腔鳞状细胞癌中表达异常升高,并分别激活β-catenin及AKT 信号通路促进细胞的增殖、迁移等[8,16]。喉癌作为常见的头颈部肿瘤,临床治疗效果不佳,最终均会以复发或耐药作为治疗终点,因此在喉癌中寻找新的治疗靶点可能是其治疗的新思路之一[17]。本研究发现在喉癌细胞及肿瘤组织中存在TRIB3异常高表达,并可促进肿瘤细胞增殖,敲低TRIB3后细胞增殖被明显抑制,肿瘤细胞被阻滞在G1/S 期,同时细胞集落生成能力降低。在体内实验中也佐证了上述结果,敲低TRIB3 的移植瘤小鼠注射5 周后,瘤体大小、体积及重量均明显降低,提示TRIB3可诱导肿瘤的生长增殖,通过靶向抑制TRIB3 可延缓瘤体生殖速度。Wnt/β-catenin信号通路的激活是肿瘤的发生机制之一,Wnt 及β-catenin 在多种肿瘤中表达升高,其中Wnt为胞外关键调控蛋白,β-catenin则在胞内发挥信号传递作用,影响下游功能蛋白Cyclin-D1 及C-myc 等的表达[18]。本研究结果显示,TRIB3 促进Wnt/β-catenin 信号通路及下游蛋白如Cyclin-D1 及C-myc 等表达,而降低β-catenin 的磷酸化水平,敲低TRIB3 后则呈现相反的结果,提示TRIB3在喉癌中可激活Wnt/β-catenin 信号通路。相关性研究显示,在正常及敲低TRIB3 细胞中TRIB3蛋白表达与Wnt/β-catenin 信号通路相关蛋白表达呈正相关,进一步证明TRIB3 在喉癌中通过激活Wnt/β-catenin信号通路发挥作用。
肿瘤免疫微环境中免疫细胞可分泌多种免疫抑制分子,产生的免疫抑制可使体内的免疫细胞无法准确识别或杀伤肿瘤细胞,使肿瘤细胞发生免疫逃逸,肿瘤免疫检查点抑制剂,如PD-1,即可通过恢复机体正常免疫功能达到抗肿瘤作用[19]。但由于肿瘤组织可分泌多种外周免疫抑制因子,寻找有效的降低免疫抑制因子的途径也是抗肿瘤治疗的思路之一。为此本实验选取了5种常见的外周免疫因子,在移植瘤小鼠中探讨TRIB3 与外周免疫抑制因子的关系。IL-4 高表达于多种肿瘤组织,参与炎症反应的同时还可在肿瘤免疫中发挥作用,IL-4 可抑制Th1 细胞产生及γδT 细胞的活化与应答,在促进免疫抑制因子IL-10 生成的同时,自身向免疫功能较差的Vδ1T 细胞偏移,导致免疫抑制发生[20]。IL-6可抑制自然杀伤细胞及抗原呈递细胞活性,阻碍免疫T 细胞功能,诱导Th2 细胞漂移,并与肿瘤的恶性程度相关,促进IL-10 及PGE2 合成,参与免疫逃逸,通过诱导血管生成等机制促进肿瘤细胞增殖并抑制其凋亡[21]。IL-10 可通过抑制T 淋巴细胞的应答及活化、降低细胞黏附分子及协同刺激分子CD86表达、抑制抗原呈递功能等引起肿瘤免疫逃逸环境[22]。除IL-10 的类似作用外,TGF-β 还可抑制Th1细胞因子的应答及细胞毒性T 淋巴细胞的分化裂解,抑制嗜中性粒细胞及NK 细胞功能,并诱导Th2细胞漂移,促进肿瘤免疫逃逸发生[23]。PGE2高表达于肿瘤组织中,通过抑制B、T 淋巴细胞增殖,抑制Th1 细胞因子的合成及NK 细胞功能,诱导并促进IL-10 产生及Th2 细胞因子合成,产生肿瘤免疫微环境,并使机体免疫功能发生障碍[24]。本研究表明体内 敲 除TRIB3 可 降 低IL-4、IL-6、IL-10、TGF-β 及PGE2 表达,提示TRIB3 参与了肿瘤免疫反应,抑制TRIB3表达可逆转肿瘤免疫微环境。
综上所述,抑制TRIB3 表达可抑制喉癌细胞的生长增殖,此作用可能是通过激活Wnt/β-catenin 信号通路实现的,同时TRIB3 在体内可促进肿瘤免疫障碍生成。抑制TRIB3靶点的治疗方式可为喉癌的防治提供新思路。