线粒体动力相关蛋白Drp1在小鼠脑出血后炎症反应中的作用①
简 丹 郑淑月 翟 瑄 梁 平 (重庆医科大学附属儿童医院,儿童发育疾病研究教育部重点实验室,国家儿童健康与疾病临床医学研究中心,儿童发育重大疾病国家国际科技合作基地,儿科学重庆市重点实验室,重庆 400016)
脑出血(intracerebral hemorrhage,ICH)是一个极具危害性的世界公共卫生问题,虽然其发病率在全球脑卒中不高(10%~15%),但其严重预后不良导致的高致残率、病死率给人类健康带来了重大难题[1]。ICH 的病后生存率较低,五年生存率仅为29%[2]。幸存者将伴随严重和长期的神经功能障碍。目前对其损伤机制和治疗手段的研究仍有限。
线粒体动力相关蛋白1(mitochondrial dynamicrelated protein 1,Drp1)是一种GTP 酶,参与线粒体分裂及线粒体稳态调节,有研究表明Drp1通过介导受损伤线粒体的分裂参与了细胞的线粒体自噬过程[3-4]。线粒体自噬是一种特异性和选择性的自噬方式[5]。当细胞持续处于应激状态时,线粒体发生分裂,同时释放大量的活性氧(reactive oxygen species,ROS)进入细胞质,对细胞造成损害[6]。分裂后的线粒体碎片被线粒体自噬机制标记和识别后分裂形成自噬小体,然后融合到溶酶体中降解,这个过程称为线粒体自噬[7]。线粒体自噬的阻滞会导致ROS 累积,从而激活炎症复合体及其下游炎症因子,表明线粒体自噬与炎症级联反应密切相关[8]。研究表明,抑制Drp1 可以抑制线粒体分裂,从而减弱线粒体自噬,而线粒体自噬在脑缺血/再灌注损伤中起神经保护作用[4,9]。然而,Drp1在ICH 中的作用尚未见报道。
Mdivi-1 是一种Drp1 抑制剂,可以通过血脑屏障。Mdivi-1 通过抑制Drp1 磷酸化以及线粒体膜转位从而抑制Drp1 与线粒体膜相互作用[10]。本研究采用自体血注射建立小鼠ICH 模型,通过腹腔注射Mdivi-1 抑制Drp1,探究Drp1 在ICH 后炎症反应中的作用及机制是否与线粒体自噬相关。
1 材料与方法
1.1 材料
1.1.1 实验动物 成年C57 雄性小鼠(SPF 级),体质量为18~22 g,购自重庆医科大学实验动物中心,本实验符合重庆医科大学实验动物伦理保护标准,符合国家相关法律规定(伦理审批号:2021295)。
1.1.2 试剂 Mdivi-1(HY-15886)购自Medchemexpress;兔来源MPO 抗体(ab208670)购自Abcam 公司;小鼠来源Drp1 抗体(6Z-82)购自Santa 公司;磷酸化Drp1 抗体(3455S)购自CST 公司;TOM20 抗体(11802-1-AP)购自Proteintech 公司;COX4Ⅰ1 抗体(ARP42784_T100)购 自Aviva 公 司;IL-6 抗 体(AP60675)购自Abcepta 公司;TNF-α 抗体(A11534)及荧光二抗购自ABclonal公司;鼠二抗、兔二抗购自Abways 公司;二甲基亚砜(DMSO,D2650);聚乙二醇300(PEG300,202371)购自Sigma 公司;聚山梨酯-80(Tween-80,A600562)购 自BBI 公 司;PVDF 膜(Millipore 公司);BCA 蛋白质分析试剂盒(Beyotime公司);化学发光液检测试剂盒(NCM 公司);牛血清蛋白封闭液(BSA,SW3015)购自Solarbio。
1.2 方法
1.2.1 实验动物分组及ICH 模型 实验动物分组及处理见图1。小鼠经腹腔注射1%戊巴比妥钠(0.7 ml/10 g)麻醉后,使用微量注射器采取小鼠尾静脉血20 μl 备用,固定小鼠于脑立体定位仪,将20 μl自体血于10 min内匀速(2 μl/min)注射入小鼠右基底节(前囟前0.2 mm,右1.0 mm,深3.0 mm),留针10 min 以防止血液反流,缓慢拔针,骨蜡封闭颅骨缺口后缝合头皮。假手术组依照相同方法注射等量生理盐水[11-12]。
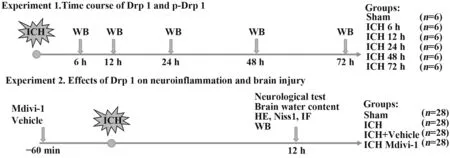
图1 实验动物分组及处理Fig.1 Grouping and operation of experimental animals
1.2.2 抑制剂给药 Mdivi-1 依次溶于DMSO、生理盐水、PEG300 以及Tween-80,终浓度为3 mg/ml。腹腔注射(25 mg/kg, 50 mg/kg, 75 mg/kg) 60 min 后建立ICH 模型[13]。Mdivi-1 溶剂对照组给予相同剂量DMSO+生理盐水+PEG300+Tween-80。
1.2.3 神经功能评分 采用改良神经功能缺损评分(modified neurological severity score,mNSS)在ICH术后12 h 评估各组小鼠神经功能,mNSS 评分主要包括4项:运动实验、感官实验、平衡木实验、反射表现和不正常运动。总分为18 分,分数越高,小鼠神经损伤越重[12,14]。
1.2.4 脑含水量测定 ICH 术后12 h 麻醉各组小鼠并迅速断头取脑,随即称取患侧半球脑组织质量获得湿重。将取出的脑组织在100 ℃烤箱中烘烤24~48 h,直至最后2 次称量脑组织质量相差不超过0.000 3 g,再次称取患侧半球脑组织质量获得干重。由以下公式计算脑含水量:脑含水量(%)=(湿重-干重)/湿重×100%[15-16]。
1.2.5 HE 和Nissl 染色 各组小鼠麻醉心脏灌注生理盐水和4%多聚甲醛,将脑组织于4%多聚甲醛中固定48 h,然后脱水、浸蜡、包埋、切片并进行染色。将HE、Nissl 切片置于光学显微镜下观察以评估形态学变化并采集图像。
1.2.6 免疫荧光 各组小鼠麻醉后,用生理盐水、4%多聚甲醛灌注后取出脑组织,于4%多聚甲醛中固定48 h,之后使用蔗糖溶液梯度脱水直至脑组织在30%蔗糖溶液中沉底,并使用低温恒温切片机切片(8 μm)。取切片置于室温复温,滴5%BSA(0.5 g BSA+0.1 ml TriotonX-100+9.9 ml PBS)于37 ℃水浴箱中封闭1 h,孵育一抗MPO(1∶100) 4℃过夜。取切片复温,37 ℃水浴箱孵荧光二抗(1∶100) 2 h,避光滴加封片剂(含DAPI)后封片。暗室荧光显微镜观察[12]。
1.2.7 Western blot 检测 麻醉各组小鼠,生理盐水灌注后快速取脑组织,取血肿周围脑组织研磨匀浆,高速离心机离心后提取组织上清液,用BCA 蛋白质分析试剂盒检测蛋白浓度。将蛋白质样品(50 μg/泳道)加样于SDS 聚丙烯酰胺凝胶,电泳分离后电转至PVDF 膜,5%脱脂牛奶室温封闭2 h。将PVDF 膜转入一抗稀释液中,4 ℃孵育过夜,然后使用相应的二抗稀释液室温孵育2 h,随后用化学发光液检测试剂盒在Bio-Rad Gel Doc Imager上显影。使用Image Lab分析蛋白条带。
2 结果
2.1 Drp1 在ICH 后的表达时间窗 通过Western blot检测小鼠ICH后血肿周围Drp1以及p-Drp1在各时间点的表达量,相比较于sham 组,Drp1 的总蛋白表达水平在ICH 后各时间点无明显变化,在ICH 后6 h p-Drp1 表达开始升高,12 h 升至最高(P<0.01,图2)。因此,为了取得最佳的观察效果,后续实验均选择ICH后12 h小鼠脑组织标本。
2.2 Mdivi-1 浓度对Drp1 的抑制效果 腹腔注射低(25 mg/kg),中(50 mg/kg),高浓度(75 mg/kg)Mdivi-1 60 min 后建立ICH模型,Western blot检测血肿周围p-Drp1以及Drp1的表达水平。结果显示,相较于ICH+Vehicle 组,ICH+Mdivi-1 低浓度组p-Drp1表达有所降低(P<0.05),而ICH+Mdivi-1 中浓度组和ICH+Mdivi-1 高浓度组p-Drp1 表达显著降低(P<0.001,图3)。而ICH+Mdivi-1中浓度组与ICH+Mdivi-1 高浓度组蛋白表达差异无统计学意义(P>0.05),故后续实验选择Mdivi-1中浓度(50 mg/kg)。
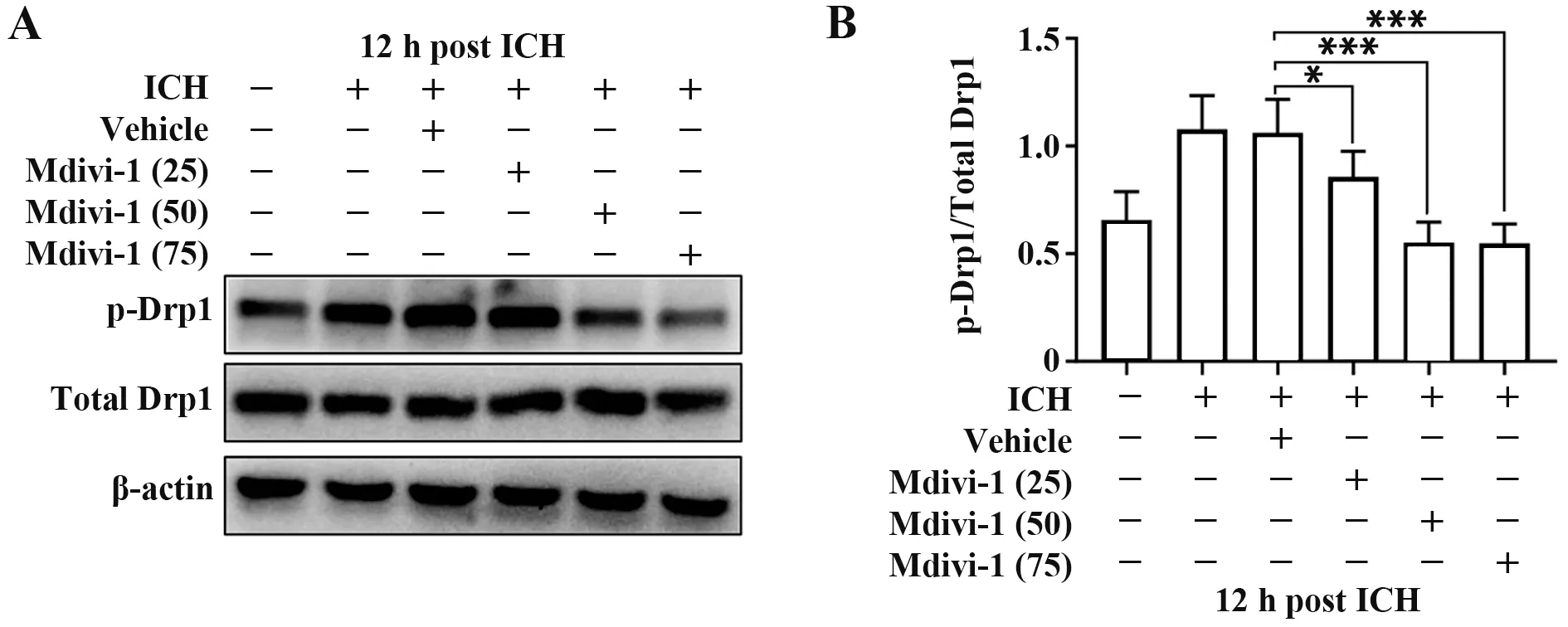
图3 Mdivi-1药物浓度筛选Fig.3 Screening of Mdivi-1 drug concentration
2.3 抑制Drp1 可加重小鼠神经功能缺损及脑水肿 相较于Sham 组,ICH 组mNSS 评分及脑含水量显著升高(P<0.05,图4),提示ICH 引起小鼠的神经功能缺损及脑水肿,而ICH 组与ICH+Vehicle 组相比,mNSS 评分及脑含水量差异无统计学意义(P>0.05),提示溶剂对照不影响药物处理结果。与ICH+Vehicle 组 相 比,ICH+Mdivi-1 组mNSS 评 分 及脑含水量增加(P<0.05,图4)。结果表明抑制Drp1可以加重小鼠ICH 后神经功能缺损以及脑组织水肿。
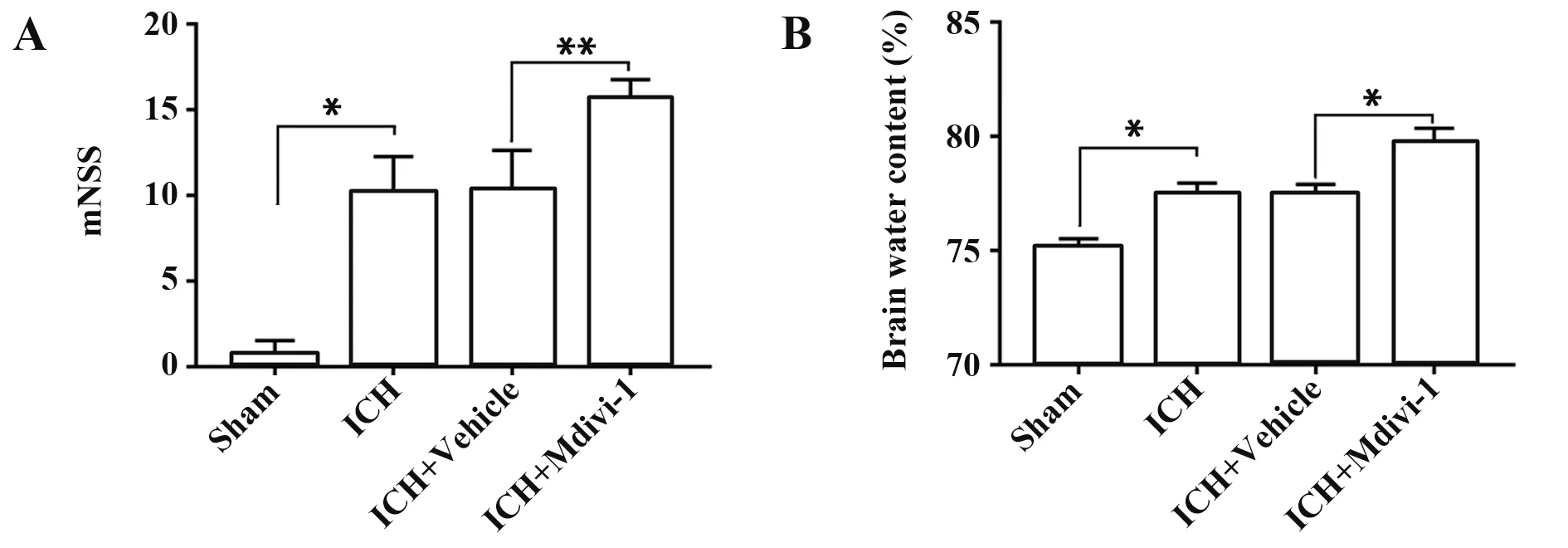
图4 各组小鼠ICH后神经功能评分和脑含水量Fig.4 ICH neural function score and brain water content of mice in each group
2.4 抑制Drp1 增加了小鼠ICH 后神经元变性死亡 HE 染色结果可见,与Sham 组相比,ICH 组染色较浅,小鼠脑组织间质稀疏水肿和弥漫性空泡化,大量核固缩、溶解,神经元变性死亡明显增多。ICH组与ICH+Vehicle 组相比无明显差异,提示溶剂对照不影响药物处理结果。与ICH+Vehicle 组相比,ICH+Mdivi-1 组间质水肿、空泡化明显加重,脑组织损伤程度加重。Nissl 染色可见Sham 组尼氏小体完整,核呈深蓝色,ICH 组和ICH+Vehicle 组脑组织尼氏体减少、解体甚至消失,而ICH+Mdivi-1 组尼氏体数量更少,与ICH+Vehicle 组相比脑组织损伤程度明显加重(图5)。结果表明抑制Drp1 增加小鼠ICH后神经元变性死亡。
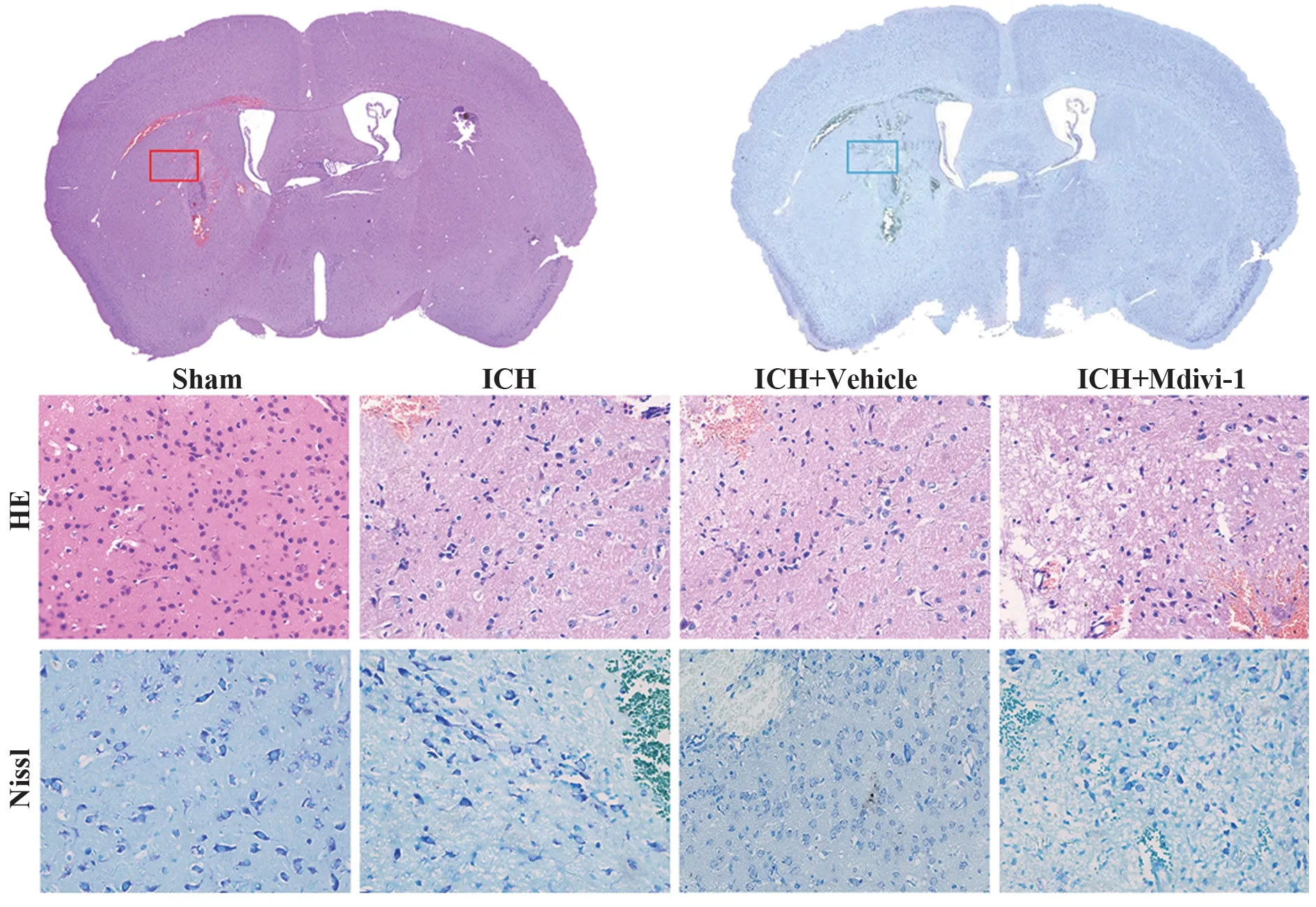
图5 HE和Nissl染色结果(×400)Fig.5 HE and Nissl staining results (×400)
2.5 抑制Drp1 增加小鼠ICH 后血肿周围中性粒细胞浸润 与Sham 组相比,ICH 组血肿周围可见大量MPO 阳性细胞。ICH 组与ICH+Vehicle 组无明显差异,提示溶剂对照不影响药物处理结果。ICH+Mdivi-1 组MPO 阳性细胞与ICH+Vehicle 组相比明显增多(图6)。表明抑制Drp1增加小鼠ICH 后血肿周围中性粒细胞浸润。
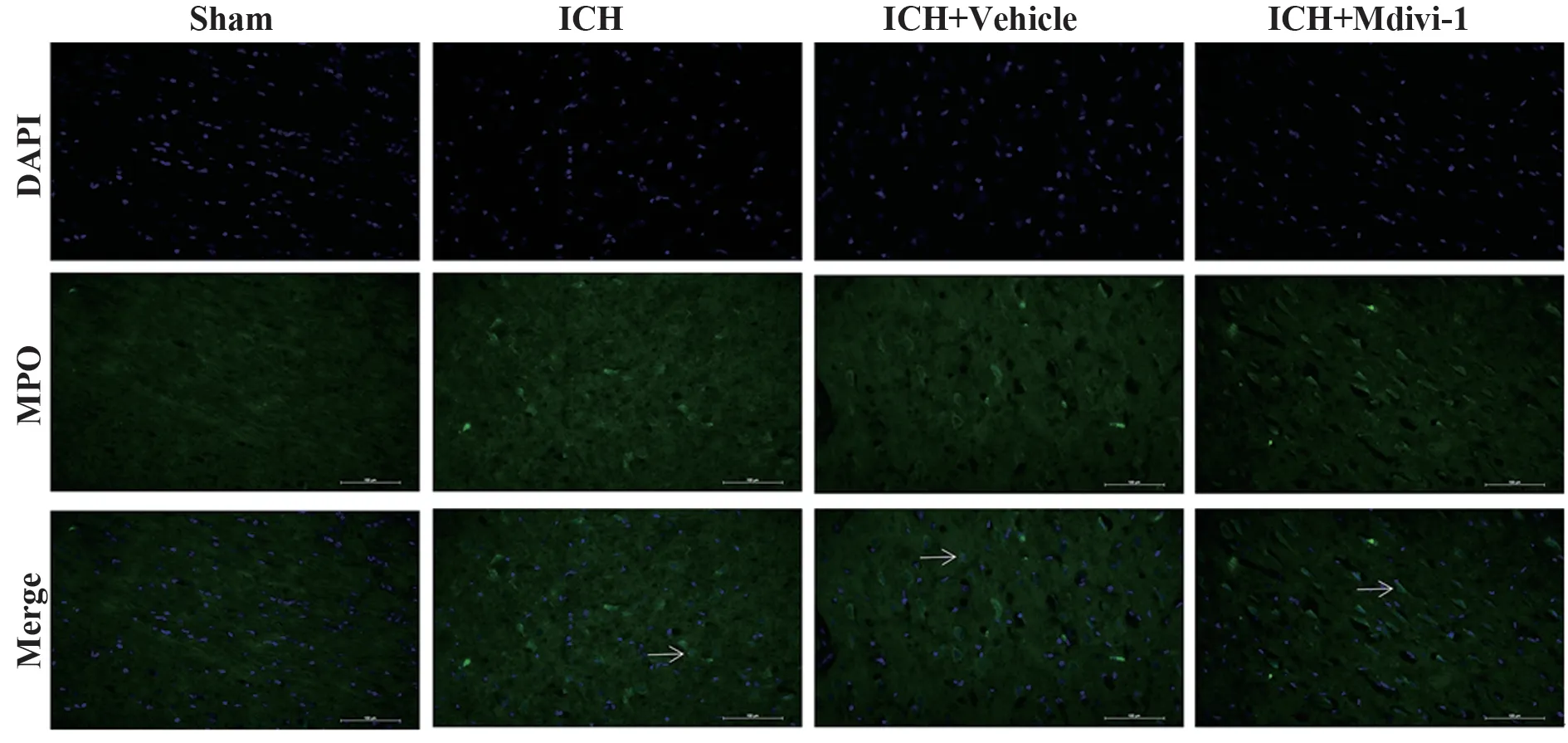
图6 各组小鼠脑出血后血肿周围脑组织MPO的表达情况Fig.6 MPO expression in peripheral brain tissue of mice after intracerebral hemorrhage
2.6 抑制Drp1抑制脑组织中线粒体分裂的发生ICH 12 h 后,Western blot 检测小鼠血肿周围脑组织中线粒体外膜标志蛋白TOM20、线粒体内膜标志蛋白COX4Ⅰ1 表达。与Sham 组相比,ICH 组TOM20、COX4Ⅰ1 表达显著降低(P<0.05);ICH 组与ICH+Vehicle 组相比,差异无统计学意义(P>0.05),提示溶剂对照不影响药物处理结果;与ICH+Vehicle 组相比,ICH+Mdivi-1 组TOM20、COX4Ⅰ1 表达升高(P<0.01,图7A~D)。结果表明抑制Drp1 可能抑制小鼠ICH后神经细胞受损线粒体分裂发生。
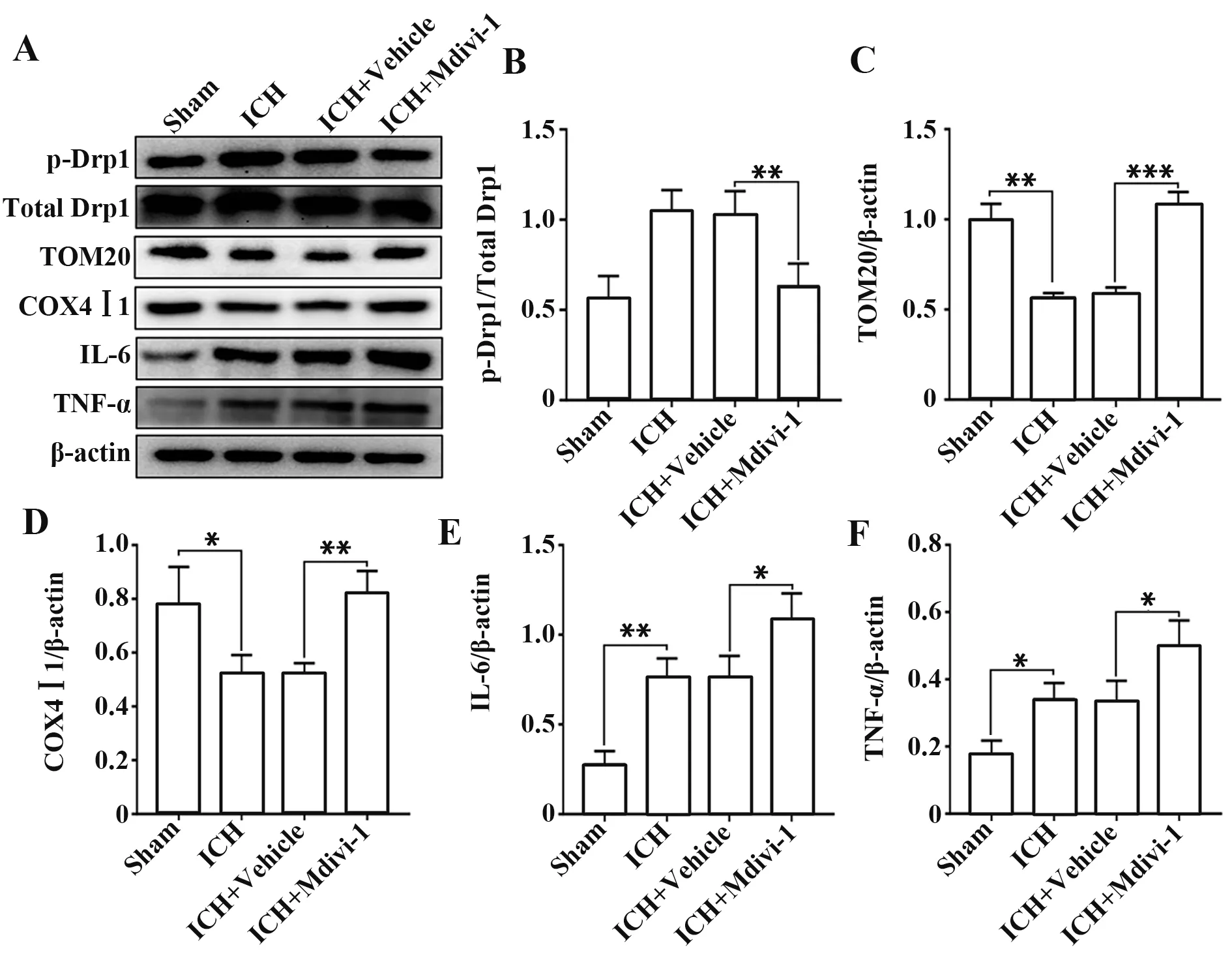
图7 各组小鼠ICH 后血肿周围TOM20、COX4Ⅰ1、IL-6和TNF-α表达Fig.7 Expression of TOM20,COX4Ⅰ1,IL-6 and TNF-α around hematoma after ICH of rats in each group
2.7 抑制Drp1 增加脑组织中炎症因子表达 ICH 12 h后,Western blot检测小鼠血肿周围脑组织IL-6、TNF-α表达。与Sham组相比,ICH组炎症因子IL-6、TNF-α 表 达 显 著 增 加(P<0.05);ICH 组 与ICH+Vehicle 组相比,差异无统计学意义(P>0.05),提示溶剂对照不影响药物处理结果;与ICH+Vehicle 组相 比,ICH+Mdivi-1 组IL-6、TNF-α 表 达 增 加(P<0.05,图7E、F)。结果表明抑制Drp1 可以增加小鼠ICH后脑组织炎症因子表达。
3 讨论
ICH 是一种预后不良的脑血管疾病,ICH 后脑损伤是影响预后的关键因素也是临床治疗ICH的重点,当前研究普遍认为,ICH 后脑损伤包括血肿占位压迫导致的原发性脑损伤以及血肿成分毒性刺激引发的继发性脑损伤(secondary brain injury,SBI)[17]。SBI 的机制十分复杂,包括炎症反应、氧化应激、脑组织水肿、线粒体功能障碍、自噬等,这些机制互相交联,最终导致神经功能损伤[18]。因此,深入研究ICH 后SBI 机制对探讨该疾病的发生、发展以及探索新型的ICH治疗方案至关重要。
线粒体自噬是机体清除细胞内受损伤或功能不完整的线粒体并维持细胞稳态的一种重要机制[5]。当细胞处于病理状态时,线粒体受损并产生过量的ROS、钙离子等毒性物质,这些过量的ROS可以激活炎症小体,导致炎症级联反应。适当的线粒体自噬可以溶解损伤的线粒体碎片,从而减轻损伤线粒体对细胞的过度损伤[19]。目前研究表明,线粒体自噬在脑缺血/再灌注损伤中有神经保护作用,诱导线粒体自噬能够减轻缺血/再灌注损伤[9,20]。线粒体分裂状态是线粒体自噬所必需的,它使得损伤的线粒体更易形成自噬小体,Drp1 是一种线粒体动力相关蛋白,是诱导线粒体分裂的关键蛋白,抑制Drp1可以减弱线粒体自噬[21]。
本实验中,使用Drp1 抑制剂Mdivi-1 抑制Drp1的磷酸化,影响Drp1 与线粒体膜相互作用,探究Drp1 在线粒体自噬以及ICH 后炎症反应中的作用。首先使用神经功能评分、脑含水量检测、HE 以及Nissl染色判断Mdivi-1对小鼠ICH后脑损伤的影响,发现Drp1 抑制剂Mdivi-1,有效抑制了Drp1 磷酸化并加重了ICH 后神经功能以及脑组织损伤,Drp1 可能在ICH后脑损伤中发挥神经保护作用。接下来进一步探讨了Drp1 影响ICH 后脑损伤的机制,发现使用Drp1 抑制剂Mdivi-1 可以抑制ICH 后脑组织中线粒体分裂并增加了脑组织中炎症因子表达。基于上述线粒体自噬负调控炎症反应的研究基础,推测Drp1 可能是通过调控线粒体分裂影响自噬小体的形成,从而影响ICH 后炎症反应。Drp1 与线粒体自噬及炎症级联反应的具体调控机制仍需进一步探究。
总之,本研究揭示了抑制Drp1可以抑制线粒体分裂,加重小鼠ICH 后急性炎症反应,并增加小鼠ICH 后脑水肿含量,加重脑组织损伤,加重神经功能缺损。