β-谷甾醇对OVA 诱导的过敏性哮喘大鼠模型中Th17/Treg 免疫失衡的调节①
贾菊芳 曾梦楠③ 张贝贝 王 茹 刘 萌 郭彭莉 张钦钦 张风宇 郑晓珂③ 冯卫生③
(河南中医药大学药学院,郑州 450046)
过敏性哮喘是一种慢性气道炎症反应,涉及多种类型的细胞、细胞因子、趋化因子和转录因子,主要表现为大量炎症细胞浸润、炎症细胞因子释放、黏液高分泌、支气管痉挛、气道高反应性(airway hyper reactivity,AHR)等[1-2]。目前全世界约有3 亿人患有哮喘,且其发病率和病死率在过去的20年中持续上升[3]。然而,目前尚无治疗哮喘的特效药物,临床上多用皮质类固醇、抗组胺药和白三烯受体拮抗剂作为哮喘的治疗药物,但长期使用效果不佳,且不良反应明显[4]。研究表明,植物甾醇因其天然来源和广泛的药理特性,已被用作治疗多种过敏和慢性炎症的常规药物[5]。β-谷甾醇是最具代表性的一种植物甾醇,具有抗炎、抗氧化、调节免疫系统等多种药理活性[6],但其对过敏性哮喘的作用及机制尚无明确报道。
目前关于哮喘的发病机制尚不完全清楚,诸多研究证实免疫机制异常与哮喘发病密切相关,除经典的Th1/Th2 免疫失衡模式外,近年来越来越多的研究表明Th17/Treg 免疫失衡在哮喘发病机制中也具有重要作用,成为哮喘治疗和预防的重点[7-8]。故本实验采用经典的卵白蛋白(ovalbumin,OVA)法建立过敏性哮喘大鼠模型,探讨β-谷甾醇对过敏性哮喘大鼠的干预作用及其对Th17/Treg 免疫失衡的影响,为β-谷甾醇作为哮喘治疗药物的潜在应用提供新的思路。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF 级雄性SD 大鼠40 只,6~8 周龄,体质量(180±20) g,购于济南朋悦实验动物繁育有限公司,许可证号:SYXK(豫)2020-0004。饲养于18~22 ℃清洁级动物实验室内,空气流通,自由进食饮水,昼夜各12 h。动物实验严格按照河南中医药大学动物伦理委员会标准执行,伦理号:DWLL2018080003。
1.1.2 药物与试剂β-谷甾醇(批号:C12368373)、氯化乙酰胆碱(批号:C12410057)购自上海麦克林生化科技有限公司;地塞米松(dexamethasone,DEX)(批号:H41021610)购自上海金不换兰考制药有限公司生产;Ⅱ级、Ⅴ级OVA(批号:A5253、A5503)购自美国Sigma 公司;氢氧化铝佐剂(批号:77161)、CD4 抗 体(PE,2198944)、IL-17A 抗 体(APC,2142931)、CD4 抗 体(FITC,2282605)、CD25 抗 体(PE,2293919)、Foxp3 抗体(APC,2250398)购自美国Thermo Fisher Scientific 公司;磷酸组胺、酚红(批号:H8530、P8460)购自北京Solarbio 公司;IL-4 试剂盒(批号:RK00040)购自武汉ABclonal 公司;IL-17A试剂盒(批号:ERC170)购自深圳NeoBioscience 公司;IL-6、TNF-α 试剂盒(批号:5TUM3CR2RV、ACMWF2PRGG)购自武汉Elabscience 公司;IL-35(批号:202109)购自江苏酶免实业有限公司。
1.1.3 主要仪器 YLS-8A 型多功能诱咳引喘仪(济南益延科技发展有限公司);BioTek 多功能酶标仪(美国Bio-Rad 公司);402A1 型超声雾化器(江苏鱼跃医疗设备股份有限公司);流式细胞仪(BD FACS Aria Ⅲ,美国BD公司)。
1.2 方法
1.2.1 过敏性哮喘大鼠模型的制备 SD 大鼠适应性喂养1 周后,按照随机分配原则分为正常组(CON)、模型组(M)、阳性药地塞米松组(DEX,0.075 mg/kg)和β-谷甾醇组(Sit,50 mg/kg)。哮喘模型的建立分为致敏期和激发期,分别在第1 天和第8 天腹腔注射致敏液(Ⅴ级OVA 10 mg+氢氧化铝10 mg)致敏(1 ml/200 g);第15~21天,采用20 ml 2%Ⅱ级OVA连续雾化激发,每次30 min,雾化前30 min灌胃给药,连续给药7 d,给药体积为1.0 ml/100 g。M 组给予等量蒸馏水,CON 组用生理盐水替代致敏液腹腔注射及雾化吸入。造模给药结束后进行各项指标的检测和取材。
1.2.2 咳喘指标检测 造模给药结束后,将大鼠置于多功能诱咳引喘仪的气雾箱中,采用25%氨水喷雾诱咳15 s取出,以大鼠腹肌收缩,同时张嘴为标准,观察大鼠从喷雾开始至第1次张口咳嗽的时间,即大鼠的咳嗽潜伏期,记录大鼠的咳嗽潜伏期及2 min内咳嗽次数。
以0.1%磷酸组胺和2%氯化乙酰胆碱等量混合液喷雾致喘,观察大鼠从喷雾开始到出现气短喘促的时间,即大鼠的引喘潜伏期。记录大鼠的引喘潜伏期及2 min内喘息次数。
1.2.3 气管排泌酚红实验 造模给药结束后,腹腔注射5%酚红溶液(0.3 ml/100 g),0.5 h 后处死大鼠,分离并剪取相同位置和长度的气管,放入含2 ml生理盐水的离心管中静置12 h,加入100 μl 1 mol/L NaOH 溶液,在波长546 nm 处检测吸光度值。以酚红含量为横坐标,吸光度值为纵坐标,制备标准曲线,并根据标准曲线计算气管酚红排泌量。
1.2.4 肺组织病理学分析 迅速解剖大鼠,取肺组织,常规脱水、渗透、石蜡包埋、切片,进行HE 染色,显微镜下对大鼠的病理结构进行观察并拍照。
1.2.5 大鼠原代肺细胞凋亡水平检测 迅速解剖大鼠取出肺脏,将肺脏上的血迹漂洗干净并擦干,取适量肺组织于1.5 ml 离心管中剪碎,加入1 ml 胰酶消化20~30 min 至细胞呈黏液状,加入血清终止消化。过滤,收集滤液,1 200 r/min 离心5 min。离心结束后,缓缓倒掉上清液,得到原代肺细胞。之后按照PE Annexin V/7-AAD 凋亡检测试剂盒要求处理细胞,并采用流式细胞检测仪进行检测分析。
1.2.6 大鼠原代肺细胞活性氧(reactive oxygen species,ROS)水平检测 以1.2.5 同样的方法获得大鼠原代肺细胞。然后按照ROS 检测试剂盒要求处理细胞,并用流式细胞检测仪进行检测分析。
1.2.7 大鼠外周血中Th17及Treg细胞水平检测
大鼠麻醉后腹主动脉取血,分别取血浆各100 μl 于流式管中,标记为Th17 和Treg。分别用PE-CD4、APC-IL-17A 抗 体 标 记Th17 细 胞,FITC-CD4、PECD25、APC-Foxp3 抗体标记Treg 细胞。每管加入对应外标抗体避光孵育30 min,然后加入1×红细胞裂解液,裂解约10 min 至液体澄清,300 g 离心5 min,弃上清,加入2 ml PBS重悬,重复2次。每管加入1 ml破膜固定工作液重悬细胞,室温避光孵育45 min;每管加入2 ml 1×破膜缓冲液,500 g 离心5 min,弃上清;用100 μl 1×破膜缓冲液重悬细胞,加入对应内标抗体避光孵育30 min,然后每管加入300 μl PBS重悬细胞并上机检测。
1.2.8 生化指标检测 生化法检测大鼠肺组织中MDA 含量及T-SOD、GSH-Px 活力,操作步骤按试剂盒说明书严格进行。
1.2.9 Th17、Treg 相关细胞因子水平检测 取出冻存的大鼠血清、肺泡灌洗液(bronchoalveolar lavage fluid,BALF)及肺组织,按试剂盒要求加入PBS缓冲液制备10%的肺组织匀浆,采用ELISA 法测定大鼠BALF 中IL-4、IL-17A 水平、血清中IL-35 水平,以及肺组织中IL-6、TNF-α、IL-35水平。
2 结果
2.1β-谷甾醇对过敏性哮喘大鼠咳喘指标及气管酚红排泌量的影响 与CON 组相比,M 组大鼠咳嗽潜伏期、引喘潜伏期及气管酚红排泌量均显著降低,2 min 内咳嗽次数及喘息次数均显著增加(P<0.01);与M 组相比,DEX 显著提高了过敏性哮喘大鼠的咳嗽潜伏期及引喘潜伏期,降低了大鼠2 min内咳嗽次数及喘息次数(P<0.01),对哮喘大鼠气管酚红排泌量的影响差异无统计学意义;Sit显著延长了过敏性哮喘大鼠的咳嗽潜伏期(P<0.01)、引喘潜伏期(P<0.05)及气管酚红排泌量(P<0.05),降低了大鼠2 min 内咳嗽次数(P<0.01)及喘息次数(P<0.05)。表明β-谷甾醇具有镇咳平喘、祛痰的作用,见图1。
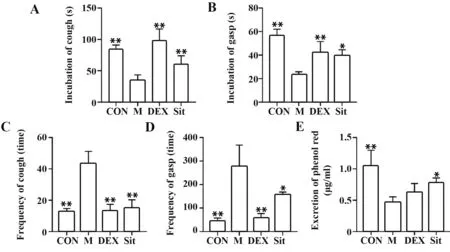
图1 β-谷甾醇对过敏性哮喘大鼠咳喘指标及气管酚红排泌量的影响Fig.1 Effects of β-sitosterol on cough and asthma indexes and tracheal phenol red excretion in allergic asthmatic rats
2.2β-谷甾醇对过敏性哮喘大鼠肺组织病理改变的影响 与CON 组相比,M 组大鼠支气管壁明显增厚,管腔狭窄,支气管和血管周围出现明显炎症细胞浸润。与M 组相比,DEX 和β-谷甾醇可显著减轻炎症细胞浸润,改善支气管壁增厚和管腔狭窄情况。表明β-谷甾醇能够减轻过敏性哮喘大鼠的肺部损伤,见图2。
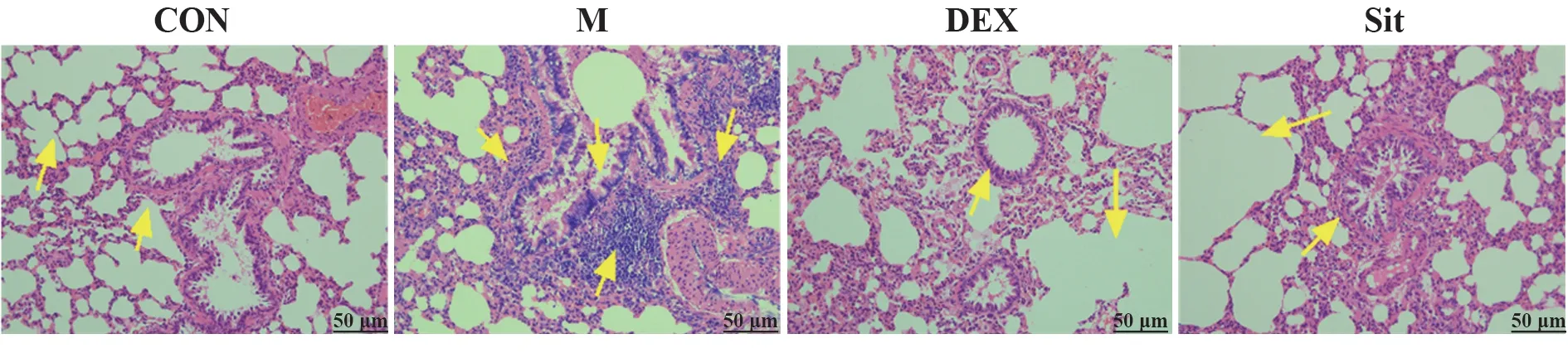
图2 β-谷甾醇对过敏性哮喘大鼠肺组织病理改变的影响(×200)Fig.2 Effects of β-sitosterol on pathological changes of lung tissue in allergic asthmatic rats (×200)
2.3β-谷甾醇对过敏性哮喘大鼠原代肺细胞凋亡水平的影响 炎症浸润会引起肺组织细胞凋亡导致结构及功能损伤,利用流式细胞术检测β-谷甾醇对过敏性哮喘大鼠原代肺细胞凋亡水平的影响。结果显示,与CON 组相比,M 组大鼠原代肺细胞凋亡水平明显升高(P<0.01);与M 组相比,DEX 和β-谷甾醇显著降低了过敏性哮喘大鼠原代肺细胞凋亡水平(P<0.01)。表明β-谷甾醇对过敏性哮喘大鼠肺脏具有保护作用,见图3。
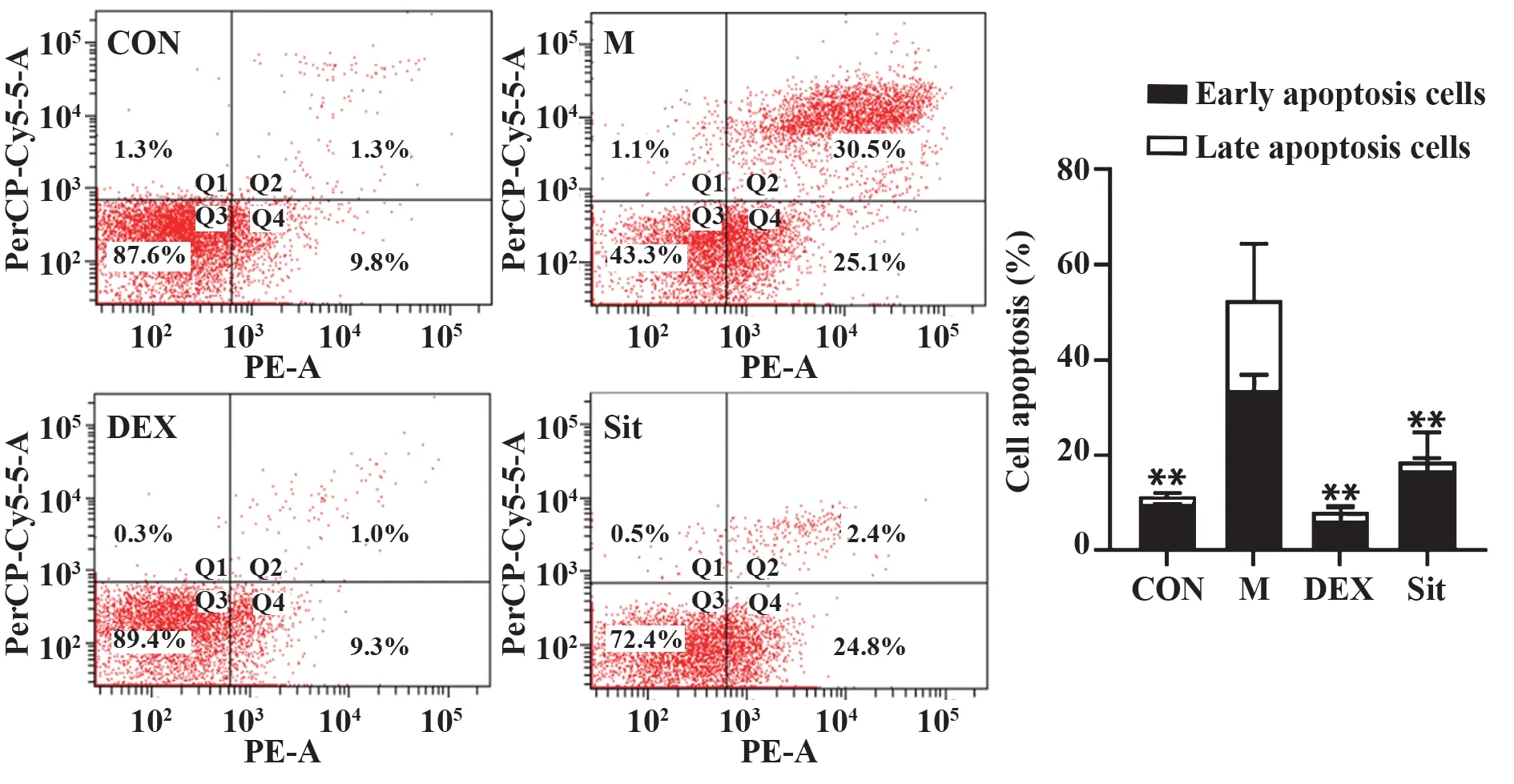
图3 β-谷甾醇对过敏性哮喘大鼠原代肺细胞凋亡水平的影响Fig.3 Effects of β-sitosterol on apoptosis of primary lung cells in allergic asthmatic rats
2.4β-谷甾醇对过敏性哮喘大鼠肺组织氧化应激水平的影响 氧化应激是诱导细胞内重要生物分子和亚细胞结构损伤的多种细胞通路的基础。结果显示,与CON 组相比,M 组大鼠原代肺细胞ROS水平明显升高(P<0.01);与M 组相比,DEX 和β-谷甾醇显著降低了过敏性哮喘大鼠原代肺细胞ROS水平(P<0.01,图4A)。检测大鼠肺组织中MDA 含量及T-SOD、GSH-Px 活力,发现DEX 和β-谷甾醇可显著降低过敏性哮喘大鼠肺组织中MDA水平,提高T-SOD 及GSH-Px 活力(P<0.01,图4B~D)。提示β-谷甾醇能够抑制过敏性哮喘大鼠肺组织氧化应激反应,减少氧化应激损伤。
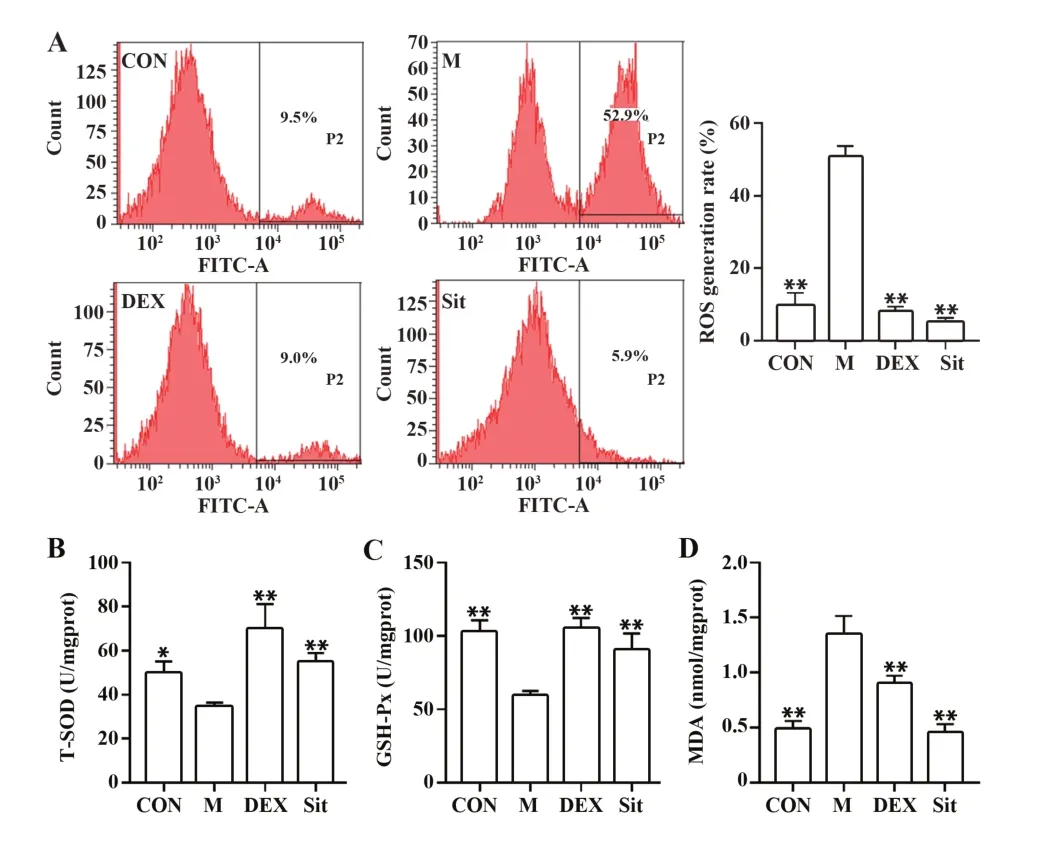
图4 β-谷甾醇对过敏性哮喘大鼠肺组织氧化应激水平的影响Fig.4 Effects of β-sitosterol on oxidative stress levels in lung tissue of allergic asthmatic rats
2.5β-谷甾醇对过敏性哮喘大鼠外周血中Th17/Treg 失衡的影响 Th17/Treg 免疫失衡在哮喘发病机制中具有重要作用,采用流式细胞术检测过敏性哮喘大鼠外周血中Th17 及Treg 细胞水平。结果如图5 所示,与CON 组相比,M 组大鼠外周血中Th17细胞比例显著升高,Treg 细胞比例显著降低(P<0.01);与M 组相比,DEX 和β-谷甾醇可显著降低Th17细胞比例,提高Treg细胞比例(P<0.01)。提示β-谷甾醇能够改善过敏性哮喘大鼠体内Th17/Treg细胞免疫失衡的状况。
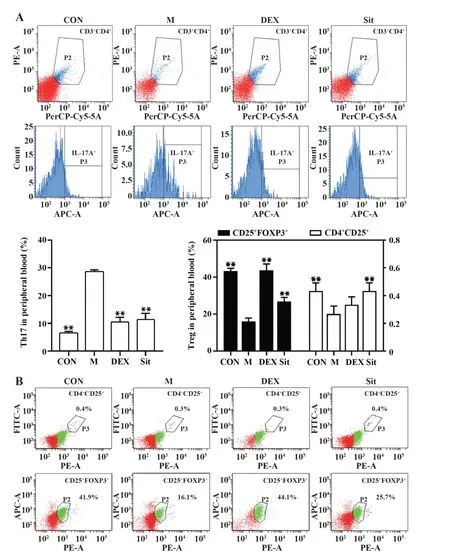
图5 β-谷甾醇对过敏性哮喘大鼠外周血中Th17/Treg 失衡的影响Fig.5 Effects of β-sitosterol on Th17/Treg imbalance in peripheral blood of allergic asthmatic rats
2.6β-谷甾醇对过敏性哮喘大鼠Th17、Treg 相关细胞因子水平的影响 如图6 所示,与CON 组相比,M 组大鼠BALF、血清及肺组织中IL-17A 水平均显著升高(P<0.01)、IL-35 水平均显著降低(P<0.05或P<0.01),BALF 中IL-4 水平及肺组织中IL-6、TNF-α 水平均显著升高(P<0.01);给药DEX 和β-谷甾醇后与M 组相比,IL-17A、IL-4、IL-6、TNF-α 水平显著降低,IL-35水平显著升高(P<0.05或P<0.01)。提示β-谷甾醇可以调节过敏性哮喘大鼠Th17、Treg相关细胞因子水平。
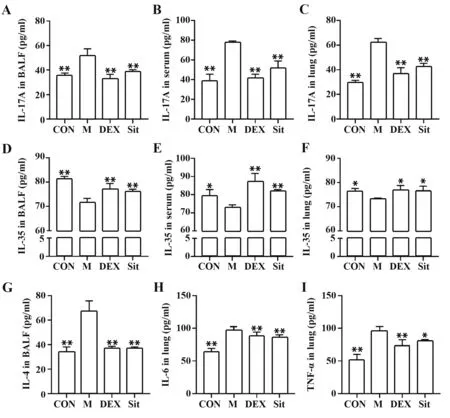
图6 β-谷甾醇对过敏性哮喘大鼠Th17、Treg相关细胞因子水平的影响Fig.6 Effects of β-sitosterol on Th17 and Treg-related cytokine levels in allergic asthmatic rats
3 讨论
哮喘是由多种细胞和细胞成分参与的气道慢性炎症性疾病,伴有反复发作的喘息、咳嗽、胸闷、气短等症状[9]。流行病学调查显示,哮喘的发病率和病死率逐年上升,且现代医学对于哮喘的治疗缺乏特效药,因此迫切需要开发出能够有效控制或治疗哮喘的替代药物[2,10]。研究表明,植物甾醇在炎症性疾病的治疗中具有明显药理活性,被誉为“生命钥匙”[5]。β-谷甾醇是其中含量最丰富的一类,在抗炎、抗氧化、降血脂及调节免疫等方面表现出良好的药理活性,但其对过敏性哮喘的作用及机制尚未见报道[6,11]。因此,本实验通过OVA 诱导成功建立过敏性哮喘大鼠模型,以研究β-谷甾醇对过敏性哮喘的干预作用。结果发现,β-谷甾醇能够明显延长过敏性哮喘大鼠的咳嗽及引喘潜伏期,减少咳嗽及喘息次数,促进气管酚红排泌,减轻哮喘大鼠肺组织炎症细胞浸润,起到一定程度的肺保护作用。
Th17 和Treg 细胞在功能上相互拮抗,共同维持机体的免疫稳态[12-13]。IL-17A 是Th17 细胞分泌的主要效应因子,能够通过促进多种炎症细胞向炎症区域募集并产生多种细胞因子,如IL-4、IL-6、TNF-α等,进而促进炎症反应发生[14-15]。IL-35 是近年发现的介导Treg 细胞免疫抑制功能的重要因子[16-18]。WHITEHEAD 等[19]研究表明,IL-35 可抑制IL-17 介导的小鼠气道高反应性。此外,IL-6 是Th17 细胞分化所必需的关键因子,其与TGF-β 相互作用,促进Th17 细胞分化,抑制Treg 细胞增殖,从而导致Th17/Treg失衡[20]。本实验通过检测过敏性哮喘大鼠外周血中Th17和Treg细胞,以及肺组织、BALF及血清中以上相关细胞因子的水平,探究β-谷甾醇对过敏性哮喘大鼠Th17/Treg 免疫失衡的调节作用。结果发现,哮喘大鼠模型中Th17 细胞及促炎细胞因子TNF-α、IL-4、IL-6、IL-17A 水平较正常大鼠显著升高,而Treg 细胞及抑炎细胞因子IL-35 水平显著降低。β-谷甾醇干预后明显改善了Th17/Treg 细胞的失衡以及相关细胞因子的变化,提示β-谷甾醇对哮喘的干预作用可能与其调节哮喘大鼠Th17/Treg 细胞比例及相关细胞因子表达有关。
氧化应激在哮喘的发病中也有重要影响。研究发现,在氧化应激相关基因被敲除的小鼠中无法建立哮喘和气道重塑模型[21]。当气道炎症发生时,嗜酸性粒细胞、中性粒细胞、淋巴细胞、巨噬细胞等多种炎症细胞募集,从而引起氧化应激及ROS 释放,导致气道上皮细胞严重损伤或凋亡[22]。在本实验中,β-谷甾醇能够抑制OVA 诱导的过敏性哮喘大鼠肺组织中ROS和MDA水平增高,并恢复抗氧化酶SOD和GSH-Px活力,抑制哮喘大鼠肺组织的氧化应激反应;同时,β-谷甾醇也降低了过敏性哮喘大鼠原代肺细胞凋亡率,改善哮喘大鼠的肺损伤。这可能与β-谷甾醇的抗氧化活性有关,其具体抗氧化机制有待进一步研究。
综上,本研究发现β-谷甾醇可以改善过敏性哮喘大鼠的咳喘指标、气管酚红排泌及肺组织病理学变化,减轻哮喘大鼠肺组织氧化损伤,调节哮喘大鼠机体Th17/Treg细胞比例及相关细胞因子的表达,从而发挥抗过敏性哮喘作用。其作用机制可能与β-谷甾醇对Th17/Treg 免疫失衡及氧化应激反应的调节有关。本文为β-谷甾醇治疗过敏性哮喘的研究提供了实验基础,也进一步证实了Th17/Treg免疫失衡在过敏性哮喘发病机制中的重要作用。