动脉粥样硬化进展中差异免疫相关基因与免疫细胞的相关性及潜在干预中药的探索①
李兴渊 李晓辉 彭广操 王建茹 (河南中医药大学第一附属医院心脏中心,郑州 450000)
动脉粥样硬化(atherosclerosis,AS)是一种免疫系统参与的慢性炎症性疾病,是多种心脑血管疾病主要的共同病理基础[1-2]。AS 是多种因素共同作用的结果,病理过程较复杂,目前尚未完全阐明[3]。一直以来,不同时期的研究者从不同角度对AS的病理机制进行了阐述,并提出了不同的学说和观点,如脂质渗入学说、内皮损伤学说、炎症学说等。
过去的几年里,越来越多的研究者意识到免疫学机制与AS 密切相关,免疫细胞功能障碍在AS 的发病及不同病理阶段均发挥重要作用[4-6]。虽然免疫细胞已被证明参与AS 的开始到进展和斑块破裂阶段,但其潜在作用机制尚不清楚,限制了以免疫细胞为靶标治疗AS 相关疾病的应用研究[4-6]。现阶段,高通量技术联合生物信息学方法已被用于探索免疫细胞在AS 不同阶段中的作用,为AS 的发病机制、发展、转归和治疗提供了一些新见解[7-12]。但在这些与AS相关的大数据研究中分析基因,尤其是免疫基因和免疫细胞间相关性的研究较少。
中医学通过“扶正”和“祛邪”来双向调节人体免疫功能,体现了其“整体观”和“阴阳平衡论”[13]。中药及其复方可通过其有效成分群调节机体多个靶点和通路发挥综合治疗免疫性疾病作用,在防治AS 方面同样也表现出了多靶点、多环节、多途径的优势[14-15]。目前,中药干预免疫损伤防治AS 的作用机制尚缺乏系统和全面的了解,积极探索中药调节AS免疫平衡可能的靶点和环节,挖掘其用药规律具有重要的意义。
基于以上认识,本文从基因表达综合数据库(gene expression omnibus,GEO)中获取GSE28829 数据集,利用生物信息学方法对GSE28829 中人颈动脉早期动脉粥样硬化斑块(early atherosclerotic plaques,EAP)和晚期动脉粥样硬化斑块(advanced atherosclerotic plaques,AAP)的差异免疫相关基因(differential immune-related genes,DIRGs)进 行 研究,运用CIBERSORT 算法分析了EAP 和AAP 的免疫细胞浸润情况,并对DIRGs 与EAP 和AAP 间的差异免疫细胞进行了相关性分析;同时,利用Coremine Medical数据库预测干预DIRGs 的中药,总结其一般药物规律(图1)。本研究将有助于更好地理解免疫机制在AS 病理进展过程中的可能作用,并为AS 的中药免疫治疗提供一定的科学依据。

图1 本研究思路流程图Fig.1 Flow chart of this research
1 资料与方法
1.1 数据集来源 从GEO 数据库(http://www.ncbi.nlm.nih.gov/geo/)中下载GSE28829 数据集和GPL570-55999 平台文件。数据集包括人颈动脉EAP 样本13 个和AAP 样本16 个。采用Affymetrix Human Genome U133 Plus 2.0 Array 检 测EAP 和AAP差异基因的表达。
1.2 数据预处理和DEGs 的筛选 依据平台文件对表达数据进行注释,将探针矩阵转化为基因矩阵。然后利用impute 包对缺失值进行填充,利用avereps 函数对基因对应的多个探针取均值,利用normalizeBetweenArrays 函数对数据进行矫正。最后,利用limma 包,以|log2(fold change,FC)|>1 和P<0.05 为阈值标准筛选差异表达基因(differentially expressed genes,DEGs)。
1.3 获取免疫相关基因 分别从ImmPort 数据库(https://www.immport.org/shared/genelists)和MSig-DB:GSEA 数据库(http://www.gsea-msigdb.org/gsea/index.jsp)中下载免疫相关基因;其中MSigDB:GSEA 数据库下载的基因集为IMMUNE_RESPONSE(编号M19817)和IMMUNE_SYSTEM_PROCESS(编号M13664)。
1.4 DIRGs 的获取及其富集分析 将1.2 中筛选出的DEGs和1.3中获取的免疫相关基因取交集,获取DIRGs。然后利用clusterProfiler 包对DIRGs 进行基因本体论(gene ontology,GO)和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集分析。
1.5 DIRGs 蛋白互作(protein-protein interaction,PPI)网络的构建及枢纽基因的筛选 将1.4 中获得的DIRGs 上传至STRING 数据库(https://string-db.org/),选择“Multiple proteins”模式,互作得分设置为最高置信度≥0.400,进行PPI 分析,并将结果导入Cytoscape3.7.2 软件构建PPI 网络。然后利用Cyto-Hubba 插件中的Degree 算法筛选PPI 网络中的核心DIRGs,即Hub基因。
1.6 免疫细胞浸润分析 基于R 软件,利用CIBERSORT 反卷积法对预处理后的GSE28829的表达谱矩阵进行模拟计算,进而获得所有样本的22种免疫细胞浸润模式。然后根据P值筛选样本,P<0.05 表示该样本免疫细胞浸润的预测结果准确可信(即可信样本),否则需剔除该样本。最后,利用Wilcoxon 检验,以P<0.05 为阈值筛选EAP 和AAP可信样品间的差异免疫细胞。
1.7 Hub 基因与差异免疫细胞的相关性分析 参考文献[6],利用R 语言中的cor.test()函数,采用Pearson 法分别对EAP 样本和AAP 样本中的差异免疫细胞和Hub 基因进行相关性系数的计算和检验。相关系数过滤条件为corFilter=0.3,相关性检验P值过滤条件为Pvalue Filter=0.05。相关系数的绝对值越大,P值越小表示Hub 基因和差异免疫细胞间的相关性越强。
1.8 预测DIRGs 的中药 将1.4 中获取的DIRGs输入Coremine Medical数据库(https://coremine.com/medical/),以P<0.05为筛选条件预测中药。然后将预测到的中药在中医药整合药理学研究平台V2.0(http://www.tcmip.cn/)、中国医药信息查询平台(https://www.dayi.org.cn/)、中国药典2020 年版、中药大辞典第二版(上海科学技术出版社)中检索其性味归经信息,并统计分析中药性味归经的出现频次和频率。若中药的性味归经不止1 个,则要全部如实记录。频率(%)=出现频次/总频次×100%。同时,提取Hub 基因所对应的中药,利用Cytoscape 3.7.2软件构建中药-Hub基因网络。
2 结果
2.1 DEGs和DIRGs的筛选结果 差异分析结果显示,共有182 个DEGs,其中上调157 个,下调25 个(图2A)。从ImmPort 数据库中获得1 793 个免疫相关基因,M19817 中获得235 个,M13664 中获得332 个,剔重后共获得1 959 个,与DEGs 取交集后共获得63个DIRGs,其中上调60个,下调3个(图2B)。

图2 DEGs和DIRGs的筛选Fig.2 Screening of DEGs and DIRGs
2.2 DIRGs 的富集分析 DIRGs 的GO 功能富集分析结果显示,依据P<0.05确定了616个GO 条目;生物学过程(biological process,BP)条目最多为524条,主要涉及细胞的迁移和趋化、炎症细胞的活化与调节、免疫效应过程的调节等;细胞组分条目(cellular component,CC)为47条,主要涉及MHC蛋白复合物、内吞溶酶体、初级溶酶体等;分子功能(molecular function,MF)条目为45 条,主要涉及模式识别受体活性、受体配体活性、MHC 蛋白复合体结合、趋化因子和细胞因子活性及其受体结合等(图3A)。DIRGs 的KEGG 通路富集分析结果显示,依据P<0.05 共映射出46 条通路,其中与AS 密切相关的有趋化因子信号通路、细胞黏附分子、Toll样受体信号通 路、IL-17 信号 通路、Th1/Th2/Th17 细胞分 化 等(图3B)。
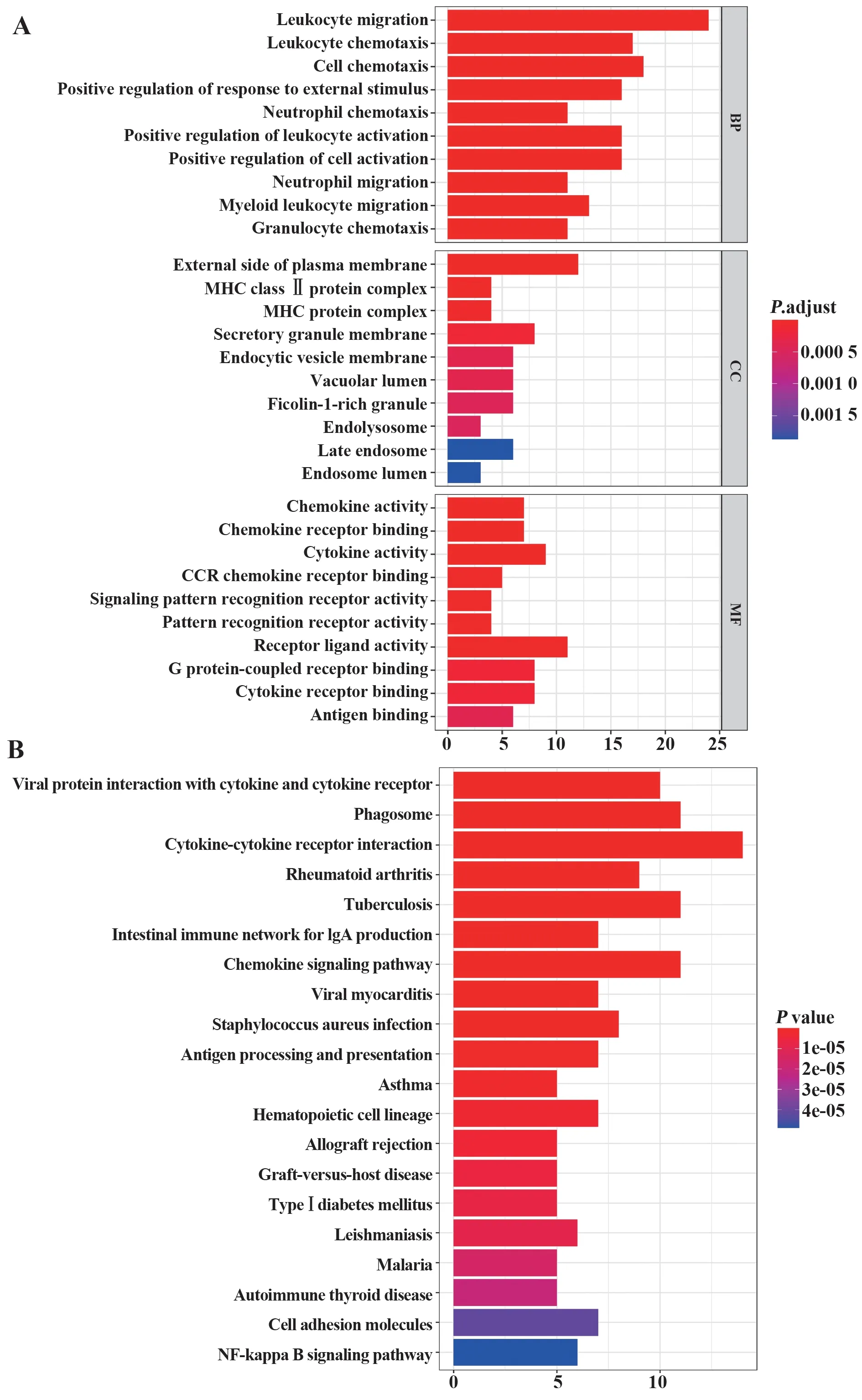
图3 DIRGs的富集分析结果Fig.3 Results of DIRGs enrichment analysis
2.3 DIRGs PPI 网络的构建及Hub 基因的筛选
经STRING 数据库对DIRGs进行PPI分析后,利用Cytoscape 软件构建PPI 网络。该网络包括3 306 条边和58 个节点,其中上调基因57 个,下调基因1 个(图4A)。如图4B 所示,利用cytoHubba 插件中的Degree 算法在PPI 网络中共筛选出10 个Hub 基因,即CD86、TLR2、TYROBP、CCR1、ITGB2、CCL2、CCL4、CSF1R、CXCR4、CTSS。
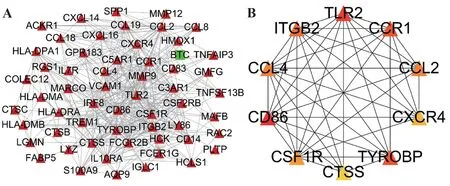
图4 DIRGs PPI网络的构建及Hub基因的筛选Fig.4 PPI network construction of DIRGs and screening of Hub genes
2.4 免疫细胞浸润分析 通过CIBERSORT 反卷积法对早期动脉粥样硬化(early atherosclerosis,EA)和晚期动脉粥样硬化(advanced atherosclerosis,AA)样本中22 种免疫细胞的相对比例进行分析,并以P<0.05 为条件对样本进行筛选,最后得到26 个可信样本,其中EA 有10 个,AA 有16 个(图5A)。如图5B 所示,EA 和AA 间存在7 种差异免疫细胞,其中调节性T细胞、活化的树突状细胞、静息肥大细胞在EA中比例显著升高;而记忆性B细胞、γδ T细胞、M0巨噬细胞、M2巨噬细胞在AA中比例显著升高。
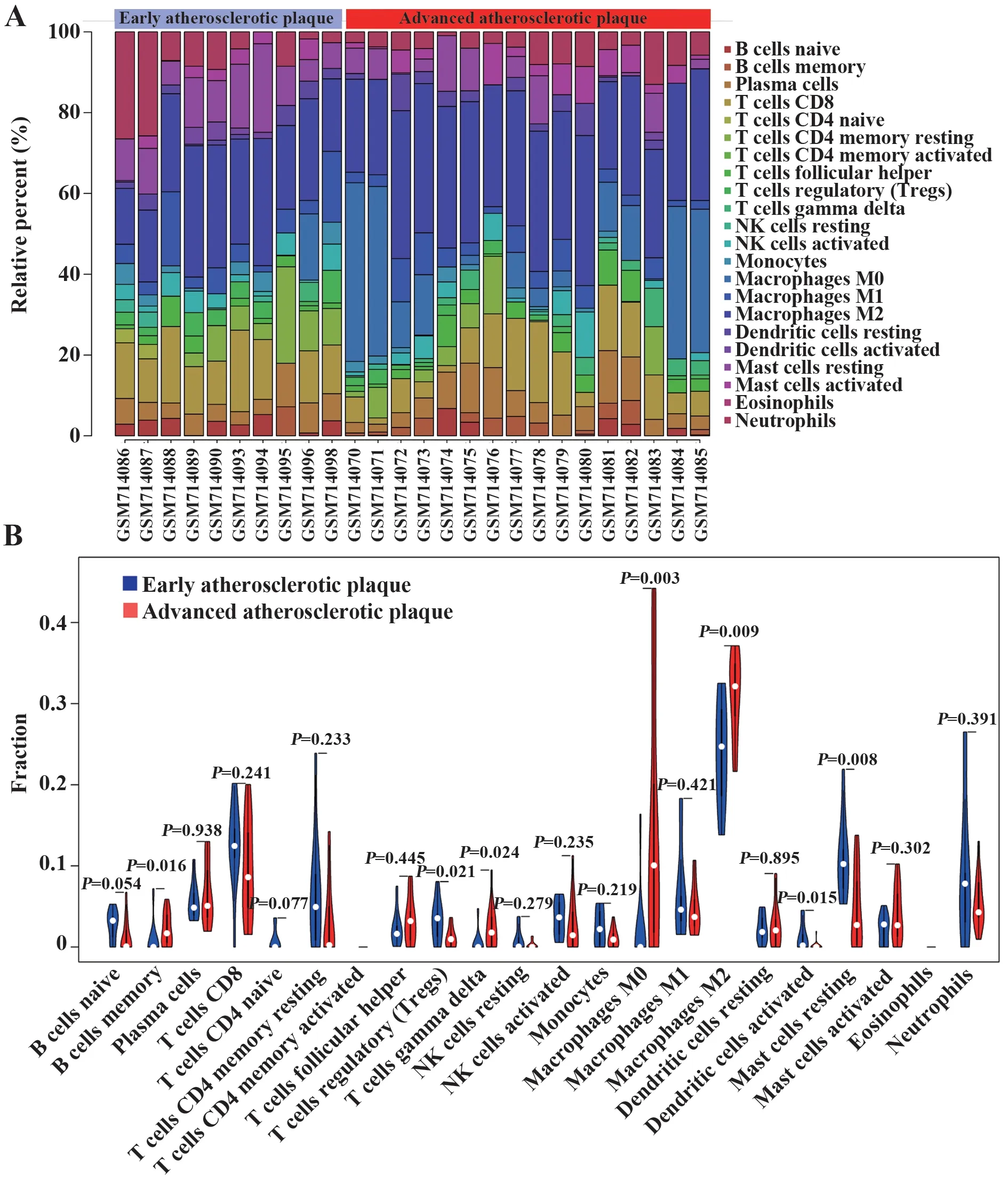
图5 EA和AA的免疫细胞浸润分析Fig.5 Analysis of immune cells infiltration in EA and AA
2.5 Hub 基因与差异免疫细胞的相关性分析 本文采用Pearson 检验分别在EA 和AA 样本中对DIRGs中的Hub基因与差异免疫细胞间的相关性进行分析。如图6 所示,在EA 中,CD86 与M2 型巨噬细胞表现出良好的相关性;在AA 中,有8 个Hub 基因与静息肥大细胞、M0 巨噬细胞间具有相关性,其中CD86 与M0 巨噬细胞正相关性最强,CCL4 与静息肥大细胞负相关性最强。
2.6 DIRGs的中药预测 将63个DIRGs输入Coremine Medical 数据库,并以P<0.05 为标准筛选后共获得482 味中药。482 味中药有63 味药未收集到归经,2 味药未收集到性味,13 味药未收集到性味、归经信息;性微温者9味,微寒者23味,微凉者1味,均按性温、性寒、性凉记录;药味微酸者2 味,微甘者7 味,微辛者4 味,微苦者26 味,均按味甘、味辛、味苦记录。经统计后发现,具有调控DIRGs 作用的中药在药味方面以苦味的出现频次和频率最高,其次为甘味和辛味;在药性方面,以性寒的出现频次和频率最高,其次为性温和性平(表1);在归经方面,以肝经的出现频次和频率最高,其次为肺经、脾经和胃经(图7A、B)。同时,本研究还构建了中药-Hub基因网络,并分析了中药的Degree值分布,发现三七、泽兰、人参、黄芪等中药较重要(附图1,www.immune99.com)。

图7 干预DIRGs的中药预测Fig.7 Prediction of Chinese herbs for DIRGs intervention
3 讨论
AS 病机复杂,从EA 进展到AA 的确切机制尚不清楚,但可以确定其涉及免疫细胞、免疫相关基因和免疫相关途径,因此识别病变部位的特异性免疫失调可以为AS的进展提供见解[10-11,16]。本研究对GSE28829 中EAP 和AAP 间的免疫相关基因进行了挖掘,共筛选出63 个DIRGs。GO 富集分析结果显示,DIRGs 的分子功能和生物学过程与免疫调节密切相关,主要涉及细胞的迁移和趋化、调节炎症细胞活化、免疫效应过程的调节、模式识别受体活性、MHC 蛋白复合体结合、趋化因子和细胞因子活性及其受体结合等。KEGG 通路富集结果显示,与AS 密切相关的有趋化因子信号通路、细胞黏附分子、Toll样受体信号通路、IL-17 信号通路、Th1/Th2/Th17 细胞分化、NF-κB 信号通路、TNF 信号通路等。富集分析的结果进一步说明AS 从EA 进展到AA 阶段为多种因素共同参与的免疫过程,演变机制错综复杂。
本文对DIRGs 进行PPI 分析,共筛选出10 个Hub 基因。研究显示,这10 个基因均通过不同方式参与了AS 的病理过程,CD86 可调控M1 型巨噬细胞[17];TLR2 促进CTSS 调控内皮细胞的血管生成作用[18];TYROBP联合CD36调控非经典单核细胞的监视作用[19];CSF1R 促进巨噬细胞的增殖[20];ITGB2、CCR1、CCL2、CCL4、CXCR4 调节炎症细胞的迁移和趋化,而CCL2 还可调控巨噬细胞极化,CXCR4 还可促进平滑肌细胞增殖[21-23]。此外,其他研究者利用生 物 信 息 学 方 法 也 证 实 了CTSS、CD86、CCR1、TYROBP、ITGB2、CCL4、CXCR4 在AS 病理过程中的重要地位[7-8,24-26]。以上报道在一定程度上佐证了本研究挖掘结果的科学性、可靠性。
为进一步探讨免疫细胞在EA 和AA 阶段的失调情况及其与Hub基因间的关系,本文利用CIBERSORT 反卷积法对EAP 和AAP 样本中22 种免疫细胞的浸润模式进行了预测,并分析了其与Hub 基因间的相关性。结果显示,共有7 类免疫细胞出现失衡,表现为EA 阶段调节性T 细胞、活化的树突状细胞、静息肥大细胞比例增加;AA阶段记忆性B细胞、γδ T细胞、M0巨噬细胞、M2巨噬细胞比例增加。早期报道显示,与EAP 相比,AAP 中约70%的树突状细胞表现为成熟表型;而近期报道表明,拟行冠状动脉旁路移植术的严重冠心病(AAP 阶段)患者树突状细胞活化功能缺陷,合并糖尿病者尤甚[27-28]。γδ T 细胞缺陷减轻了EA 和AA 阶段的病变,但也有研究证明其未影响EA 的发展[29-30]。肥大细胞现已被认为是他汀类药物治疗AS 的靶点之一,调节性T细胞也被证明具有抗AS 作用,并可作为防治AS 的新靶点[31-32]。在冠心病人群中,记忆性B 细胞与较低的继发性心血管事件风险相关[33]。巨噬细胞在AS 中表现出可塑性和多样生物学功能,M0 巨噬细胞在不同刺激因子作用下分化为M1 型和M2 型[34]。在EA 和AA 阶段均有M1 型和M2 型巨噬细胞,随着AS 的发展,M2 型巨噬细胞数量减少,但其在稳定斑块中的比例相对较高[35]。本文预测M2 型巨噬细胞在AA 阶段比例高,考虑可能与GSE28829 的AAP 为稳定斑块有关。总之,关于M0 巨噬细胞、记忆性B细胞、静息肥大细胞、调节性T细胞在EA和AA阶段的浸润情况报道较少。相关性分析结果显示,EA阶段,CD86 与M2 型巨噬细胞呈正相关;AA 阶段,CD86、CTSS、CXCR4、CSF1R、ITGB2、TYROBP 与M0巨噬细胞正相关,CCL4、CCL2 与静息肥大细胞负相关。目前,关于Hub基因与EA、AA阶段的免疫细胞相对百分比的关系尚缺少相关研究,本研究结果可为后续研究提供一些借鉴。
本研究发现通过调控免疫机制防治AS 的中药大都归肝经、肺经,药味多为苦、甘,药性以寒、温为主;同时,挖掘出三七、泽兰、人参、黄芪等中药在调控免疫机制防治AS 方面表现出较大潜力。提示AS进展的免疫机制与中医肝经、肺经、味苦、味甘、性寒、性温密切相关。肝藏血主疏泄,肺朝百脉主治节,两者的相互作用可调控全身气机升降和气血运行;苦味能泄、能燥、能坚,甘味能补、能和、能缓;寒性属阴可清泻除热,温性属阳可温通助阳。中医学将AS的病机分为虚实两类,虚(气虚、阴虚、阳虚)为病之本,实(瘀血、痰浊、毒邪、湿热)为病之标,虚可生实,实可致虚,虚实错杂且相互转化最终呈现为错综复杂的病理状态[36]。综上所述,本研究挖掘出的中药性味归经规律的结果与AS 的中医病机相吻合。
本研究尚存在一定的局限性。①GEO 数据库中满足研究条件的样本较少,最终纳入分析的样本有限;②CIBERSORT 反卷积算法已被广泛用于预测肿瘤和非肿瘤疾病的免疫细胞浸润模式,其预测精准度虽为诸多算法中的较优者,但仍与实际情况存在偏倚;③Coremine Medical 数据库存在一些不足,部分DIRGs 未能映射到对应的中药;④由于收集中药相关信息的书籍和平台未对中药进行功效分类,本研究未总结其功效规律。总之,本研究发现在AS 的 进 展 过 程 中 有10 个DIRGs(CD86、TLR2、TYROBP、CCR1、ITGB2、CCL2、CCL4、CSF1R、CXCR4、CTSS)最重要,7 种免疫细胞(调节性T 细胞、活化的树突状细胞、静息肥大细胞、记忆性B 细胞、γδ T 细胞、M0 巨噬细胞、M2 巨噬细胞)出现失 调,其 中CD86、CTSS、CXCR4、CSF1R、ITGB2、TYROBP、CCL4、CCL2与静息肥大细胞、M0和M1型巨噬细胞存在相关性;同时,发现干预DIRGs 的中药大多归肝经、肺经,性味多为寒、苦。本研究结果可为后续探索AS进展的免疫学机制,以及中医临床精准遣方用药治疗AS提供借鉴和思路。