长链非编码RNA SNHG15对肾细胞癌细胞增殖、凋亡、迁移和侵袭的影响
张绍谨,闫泽晨,李 腾,陈昆仑,刘雨轩,李松超,王 静,何娟娟,张卫星
1)郑州大学第一附属医院泌尿外科 郑州 450052 2)郑州大学第一附属医院肝胆胰外科 郑州 450052 3)郑州大学医学院 郑州 450052 4)郑州大学第一附属医院乳腺外科 郑州 450052
肾细胞癌(renal cell carcinoma,RCC)是最常见的恶性肿瘤之一,高达30%的早期RCC患者在手术后1~2 a内会出现肿瘤复发和转移[1-2]。近年来研究[3-4]发现,长链非编码RNA (LncRNA)可直接结合转录因子、RNA 聚合酶、染色质修饰蛋白,调控基因的转录和翻译,参与细胞的分化、发育、凋亡等。研究[5-8]发现许多LncRNA参与人类恶性肿瘤包括RCC的进展。LncRNA小核仁RNA宿主基因15(SNHG15)是一种致癌基因,可以刺激结肠癌、甲状腺乳头状癌、肺腺癌和口腔鳞状细胞癌细胞的增殖、凋亡抵抗和耐药性[9-12]。Du等[13]的研究结果显示RCC细胞和组织中SNHG15高表达,高表达SNHG15提示RCC患者预后不佳,SNHG15可以通过激活NF-κB途径促进RCC的增殖、侵袭和迁移。本研究检测SNHG15对人RCC细胞株ACHN和786-O增殖、凋亡、侵袭、迁移的影响,并利用双荧光素酶报告实验验证SNHG15作用的分子机制,探讨SNHG15成为RCC治疗靶点的可能性。
1 材料与方法
1.1 主要试剂ACHN和786-O细胞购自美国典型培养物保藏中心。DMEM培养液为美国Gibco公司产品,胎牛血清购自杭州四季青生物工程材料有限公司。SYBR Green PCR试剂盒购自Toyobo公司,Lipofectamine 3000试剂购自Invitrogen公司,Caspase-Glo®3/7蛋白酶活性检测试剂盒(G8091)购自美国Promega公司, Transwell小室和基质胶购自美国Millipore公司,抗Myc和GAPDH抗体购自美国Abcam公司,基因突变检测试剂盒购自美国Qiagen公司。质粒和引物由广州市锐博生物科技有限公司设计和合成。
1.2 细胞培养与分组ACHN和786-O细胞用含体积分数10%胎牛血清、100 IU/mL青霉素和100 μg/mL链霉素的DMEM培养液,于37 ℃、体积分数5%CO2培养箱中培养。取对数生长期细胞分为转染空载体pcDNA3.1的空白对照组和转染SNHG15表达质粒的SNHG15组;取对数生长期细胞分为转染无关序列的shRNA阴性对照组(shNC组),转染靶向SNHG15的短发夹RNA 1组和2组(shSNHG15#1组和shSNHG15#2组)。使用Lipofectamine 3000试剂进行转染,转染24 h后收集细胞,用于以下实验。
1.3 细胞中SNHG15和Myc mRNA的qRT-PCR检测采用Trizol试剂提取细胞的总RNA,使用反转录试剂盒合成cDNA。扩增反应在SYBR Green PCR试剂盒的12 μL反应系统中进行。PCR反应条件:94 ℃预变性30 s;94 ℃变性30 s,57 ℃退火40 s,72 ℃延伸40 s,32次循环;72 ℃温育15 min。选择GAPDH作为内参。SNHG15上游引物序列:5’-GGGACCTGACCTGAGAGAAGAT-3’; 下游引物序列:5’-GGTGCCAAGGCTTGCATTCA-3’。Myc上游引物序列:5’-TGGACGAGGCAAGAGTTT-3’;下游引物序列:5’-CTTCTGGGTTCCCGAGGT-3’。GAPDH上游引物序列:5’-CGTCTTCCCCTCCATCGT-3’;下游引物序列:5’-GAAGGTGTGGTGCCA GATTT-3’。使用2-ΔΔCt法计算SNHG15和Myc mRNA的表达水平。实验重复3次。
1.4 细胞增殖的MTT法检测分组处理后细胞用2.5 g/L胰蛋白酶消化,吹打成单细胞悬液,用含体积分数10%胎牛血清的DMEM培养基稀释,调整细胞密度为2×104个/mL。细胞按100 μL/孔接种于96孔培养板,每组设3个复孔,于37 ℃、体积分数5%CO2及饱和湿度条件下培养。在第1、2、3、4天每孔加入20 μL 5 mg/mL 的MTT孵育4 h,用酶标仪测定第4天细胞的吸光度值(575 nm)。
1.5 细胞中Caspase 3/7活性测定应用Caspase-Glo®3/7蛋白酶活性检测试剂盒检测细胞中Caspase 3/7活性。将细胞按1.5×104个/孔加入到96孔板,于37 ℃、体积分数5%CO2条件下孵育。每个孔中加入100 μL检测试剂,室温下孵育2 h。通过发光计检测荧光数值,计算相对荧光值,作为Caspase 3/7活性。
1.6 细胞体外迁移、侵袭能力检测以无血清DMEM培养液稀释基质胶,并铺于Transwell上室,37 ℃孵育5 h制作基底膜。未涂覆基质胶的小室用于迁移能力测定,涂覆的小室用于侵袭能力测定。在Transwell上室加入400 μL细胞(约106个/mL),下室加入含体积分数20%胎牛血清的培养基,37 ℃条件下培养24 h。之后用棉签头擦掉侵入下室的细胞,固定后用结晶紫染色。光学显微镜下随机选取3个视野计数迁移或侵袭细胞,实验重复3次。
1.7 双荧光素酶报告实验从在线软件StarBase v3.0(http://starbase.sysu.edu.cn/)获得miR-665与SNHG15和Myc-3’非翻译区(UTR)的结合位点。突变型(MUT)载体由突变试剂盒产生。将结合序列和突变序列分别克隆到pmirGLO双荧光素酶载体中。取生长状态良好的293T细胞接种到24孔板中,分为NC mimic、miR-665 mimic、NC inhibitor和miR-665 inhibitor组,用Lipofectamine 3000试剂进行转染,转染后36 h,收集细胞,参照双荧光素酶报告实验检测试剂盒说明检测细胞中的荧光素酶活性。实验重复3次。
1.8 统计学处理采用GraphPad Prism 8.0分析。空白对照组和SNHG15组细胞SNHG15表达水平,增殖、凋亡抵抗、迁移、侵袭能力等的比较采用两独立样本t检验或校正t检验,shNC、shSNHG15#1和shSNHG15#2组细胞SNHG15表达水平,增殖、凋亡抵抗、迁移、侵袭能力等的比较采用单因素方差分析和Turkey检验。检验水准α=0.05。
2 结果
2.1 SNHG15过表达对RCC的增殖和凋亡抵抗的影响qRT-PCR检测结果显示SNHG15转染组SNHG15的表达升高。空白对照组和SNHG15组的ACHN和786-O细胞增殖能力和Caspase 3/7活性的差异有统计学意义(表1)。过表达SNHG15促进了RCC细胞的增殖和凋亡抵抗。
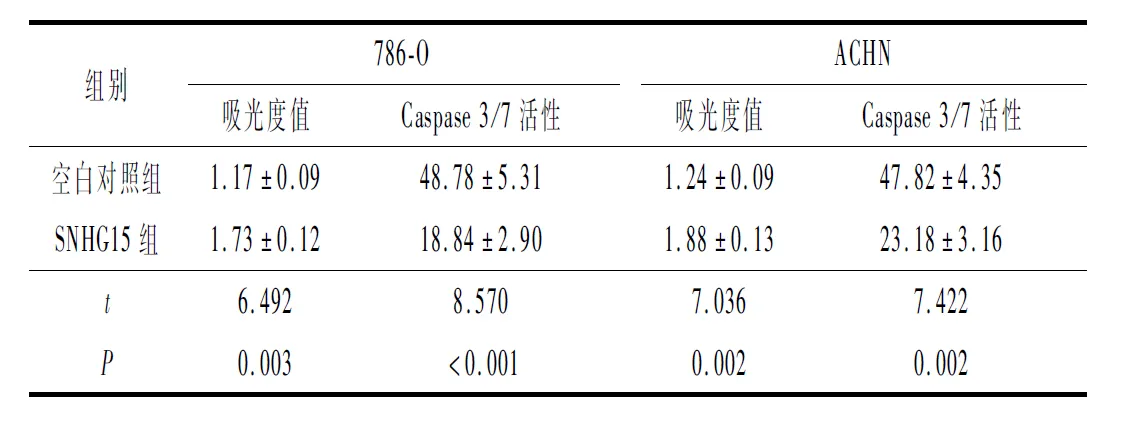
表1 各组细胞增殖情况和Caspase 3/7蛋白酶活性比较(n=3)
2.2 SNHG15过表达对RCC迁移和侵袭的影响SNHG15过表达可促进RCC细胞的迁移、侵袭(表2)。
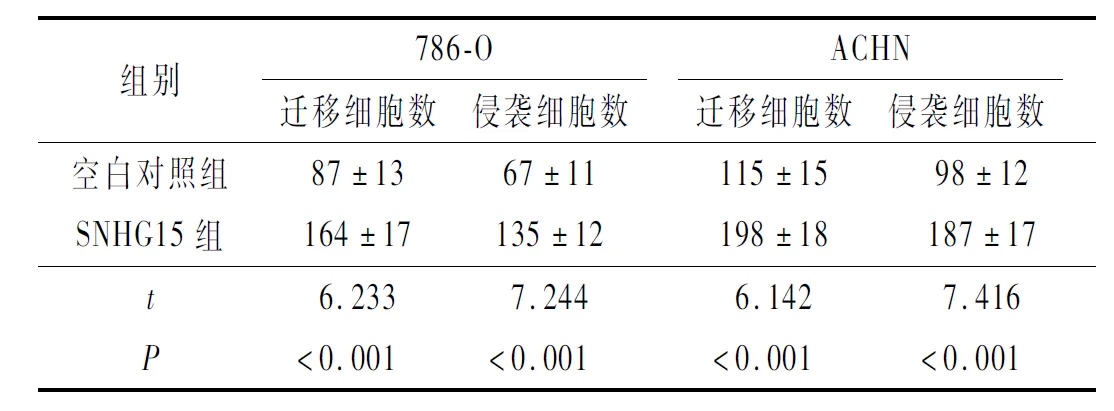
表2 各组迁移和侵袭细胞数比较(n=3)
2.3 敲低SNHG15表达对ACHN和786-O细胞增殖和凋亡的影响结果见表3。与shNC组比较,shSNHG15#1组和shSNHG15#2组SNHG15 mRNA表达降低,细胞增殖能力和Caspase 3/7活性升高。敲低SNHG15可明显抑制RCC细胞的增殖和凋亡抵抗。
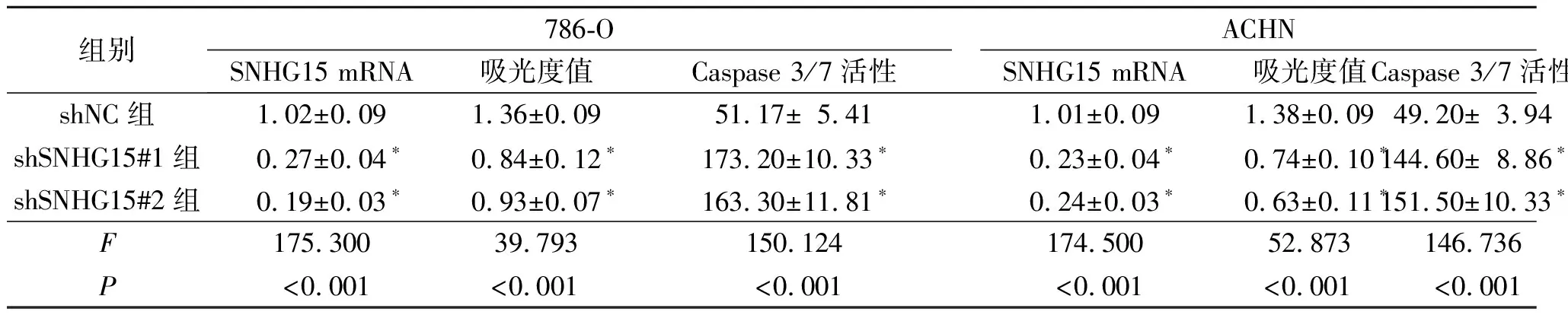
表3 敲低SNHG15表达对ACHN和786-O细胞增殖和凋亡的影响(n=3)
2.4 敲低SNHG15表达对ACHN和786-O细胞迁移和侵袭的影响敲低SNHG15可抑制RCC细胞的迁移、侵袭(表4)。
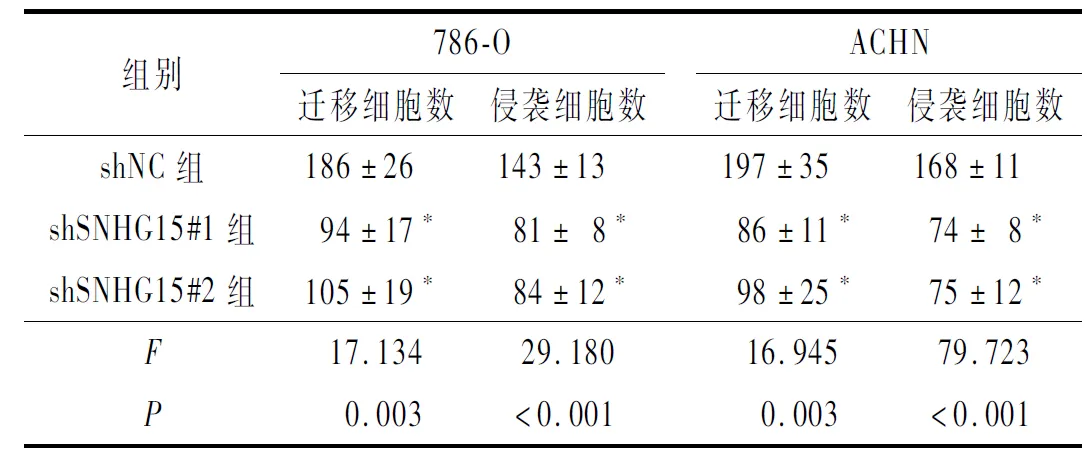
表4 敲低SNHG15对ACHN和786-O细胞迁移和侵袭的影响(n=3)
2.5 SNHG15、miR-665和Myc的关系SNHG15过表达增加了Myc mRNA的表达水平(表5),而敲低SNHG15表达降低了Myc mRNA的表达水平(表6)。在线生物信息学结果显示,SNHG15和Myc-3’UTR在miR-665上共享一个共有结合位点,提示这3个分子之间可能存在相互作用。双荧光素酶报告实验显示,miR-665 mimic抑制含有野生型SNHG15或Myc的报告基因质粒的荧光素酶活性(表7、8);miR-665 inhibitor可以增加野生型SNHG15或Myc的荧光素酶活性(表9、10)。

表5 SNHG过表达对ACHN和786-O细胞Myc mRNA表达的影响(n=3)
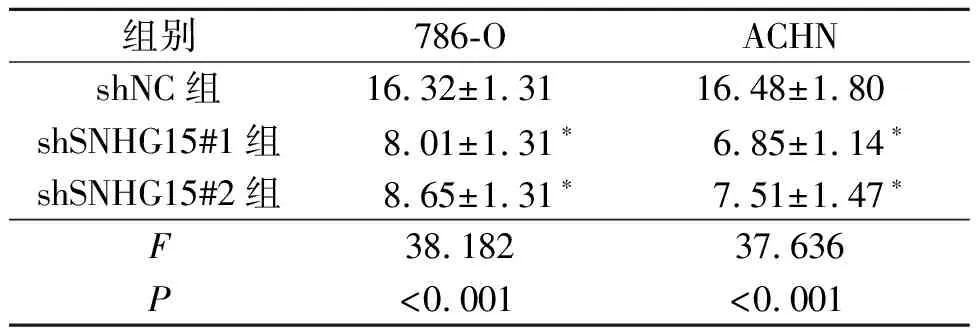
表6 敲低SNHG15表达对ACHN和786-O细胞Myc mRNA表达的影响(n=3)
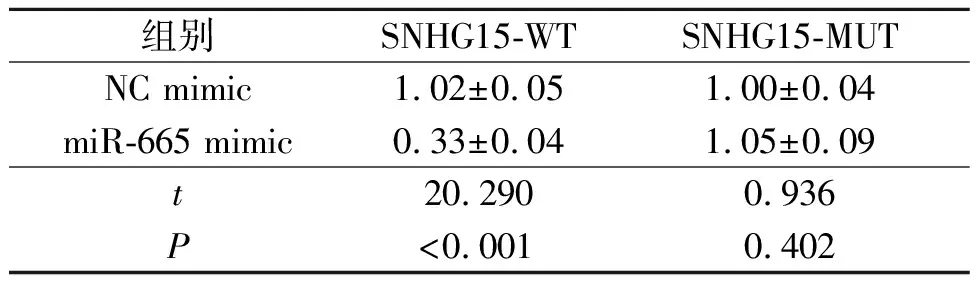
表7 miR-665 mimic和SNHG15双荧光素酶报告实验结果(n=3)
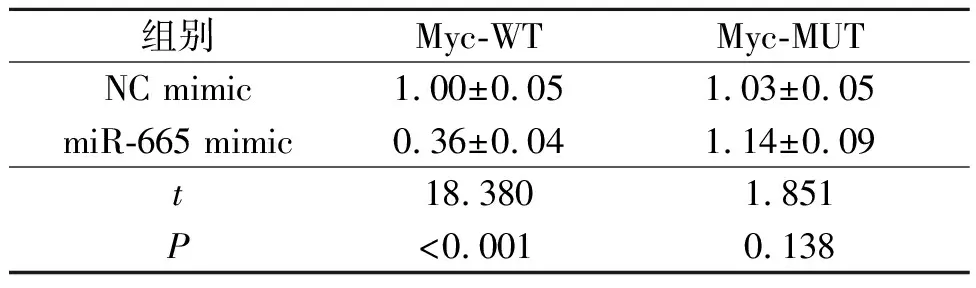
表8 miR-665 mimic和Myc双荧光素酶报告实验结果(n=3)
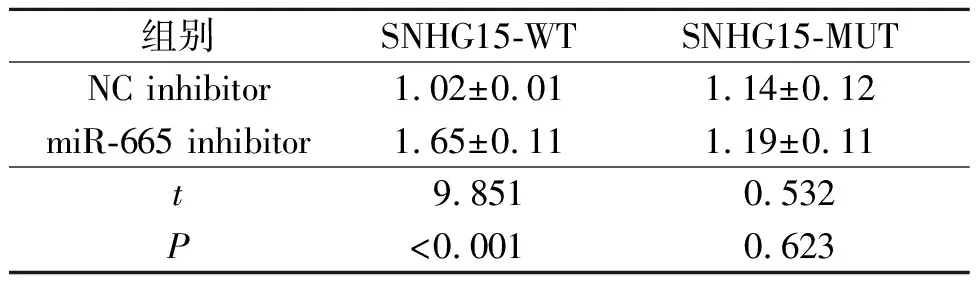
表9 miR-665 inhibitor和SNHG15双荧光素酶报告实验结果(n=3)
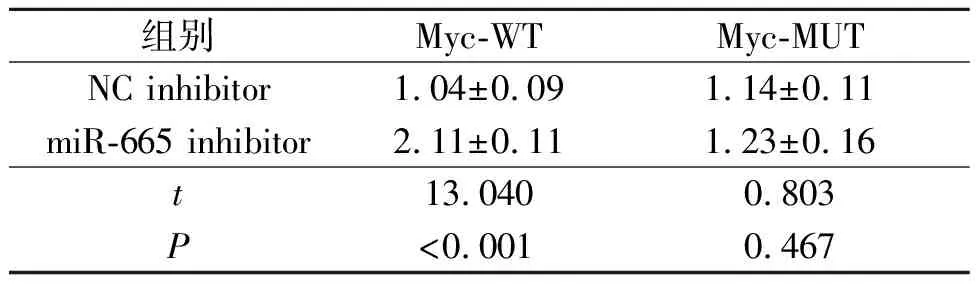
表10 miR-665 inhibitor和Myc双荧光素酶报告实验结果(n=3)
3 讨论
越来越多的研究[14]表明,异常表达的LncRNA参与了恶性肿瘤的疾病进展。有研究[10]发现,SNHG15可与AIF蛋白相互作用,促进结直肠癌细胞增殖、耐药性和远处转移。Du等[13]认为SNHG15在RCC组织中高表达,并与RCC预后不良相关,抑制SNHG15可以通过NF-κB信号通路抑制RCC的增殖、侵袭、迁移。本研究结果显示SNHG15过表达促进了RCC细胞增殖、凋亡抵抗、迁移、侵袭,敲低SNHG15表达则抑制RCC细胞以上恶性生物学行为。
LncRNA主要作为“海绵”吸附miRNA进而调控肿瘤的发生发展[6]。有研究[15]发现SNHG15可作为一种miR-200a-3p海绵,在甲状腺乳头状癌中调节YAP1/Hippo信号通路。SNHG15可以通过调节miR-451/多药耐药蛋白1(MDR-1),改变肺癌细胞对吉非替尼的耐药性[11]。最近的研究[16-18]表明,miR-665有抑制多种人类肿瘤中的作用。本研究的生物信息学数据和双荧光素酶报告实验发现SNHG15可通过吸附减少miR-665抑制Myc蛋白的作用。以上结果提示,SNHG15可与miR-665竞争性结合,并可能通过miR-665/Myc轴在RCC细胞中参与肿瘤的生物学作用。
总之, RCC细胞中SNHG15可能作为miR-665的吸附海绵增强Myc蛋白的表达,进而驱动RCC肿瘤进展,SNHG15/miR-665/Myc信号轴可能成为RCC患者潜在的治疗靶点。

