当归-川芎药对改善脑缺血再灌注急性损伤的代谢组学机制分析
翟 优,李 琨,陈毓龙,泥文娟,纪秋如,王晓艳,张 辉,孟伟亭,唐进法,李伟霞
1)河南中医药大学中医学院(仲景学院) 郑州 450046 2)河南中医药大学第一附属医院河南省中药临床应用、评价与转化工程研究中心;河南省中药临床药学中医药重点实验室;河南省中药安全评价与风险防控工程研究中心 郑州 450000 3)天津中医药大学中药制药工程学院 天津 301617
中风目前是全球第二大常见死亡原因[1-2]。用药治疗缺血性中风使血管再通后,往往引起更为严重的脑缺血再灌注损伤,其病理机制主要与氧化应激、兴奋性毒性、能量代谢障碍、炎症反应、细胞凋亡和线粒体功能障碍等有关。当归能养血补血、活血止痛,是补血之要药。川芎能行气活血、祛风止痛,被称为“血中气药”[3]。当归-川芎药对可独自成方,如佛手散、芎汤、芎归散等,也是历代许多经典良方如四物汤、补阳还五汤等的重要组成部分。现代药理[4-6]显示,当归、川芎具有抗炎、保护脑缺血损伤、抗血栓形成、抗氧化等药理作用。
运用大鼠病理模型结合代谢组学分析是一种常见的研究方法,高通量、高灵敏度、快速便捷的超高效液相色谱-四极杆-飞行时间质谱(UPLC-QTOF/MS)技术已成为探究疾病机制和筛选生物标志物的重要工具。本研究分析了当归、川芎和当归-川芎药对干预后大脑中动脉栓塞/再灌注(middle cerebral artery occlusion/reperfusion,MCAO/R)损伤模型大鼠血清和脑组织代谢物成分的变化,探讨当归-川芎药对治疗脑缺血再灌注损伤的可能机制。
1 材料与方法
1.1 试剂与仪器色谱级甲醇、乙腈购于德国默克公司;色谱级甲酸购于北京迪科马科技有限公司。当归(批号20040101)和川芎(批号20070105)饮片购于郑州瑞龙制药股份有限公司,尼莫地平片(批号201017)为亚宝药业集团股份有限公司产品。UPLC-QTOF/MS仪购于美国Waters公司。
1.2 药物的制备分别称取当归、川芎和当归-川芎(1∶1,前期课题组优选的最佳质量配比)饮片各1 kg,加10倍质量的水冷凝回流2 h,滤出滤液,之后再将中药滤渣加入8倍质量的水冷凝回流重复提取2次,合并3次滤液,减压浓缩得到1 g中生药量分别为0.944 9、0.959 7和0.902 0 g的浸膏。称取尼莫地平片适量并研磨成细粉,再加入生理盐水配制成2 mg/mL的混悬液。
1.3 实验分组60只雌性SD大鼠购自北京维通利华实验动物技术有限公司,许可证号SCXK(浙)2019-0001。大鼠随机分成假手术(Sham)组、模型(MCAO)组、当归干预(DG)组、川芎干预(CX)组、当归-川芎药对干预(GX)组和尼莫地平片阳性药对照(NM)组,每组10只。其中,DG、CX和GX组按5倍临床剂量给药,即8.1 g/(kg·d);NM组按照20 mg/(kg·d)灌胃尼莫地平混悬液;Sham组和MCAO组大鼠灌胃等体积生理盐水;连续灌胃7 d。第6天晚上大鼠禁食不禁水12 h,于第7天采用改良的Zea Longa法制备MCAO/R模型[7]。假手术组大鼠未进行血管栓塞,其他操作同造模。
1.4 标本采集及前处理再灌注24 h后,用0.75 g/kg的乌拉坦麻醉大鼠,腹主动脉取血,室温静置30 min后3 500 r/min离心10 min,吸取上层血清于-80 ℃保存待用。取血后迅速取脑组织,在液氮中快速淬灭30 min后转移至-80 ℃保存备用。
血清标本前处理:取200 μL血清置于1.5 mL离心管中,加600 μL甲醇,涡旋3 min,4 ℃ 14 000 r/min离心10 min,取上清进行UPLC-QTOF/MS分析。脑组织标本前处理:将缺血侧脑组织与80%甲醇按1∶10混合制成匀浆,4 ℃ 14 000 r/min离心10 min,取上清进行UPLC-QTOF/MS分析。
1.5 代谢组学检测采用UPLC-QTOF/MS技术对血清和脑组织样品进行代谢组学检测。色谱条件:柱温40 ℃,流速0.3 mL/min,进样量3 μL。流动相A为0.1%甲酸水溶液,流动相B为0.1%甲酸乙腈溶液。血清样品洗脱梯度:5%~45%(体积分数,下同)B 0~6 min,45%~75%B 6~8 min,75%~85%B 8~12 min,85%~100%B 12.0~12.5 min,100%~100%B 12.5~14.0 min,100%~5%B 14.0~14.5 min,5%~5%B 14.5~16.0 min。脑组织样品洗脱梯度:5%~45%B 0~3 min,45%~65%B 3~9 min,65%~100%B 9.0~12.5 min,100%~100%B 12.5~14.0 min,100%~5%B 14.0~14.5 min,5%~5%B 14.5~16.0 min。
质谱条件:电喷雾离子源,毛细管电压ESI+3 kV、ESI-2.5 kV,离子源温度140 ℃,脱溶剂气温度450 ℃,锥孔电压40 V,锥孔气流量50 L/h,脱溶剂流量800 L/h,碰撞能量10~45 V,间隔扫描时间0.2 s,质量扫描范围50~1200 m/z。使用MassLynxTMv4.1(Waters Corp.)工作站,以MSE Continuum模式进行数据采集。以亮氨酸-脑啡肽(Leucine-enkephalin,ESI+m/z556.277 1,ESI-m/z554.261 5)溶液为锁定质量溶液,进行准确质量测定。
1.6 差异代谢物的筛选采用Progenesis QI v2.1对所得数据进行对齐、峰提取、样品分组和去卷积等处理;结合Simca-P v13.0对数据进行多元分析,包括主成分分析(principal component analysis,PCA)、偏最小二乘-判别分析(partial least squares-discriminant analysis,PLS-DA)和正交偏最小二乘判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)。将VIP>1且P<0.05作为差异代谢物筛选条件,通过与Progenesis QI的HMDB和KEGG等在线数据库以及相关文献比对,进行成分鉴定,将鉴定得到的差异代谢物名称导入MetaboAnalyst v5.0在线数据库进行代谢途径富集分析。
1.7 统计学处理使用SPSS 20.0 和GraphPad Prism 9.0进行统计学处理和做图,组间各指标的比较采用单因素方差分析,检验水准α=0.05。
2 结果
2.1 血清和脑组织中代谢物检测及多元分析结果PCA和PLS-DA分析结果如图1和图2所示。PCA得分图可见Sham组和MCAO组代谢轮廓存在差异。PLS-DA得分图中两组均呈现较好的聚类效果,且明显分离,其中血清ESI-下R2Y=0.992、Q2=0.618,脑组织ESI+下R2Y=0.955、Q2=0.427,ESI-下R2Y=0.967、Q2=0.895;对PLS-DA模型进行置换检验,Q2在纵轴上的截距为负值,说明该模型未过度拟合,数据具有真实性与可靠性。
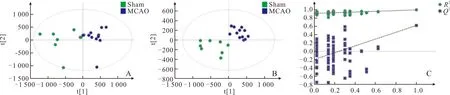
图1 血清标本ESI-的PCA得分图(A)、PLS-DA得分图(B)及置换检验图(C)
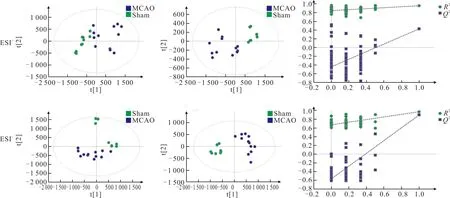
图2 脑组织标本ESI+(上)和ESI-(下)的PCA得分图(左)、PLS-DA得分图(中)及置换检验图(右)
OPLS-DA结果(图3、4)显示,Sham组和MCAO组得到很好的分离,血清ESI-下R2Y=0.998、Q2=0.618;脑组织ESI+下R2Y=0.69、Q2=0.455,ESI-下R2Y=0.967、Q2=0.924,表明模型具有较好的解释度和预测度。
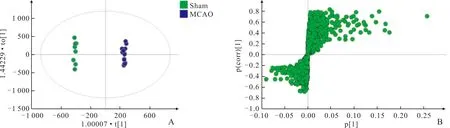
图3 Sham组与MCAO组血清标本ESI-的OPLS-DA得分图(A)及S-plot图(B)
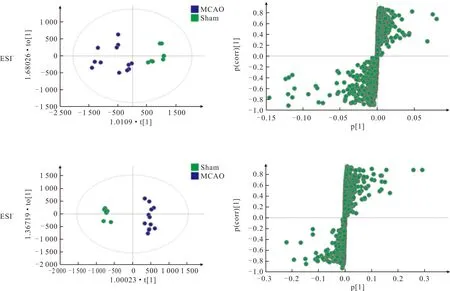
图4 Sham组与MCAO组脑组织标本ESI+(上)、ESI-(下)的OPLS- DA得分图(左)及S-plot图(右)
2.2 差异代谢物的筛选鉴定及变化趋势分析将符合筛选条件的差异代谢物二级质谱信息,与HM-DB和KEGG在线数据库等进行检索、匹配,共筛选鉴定出19个差异代谢物,其中血清5个,脑组织14个,具体见表1。给药DG、CX和DX后,有14个差异代谢物有显著转归变化趋势;其中GX对牛黄胆酸、α-D-葡萄糖、柠檬酸、N-乙酰-L-天门冬氨酸复合物、溶血磷脂酸、肌酐、次黄嘌呤、烟酰胺、D-葡糖醛酸、溶血磷脂和棕榈酸有显著改善作用。
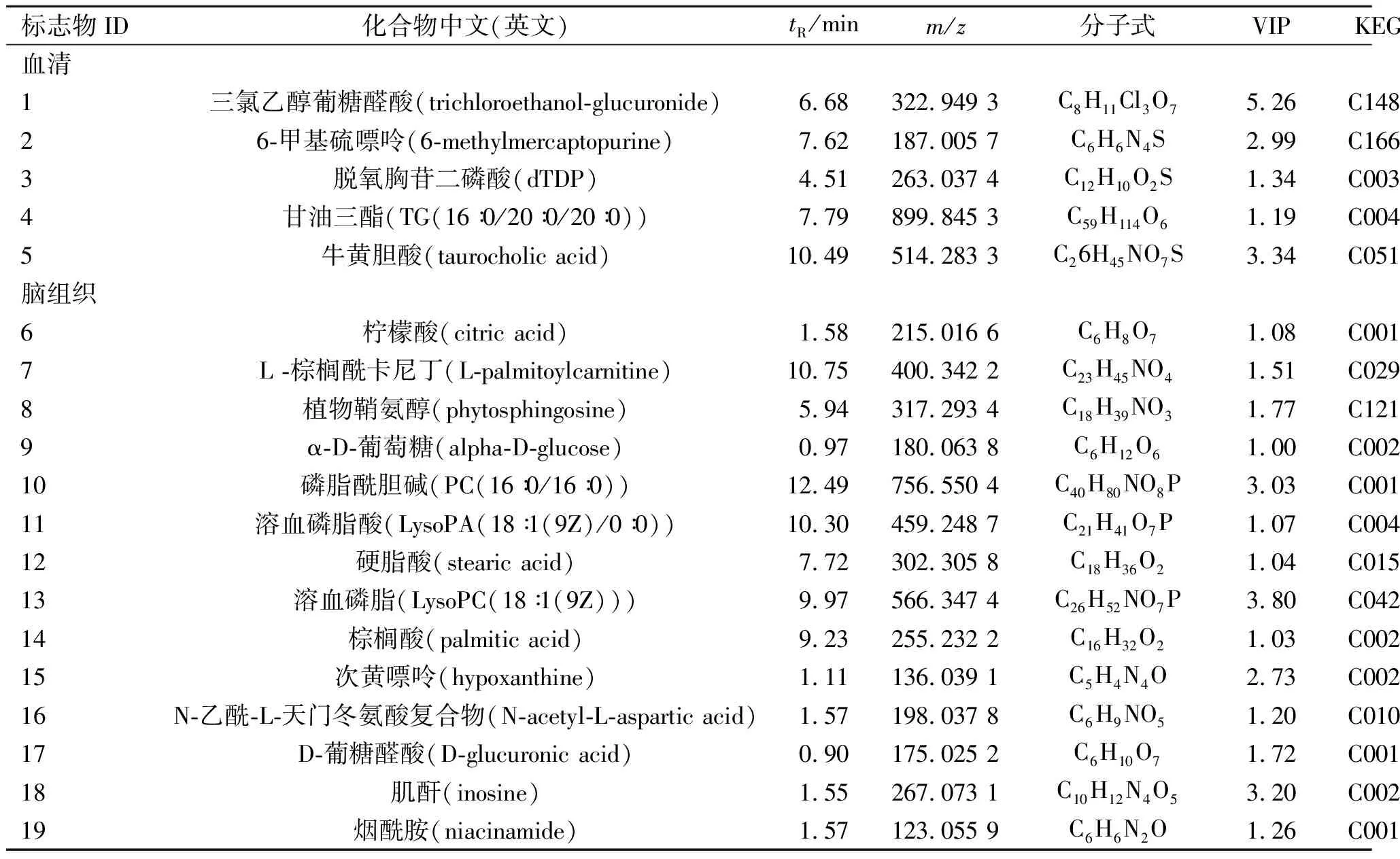
表1 差异代谢物信息
2.3 代谢途径分析对GX给药后具有显著转归的11个差异代谢物进行代谢途径分析,共涉及21条通路(图5)。影响值的临界值大于0.14的有10条,考虑将其作为潜在的靶标路径。大鼠脑组织缺血再灌注损伤主要与抗坏血酸和醛酸盐代谢、烟酸和烟酰胺代谢、甘油磷脂代谢、戊糖和葡糖醛酸的相互转化、柠檬酸循环、丙氨酸、天冬氨酸和谷氨酸代谢、乙醛酸和二羧酸代谢、半乳糖代谢、嘌呤代谢、脂肪酸生物合成有关。GX对上述紊乱的代谢途径有较好的改善作用。
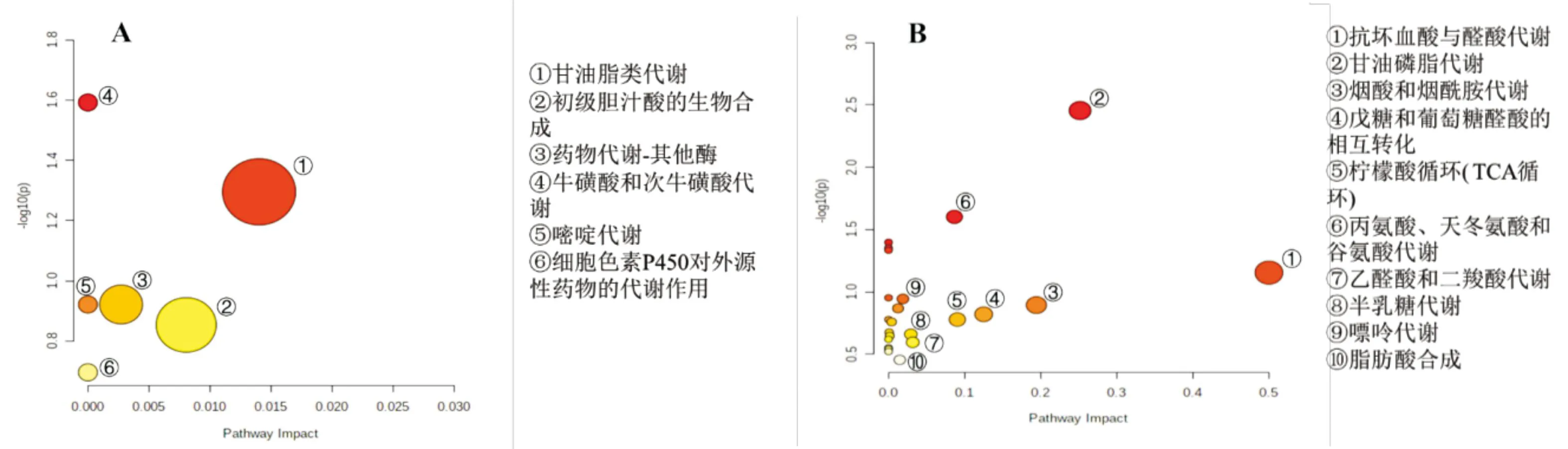
A:血清差异代谢物干预的相关代谢途径;B:脑组织差异代谢物干预的相关代谢途径
3 讨论
当归与川芎成分相似且具有类似的药理活性,其活性成分主要为苯酞类及有机酸类,具有良好的心脑血管调控功能。当归-川芎药对二者相使配伍,长于治疗脑血管疾病,可用于缺血性中风的治疗。探究当归-川芎药对治疗脑缺血再灌注损伤的机制具有重要意义。本研究采用UPLC-QTOF/MS代谢组学分析方法,发现了19种与脑缺血再灌注损伤有关的差异代谢物,经筛选,得到11个与当归-川芎药对治疗脑缺血再灌注损伤机制有关的代谢物,这些代谢物主要涉及10条代谢通路,包括抗坏血酸和醛酸盐代谢、烟酸和烟酰胺代谢、甘油磷脂代谢、戊糖和葡糖醛酸的相互转化、柠檬酸循环、丙氨酸、天冬氨酸和谷氨酸代谢、乙醛酸和二羧酸代谢等。
研究[8-11]表明,牛黄胆酸能显著减少MCAO/R大鼠脑梗死体积,主要参与初级胆汁酸的生物合成,是一种天然的抗炎成分,能够抑制炎症因子的表达。烟酰胺参与烟酸和烟酰胺代谢途径,是烟酰胺腺嘌呤二核苷酸的前体,能通过调节能量代谢抑制氧化应激和炎症[12],在中风早期应用可明显改善局灶性缺血再灌注后的坏死和凋亡性脑损伤[13]。细胞能量代谢异常是缺血性脑疾病常见的病理生理变化,是神经元损伤的主要原因,而大脑中的神经元对缺糖、缺氧导致的能量下降异常敏感。葡萄糖是参与能量代谢的重要物质,为了恢复大脑内的能量稳态,内源性葡萄糖将增加,从而促进能量的产生[14]。脂质稳态是维持中枢神经系统正常结构和功能所必需的,磷脂是细胞膜的主要组成部分,在细胞信号转导中发挥着关键作用[15]。甘油磷脂代谢紊乱可以激活NF-κB通路,与细胞凋亡和炎症相关[12,16-17],调节甘油磷脂代谢紊乱可以改善脑缺血再灌注损伤[18-19]。三羧酸循环是有氧代谢的驱动力,作为调节能量稳态和细胞代谢的中心,是细胞线粒体中产生能量最多的途径[20-21],该循环是维持大脑功能所必需的,功能障碍会导致能量生产紊乱和大脑损伤。脂肪酸的合成与神经细胞的凋亡有关[22],棕榈酸是脂肪酸合成途径的重要代谢物。
总之,本研究筛选出了11个与当归-川芎药对抗脑缺血再灌注损伤机制有关的代谢物,这些代谢物主要涉及10条代谢途径。本研究结果为后续潜在生物标志物和靶标途径的选择研究提供了重要的参考。

