Transgelin-2对牙龈卟啉单胞菌感染的食管鳞状细胞癌细胞恶性生物学行为的影响
伍当柔,朱巧晴,朱亚飞,许海军,陈 攀,王 明,赵云岗,孙丹妮,郭 苒,高社干,齐义军
1)河南科技大学临床医学院;河南科技大学第一附属医院;河南省肿瘤表观遗传重点实验室;河南省微生态与食管癌防治重点实验室 河南洛阳 4710032)北京垂杨柳医院老年医学科 北京 100022 3)郑州大学第一附属医院医学研究中心 郑州 450052 4)长治市妇幼保健院医学遗传科 山西长治 046000 5)宝鸡市妇幼保健院检验科 陕西宝鸡 721006
口腔中牙龈卟啉单胞菌(Porphyromonasgingivalis,PG)富集能够增加食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)的罹患风险[1-2]。中国食管癌高发区ESCC患者癌组织中PG丰度高于癌旁组织,并且其丰度与TNM分期呈正相关,与肿瘤分化程度和总生存期呈负相关[3]。然而,PG促进ESCC演进的分子机制仍不十分清楚。
肿瘤细胞的转移扩散依赖于细胞的迁移和侵袭能力,涉及肌动蛋白微丝(filamentous actin,F-actin)的动态聚合/解聚[4]。Transgelin-2属于肌动蛋白结合蛋白,通过与F-actin相互作用调控细胞骨架,与癌细胞增殖、侵袭和迁移关系密切[5]。牙龈上皮细胞感染PG 30 min,F-actin即可重新分布于细胞表面形成微丝样突起,伴随着F-actin所形成的应力纤维在胞内纵行分布;24 h后,F-actin解聚并重新均匀分布于细胞周边;表明PG能够诱导细胞骨架动态变化,影响牙龈上皮细胞的生物学行为和功能[6]。因此,本研究观察了ESCC细胞感染PG和转染siTAGLN-2(TAGLN-2基因编码Transgelin-2蛋白)后F-actin和Transgelin-2表达的变化,检测了细胞增殖、迁移、侵袭能力的变化,探讨PG对ESCC细胞恶性生物学行为的影响及可能的机制。
1 材料与方法
1.1 细菌及细胞来源野生型PG(ATCC33277)来源于ATCC细胞库,ESCC细胞系NE6-C和KYSE140由河南科技大学第一附属医院肿瘤表观遗传重点实验室冻存。
1.2 实验分组将NE6-C或KYSE140细胞分为4组处理,分别转染siControl、感染PG、转染siTAGLN-2、转染siTAGLN-2+感染PG。siTAGLN-2序列和siControl序列分别为:5’-GGCAGUAGCCCGAGAUGAUTT-3’和5’-UUCUCCGAACGUGUCACGUTT-3’。转染操作步骤:取8 μL siControl或siTAGLN-2和10 μL siRNA-MATE(均购自吉玛基因股份有限公司)溶于200 μL无血清RPMI 1640培养基,用以培养细胞,12 h后更换培养基。感染PG时,感染复数为10,适时终止实验。
1.3 观测指标
1.3.1细胞增殖能力检测 将成功转染siControl或siTAGLN-2的细胞以3 000个/孔接种于96孔板,进行PG感染。分别于感染6、12、24、48、72 h后,每孔中加入10 μL的CCK-8,继续培养2 h,采用全自动酶标仪(Thermo Multiskan Ascent公司)测定450 nm波长处的吸光度值,绘制增殖曲线。实验重复3次。
1.3.2细胞周期检测 将成功转染siControl或siTAGLN-2的细胞以1×106个接种于10 cm细胞培养皿中进行PG感染。感染48 h后,加入BrdU继续培养2 h,胰蛋白酶消化后收集细胞,用预冷的体积分数70%乙醇、2 mol/L HCl和5 mg/mL BSA分别孵育30、30和10 min,加鼠抗BrdU(10 μmol/L ) 室温孵育1 h,加Alexa Fluor 488标记的抗鼠二抗(稀释度1∶500)孵育30 min,上流式细胞仪检测细胞周期。抗体均购自CST公司。实验重复3次。
1.3.3细胞迁移和侵袭能力的检测 细胞按1.2分组处理24 h后,取4×104个细胞重悬于250 μL无血清培养基中,接种于Matrigel未包被(迁移实验)或包被(侵袭实验)的Transwell小室(Corning公司),小室下层加入500 μL含体积分数10%小牛血清的培养基,分别于培养24 和36 h后终止实验。Transwell小室用4%多聚甲醛固定,结晶紫染色,用棉签擦除小室内部细胞,于显微镜下拍照,用Image J进行图片处理,分析迁移细胞数或侵袭细胞数。实验重复3次。
1.3.4细胞中Transgelin-2、F-actin、E-cadherin和Vimentin蛋白表达的免疫荧光法检测 NE6-C细胞分组处理24 h后,4%多聚甲醛固定细胞,分别加入Alexa Fluor 488标记的鬼笔环肽(标记F-actin)、抗Transgelin-2(稀释度1∶200)、抗E-cadherin(稀释度1∶400)或抗Vimentin(稀释度1∶100),4 ℃孵育过夜,DAPI复染,Zeiss LSM700共聚焦荧光显微镜下观察、拍照,采用Image J进行图片处理及分析。抗体均购自CST公司。实验重复3次。
1.3.5细胞中Transgelin-2、E-cadherin和Vimentin蛋白表达的Western blot法检测 细胞分组处理24 h后,以RIPA裂解液裂解提取细胞总蛋白。取40 μg蛋白进行SDS-PAGE电泳,分离、转膜、50 g/L脱脂奶封闭,加入抗Transgelin-2、抗E-cadherin和抗Vimentin一抗(均1∶1 000稀释),4 ℃孵育过夜,洗膜后应用HRP标记的山羊抗兔或鼠二抗室温孵育1 h,ECL显色。应用Image J进行定量分析。实验重复3次。
1.4 统计学处理应用SPSS 25.0进行统计学分析。采用析因设计的方差分析比较4组细胞、迁移、侵袭能力和蛋白表达水平。检验水准α=0.05。
2 结果
2.1 4组细胞增殖能力的比较增殖曲线见图1。 PG感染可以增加ESCC细胞增殖速率,siTAGLN-2转染则降低细胞增殖速率;两者联合,siTAGLN-2转染可以显著拮抗PG感染的效应,细胞增殖速率显著低于对照组。
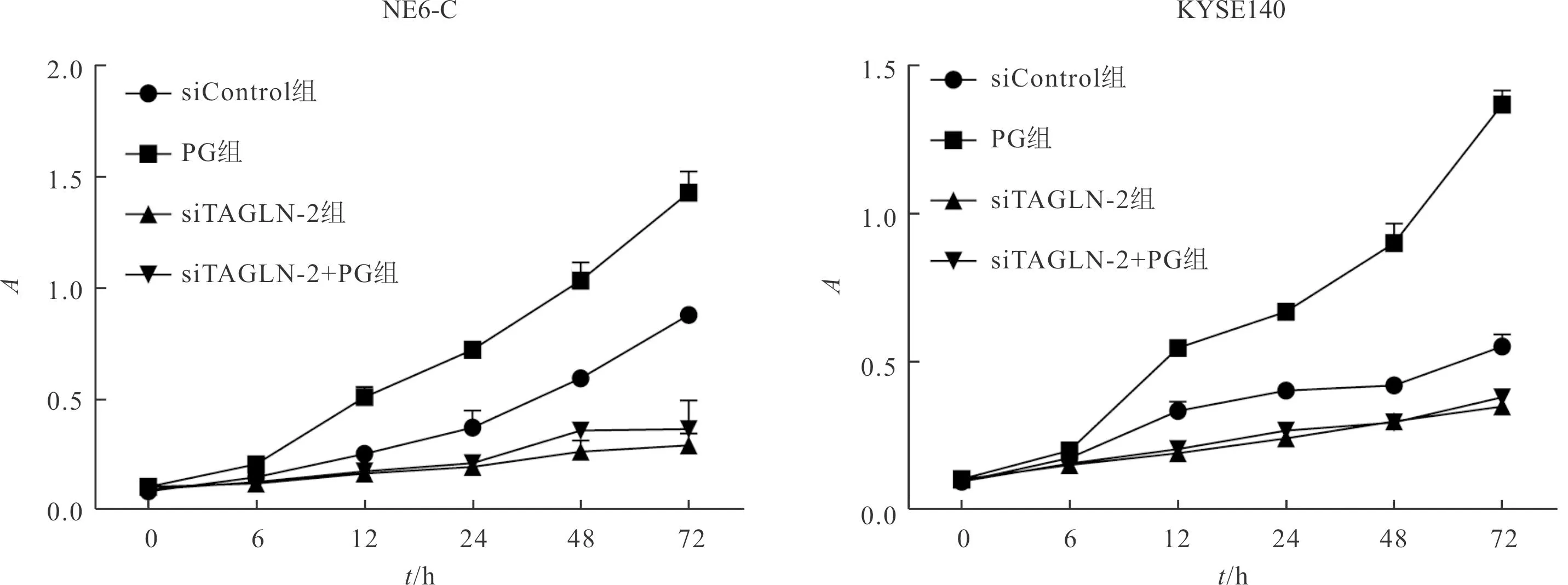
左:FsiTAGLN-2=851.612,FPG=198.217,F时间=335.567,FsiTAGLN-2×PG=125.039,F三交互=10.692,P均<0.001。右:FsiTAGLN-2=1 693.946,FPG=647.733,F时间=748.052,FsiTAGLN-2×PG=558.961,F三交互=97.422,P均<0.001
2.2 4组细胞周期、迁移和侵袭能力的比较各指标测定结果见表1、2。PG感染可以增加ESCC细胞S期细胞比例、侵袭细胞数和迁移细胞数,siTAGLN-2转染则降低上述指标;两者联合,siTAGLN-2转染可以显著拮抗PG感染的效应,细胞侵袭、迁移能力显著低于对照组。
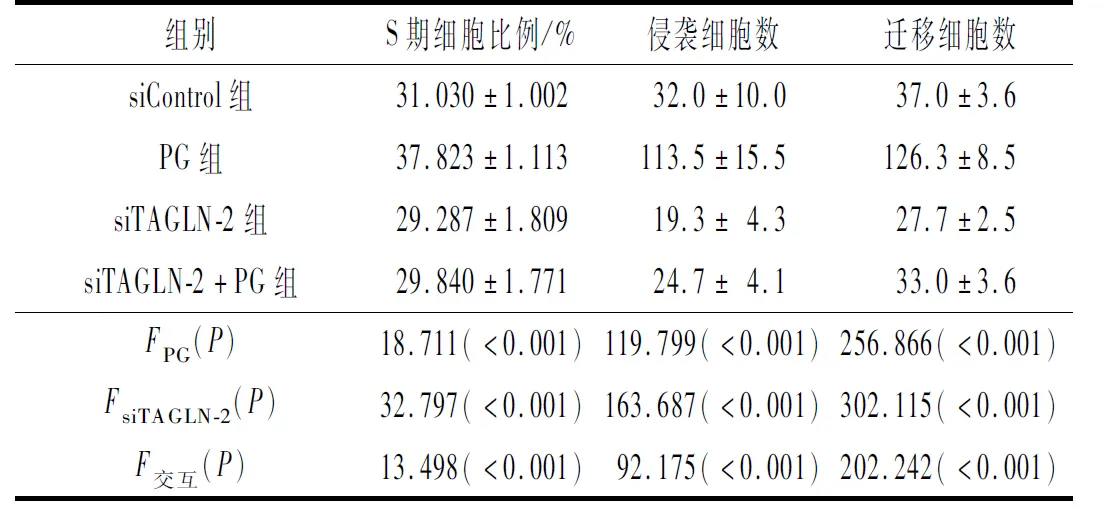
表1 4组NE6-C细胞S期细胞比例、迁移和侵袭细胞数的比较(n=3)
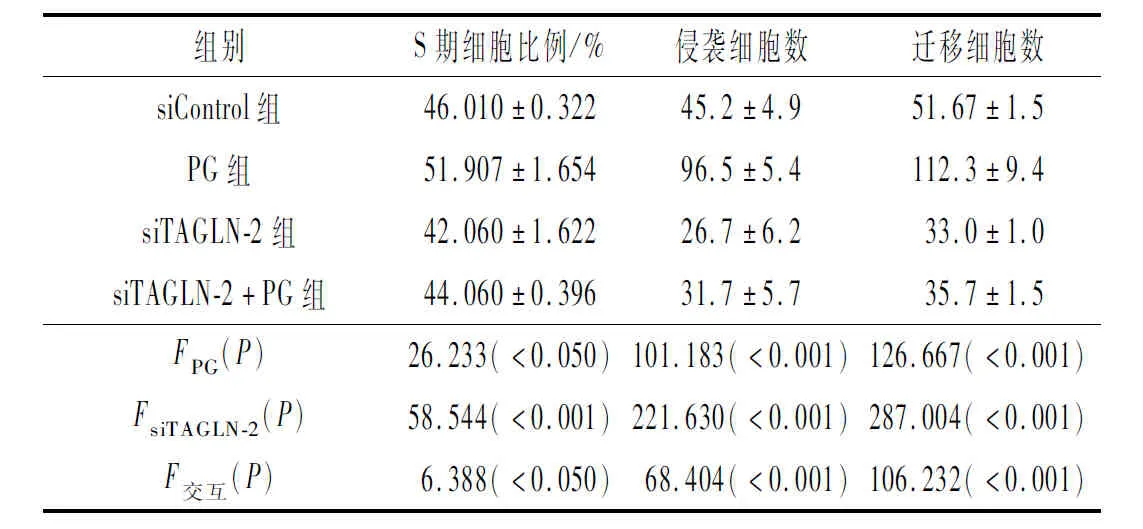
表2 4组KYSE140细胞S期细胞比例、迁移和侵袭细胞数的比较(n=3)
2.3 4组细胞中Transgelin-2及F-actin的表达免疫荧光结果见图2,Western blot结果见图2、表3。siControl组细胞中F-actin与细胞长轴平行纵行分布;PG组细胞中F-actin较siControl组明显减少,siTAGLN-2组和siTAGLN-2+PG组细胞中F-actin较PG组明显增多。PG感染可以增加ESCC细胞中Transgelin-2的表达,siTAGLN-2转染则降低细胞中Transgelin-2的表达;两者联合,siTAGLN-2转染可以显著拮抗PG感染的效应,Transgelin-2的表达显著低于对照组。

表3 4组细胞中Transgelin-2蛋白表达的比较(n=3)

1:siControl组;2:PG组;3:siTAGLN-2组;4:siTAGLN-2+PG组
2.4 4组细胞中E-cadherin和Vimentin蛋白表达的比较见图3和表4。PG感染可以降低ESCC细胞中E-cadherin表达,上调Vimentin表达;siTAGLN-2转染可以升高E-cadherin表达,降低Vimentin表达;两者联合,siTAGLN-2转染可以显著拮抗PG感染的效应。

表4 4组细胞中E-cadherin和Vimentin蛋白表达的比较(n=3)
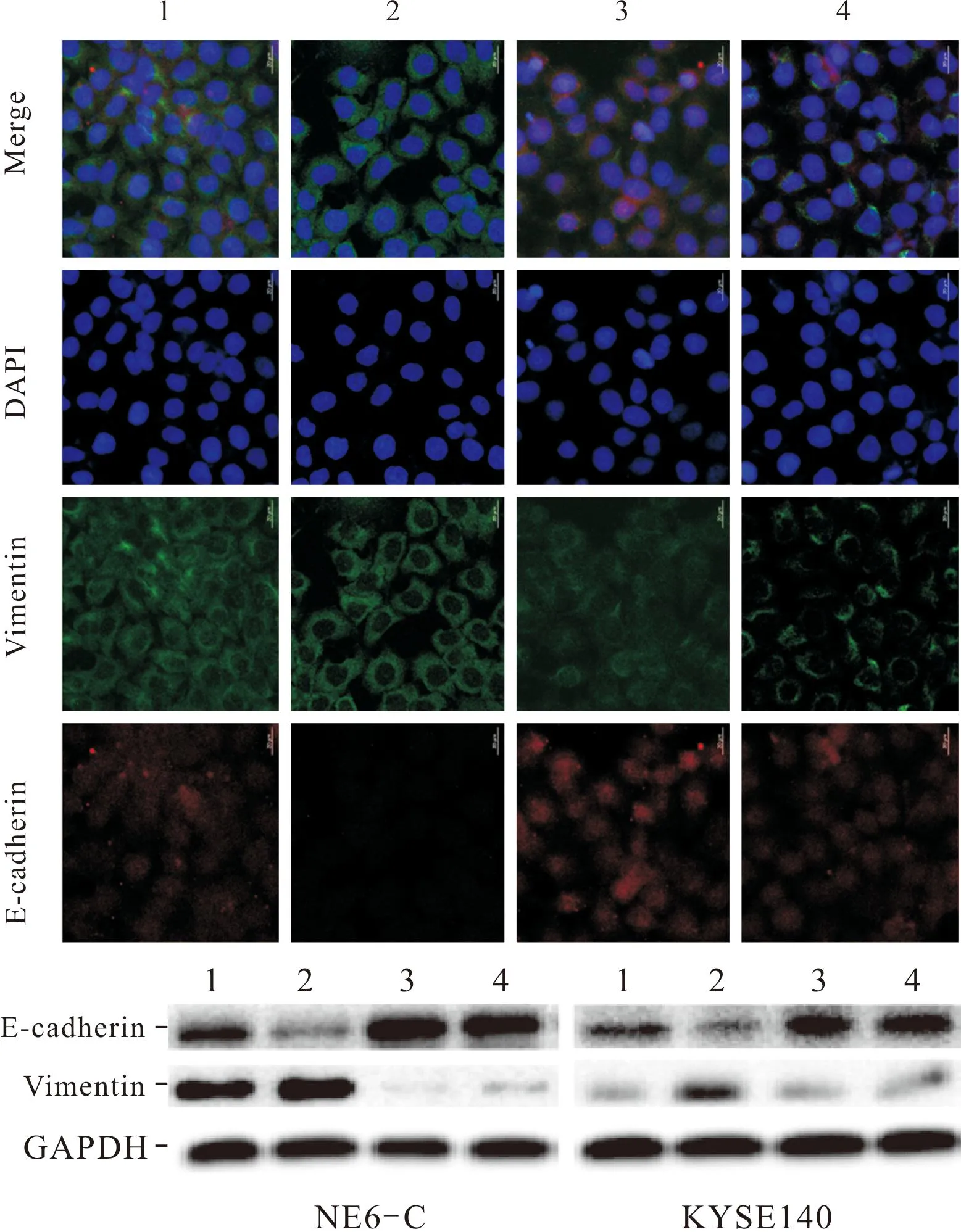
1:siControl组;2:PG组;3:siTAGLN-2组;4:siTAGLN-2+PG组
3 讨论
虽然中国食管癌的发病率和死亡率近年已呈下降趋势,但仍居所有恶性肿瘤的第5位和第4位[7]。2016年,本课题组[3]报道了PG富集于ESCC组织,并且高丰度PG与ESCC低分化程度、高TNM分期以及ESCC预后不良显著相关,因此推测PG感染促进了ESCC恶性演进过程。本研究中,PG感染可以增加ESCC细胞增殖速率,增加S期细胞比例、侵袭细胞数和迁移细胞数;siTAGLN-2转染则降低了ESCC细胞的增殖速率,降低了S期细胞比例、侵袭细胞数和迁移细胞数;两者联合,siTAGLN-2转染效应更显著。本研究结果证实,PG感染促进了ESCC的转移、侵袭能力,这种效应可以被siTAGLN-2转染显著拮抗,提示Transgelin-2介导了PG感染诱导的ESCC细胞侵袭和转移能力的增强。
微丝、微管、中间丝等细胞骨架成分不仅参与细胞结构维系、形态变化、胞吞及胞内物质转运、肌肉收缩等生物学过程,还与细胞黏附、黏着斑激活、细胞伪足形成等细胞迁移过程密切相关[8]。维持肌动蛋白微丝结构和功能的完整性,细胞才能正常行使生理功能。Transgelin-2是一种肌动蛋白结合蛋白[5]。细胞黏附蛋白E-cadherin通过Catenin与F-actin连接形成E-cadherin/Catenin/Actin复合体,维持细胞黏附、细胞极性、细胞增殖等过程[9]。在PG感染、侵入细胞的过程中,细胞骨架相关分子如FAK、paxillin、vinculin、talin等表达水平或活性发生变化,微管重新分布,F-actin分布于细胞周边和胞膜形成微刺样凸起,以利于细菌的侵入和定植,并且激活多个信号通路,诱导炎症因子的表达、释放[6,10]。本研究应用PG感染ESCC细胞后,胞内F-actin表达减少,丝状伪足和黏着斑增多,Transgelin-2表达增加,但与F-actin共定位明显减少;沉默Transgelin-2表达,则F-actin明显增加;研究结果表明,PG定植于ESCC细胞内可引起F-actin为代表的细胞骨架变化,Transgelin-2介导了F-actin的解聚过程,从而增加了ESCC细胞的侵袭和转移能力。
上皮间质转化与肿瘤发生、转移、肿瘤干性和肿瘤化疗耐药性密切相关[11]。本研究中,PG感染的ESCC细胞中E-cadherin表达降低,Vimentin表达升高,而沉默Transgelin-2则可以阻断了PG诱导的上皮间质转化。结直肠癌中F-actin与E-cadherin/Catenin/Actin构成的复合体在CARD表达降低时解离,但APCMIN:CRAD+/-鼠的结直肠自发肿瘤并未发生上皮间质转化,这与本研究结果并不一致,可能是PG不但引起F-actin解聚,还通过其他信号通路或分子诱导上皮间质转化发生,如Transgelin-2。但Transgelin-2介导PG引起ESCC发生的具体分子机制尚需更深入的研究证实。
综上所述,本研究证实PG感染可显著增强ESCC细胞的增殖、迁移和侵袭能力,沉默Transgelin-2表达则可阻断PG的肿瘤促进作用,Transgelin-2可能是PG感染型ESCC患者潜在的分子诊断标志物和治疗靶点。

