C/GP/Co水凝胶联合肌腱干细胞在大鼠跟腱损伤愈合中的作用研究
杨志金,徐 江,徐雁华,陈 康,谢美明,唐康来
1.中国人民解放军联勤保障部队第九二〇医院康复医学科,昆明 650032; 2.中国人民解放军西部战区总医院骨科,成都 610083; 3.陆军军医大学第一附属医院运动医学中心,重庆 400038
肌腱损伤在体育运动及日常生活中均十分常见。肌腱损伤的治疗是骨科及运动医学的一个难题,目前仍没有最佳治疗方案,治疗方法也尚有争论,临床迫切需要切实有效的治疗方法[1- 2]。干细胞治疗有望促进损伤肌腱组织再生,肌腱干细胞(tendon stem cells,TSCs) 是来源于肌腱组织的一种间充质干细胞[3-4]。TSCs具有多向分化潜能,并且在维持肌腱自我平衡及促进肌腱损伤修复中发挥关键作用。采用TSCs促进肌腱损伤修复是一项极有前景的治疗方法。TSCs需要适当的支架以保持其干细胞的干性及成肌腱分化能力,且支架在肌腱组织再生的过程中起到重要作用[2]。
细胞外基质(extracellular matrix,ECM)及其组成成分对健康肌腱的发育及维护起到重要作用,肌腱组织ECM的主要成分是I型胶原[5]。I型胶原具有良好的生物相容性、生物活性及可降解性,是最适宜作为肌腱组织工程的生物材料[6]。水凝胶具有良好的生物相容性、天然的仿生特征,用作肌腱组织工程支架切实可行[7]。水凝胶为移植的TSCs提供了一个良好的载体及模拟ECM的微环境,营养物质及氧气等能轻易地在水凝胶内部移动[8]。水凝胶在各类组织的损伤愈合过程中均有应用可能[9]。
笔者课题组在前期实验中,按6∶1∶8的体积比,成功制作了壳聚糖/β-甘油磷酸钠/胶原(chitosan/β-glycerophosphate/collagen,C/GP/Co)水凝胶,并对其理化性质及生物相容性进行了详细研究。结果证实:C/GP/Co水凝胶对营养物质和水溶性代谢产物具有良好的渗透性,也有利于TSCs的存活及生长[10]。此外,C/GP/Co可在液体状态时包裹细胞,通过微创的方式注射至损伤部位,然后在生理情况下,体温37°C以上时形成凝胶。
本实验拟首先建立大鼠急性跟腱损伤模型,然后将C/GP/Co水凝胶联合TSCs注射至大鼠跟腱损伤区域,通过组织学、成肌腱相关基因的表达及成肌腱分化相关蛋白检测等指标评价C/GP/Co联合TSCs对大鼠跟腱损伤的治疗效果,并分析其可能的作用机制。
材料与方法
1 实验动物
98只雄性SD大鼠(4周龄,体重约100g,由陆军军医大学实验动物中心提供)。其中2只用于提取TSCs,96只用于进一步动物实验。实验动物均严格按照实验动物治疗和处理指南进行处理,实验程序均由陆军军医大学动物研究伦理委员会批准 [SYXK(渝)20170002]。
2 主要试剂
壳聚糖(脱乙酰度>95%,大连美仑生物公司,中国);β-甘油磷酸钠 (上海瑞永生物公司,中国);Ⅰ型鼠尾胶原溶液(上海鲁汶生物公司,中国);天狼星红染色液(北京索莱宝公司,中国);苦味酸染色液(北京索莱宝公司,中国);mRNA提取试剂盒(Takara公司,日本);荧光定量PCR试剂盒(Takara公司,日本)。
3 主要仪器
E400POL偏振光显微镜(NIKON公司,日本);iMarkTM酶标仪(Bio-Rad 公司,美国);ABI 7500实时荧光定量PCR仪(Life Tech公司,美国);Cycler Real time PCR仪(BIO-RAD公司,美国);自动凝胶成像(Eppendorf公司,德国)。
4 方法
4.1SD大鼠跟腱TSCs的分离及培养 取4周龄雄性SD大鼠2只,体重约100g,用于SD大鼠跟腱TSCs的分离及培养,具体分离及培养步骤采用笔者课题组前期研究使用方法[10]。
4.2C/GP/Co水凝胶的配制 在超净台中、无菌条件下,配制体积比为6∶1∶8的C/GP/Co溶液,具体步骤采用笔者课题组前期研究使用方法[10]。
4.3大鼠跟腱损伤模型的建立及分组 取96只SD大鼠,建立左侧后肢急性跟腱损伤动物模型,具体步骤采用笔者课题组前期研究使用方法,右侧后肢不做任何处理[10]。
将96只左侧跟腱缺损的SD大鼠完全随机分为4个组,每组包含24只大鼠。分别为:(1)对照组:左侧跟腱缺损术后,自然愈合组;(2)水凝胶组:单纯在跟腱损伤区域注射300μL C/GP/Co水凝胶;(3)TSCs组:单纯在跟腱损伤区域注射106TSCs;(4)TSCs联合水凝胶治疗组:在跟腱缺损区域注射300μL C/GP/Co水凝胶及106TSCs。
每组大鼠分别于损伤后2、4、6周,用CO2过度麻醉法各处死8只,迅速将大鼠左侧跟腱完整取出,用于组织学检测及基因、蛋白表达检测。
4.4天狼星红染色 分别将不同时间点的4组大鼠的跟腱取材。石蜡切片常规脱蜡、水化,苏木素染色液染细胞核20min,自来水冲洗5min,蒸馏水冲洗1次,用天狼星红苦味酸染色液染色1h,自来水冲洗5min,常规脱水、透明,中性树胶封片。偏振光显微镜下观察,采集图像,图像分析采用IPP(Image-Pro Plus)6.0专业图像分析软件,对Ⅰ型、Ⅲ型胶原的比例进行定量分析。
4.5实时荧光定量(real-time fluorescent quantitative PCR,RT-qPCR)分析 为比较各组成肌腱基因的表达情况,采用PCR分析成肌腱Ⅰ型胶原、Ⅲ型胶原及scleraxis(SCX)的变化情况。分别将不同时间点4组的大鼠跟腱取材,每个跟腱样本取约200mg组织,分离提取总RNA,使用微量分光光度计测定RNA浓度,OD260/280范围在1.7~2.1,符合要求,然后逆转录合成互补DNA(complementary DNA,cDNA),用ABI 7500 PCR仪进行PCR分析。所有的引物序列(表1)由primer 5.0软件设计并由上海生工公司合成。每个样本重复检测3次,每个基因检测3个PCR循环,检测各基因扩增的Ct值,以甘油醛-3-磷酸脱氢酶( glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作为内参基因,目的基因的表达水平用2-△△Ct公式计算获得。数据分析采用CFX Manager 3.0软件(Bio-Rad),目标基因的表达水平标准化至内参基因水平。
4.6成肌腱分化相关蛋白检测 肌腱相关的特定蛋白表达水平用蛋白质印迹法(western blot,WB)进行检测,分别将不同时间点的4组大鼠跟腱取材,提取总蛋白,蛋白定量采用二喹啉甲酸(bicinchoninic acid,BCA)蛋白质定量试剂盒完成(按照上海碧云天公司BCA试剂盒说明书操作)。用蛋白裂解液作为对照,用酶标仪562nm(540~590nm)测出样本的吸光度值,分别计算各组标本的蛋白浓度。在十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳液中分离总蛋白,转移蛋白到PVDF膜,室温下用5%BSA封闭液(block buffer)封闭2h,分别加入对应的抗体Ⅰ型胶原(1∶500)、Ⅲ型胶原(1∶250)、SCX (1∶500)及GAPDH (1∶3000),4℃孵育过夜。再加入辣根过氧化物酶标记的二抗(1∶3000),室温孵育2h,用增强化学发光底物显影印迹、曝光。蛋白的表达水平通过Image J软件来测定条带面积和灰度值,以GAPDH条带为内参(n=3),计算4组的相对蛋白表达水平。
5 统计学分析
结 果
1 天狼星红染色观察
肌腱组织天狼星红染色在偏振光显微镜下较容易区分出Ⅰ、Ⅲ型胶原纤维,Ⅰ型胶原纤维较粗大、排列紧密,具有强双折光性,呈红色或橙色;而Ⅲ型胶原纤维较细,具有弱双折光性,在镜下呈绿色(图1)。天狼星红染色结果显示损伤后2周时,各组的Ⅰ型胶原面积占比比较差异无统计学意义(P>0.05,图1b)。在损伤后4周及6周时,TSCs联合水凝胶治疗组的Ⅰ型胶原面积占比明显大于其他3组,差异有统计学意义(P<0.05,图1b)。天狼星红染色结果显示损伤后2周时,各组的Ⅲ型胶原面积占比比较差异无统计学意义(P>0.05,图1c)。在损伤后4周及6周时,TSCs联合水凝胶治疗组的Ⅲ型胶原面积占比明显小于其他3组,差异有统计学意义(P<0.05,图1c)。
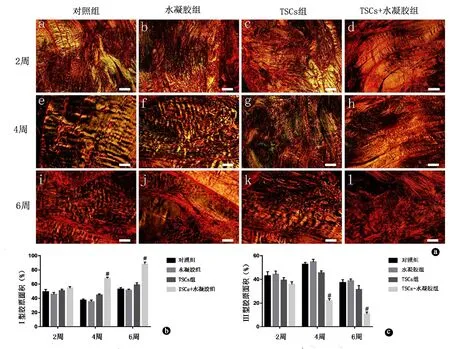
图1 天狼星红染色观察及Ⅰ型胶原、Ⅲ型胶原面积占比统计分析。a.损伤后2、4、6 周各组跟腱组织天狼星红染色观察,Ⅰ型胶原纤维呈橙黄色,Ⅲ型胶原纤维呈绿色,放大倍数:×100,标尺=200 μm;b.损伤后2、4、6周各组跟腱组织天狼星红染色Ⅰ型胶原面积占比统计分析;c.损伤后2、4、6周各组跟腱组织天狼星红染色Ⅲ型胶原面积占比统计分析。#:P<0.05;TSCs:肌腱干细胞
2 PCR检测相关基因的表达
损伤后2、4、6 周时,各组Ⅰ型胶原及SCX mRNA的表达量均成逐渐上升趋势,其中Ⅰ型胶原mRNA增加更明显(图2)。在损伤后2、4、6 周时,TSCs联合水凝胶治疗组Ⅰ型胶原及SCX mRNA的表达量均明显高于其他3组,差异有明显统计学意义(图2a、c)。表明移植到大鼠体内的TSCs在C/GP/Co水凝胶的协同作用下,利于向肌腱细胞分化。
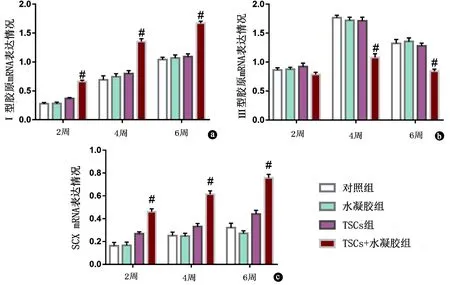
图2 PCR检测相关基因的表达。a.Ⅰ型胶原mRNA表达情况;b.Ⅲ型胶原mRNA表达情况;c.SCX mRNA表达情况。#:P<0.05;TSCs:肌腱干细胞
损伤后2周,各组Ⅲ型胶原mRNA的表达量开始增加,但各组之间无明显差异。损伤后4周,各组Ⅲ型胶原mRNA的表达量增加至最高水平,但TSCs联合水凝胶治疗组明显低于其他3组,差异有统计学意义(P<0.05)。损伤后6周,各组Ⅲ型胶原mRNA的表达量较前明显降低,TSCs联合水凝胶治疗组明显低于其他3组,差异有统计学意义(图2b),表明移植到大鼠体内的TSCs在C/GP/Co水凝胶的协同作用下,可抑制损伤区域瘢痕组织的增生,有利于提高损伤肌腱愈合质量。
3 WB检测相关蛋白的表达
损伤后2周,TSCs联合水凝胶治疗组Ⅰ型胶原明显高于其他3组,差异有统计学意义(P<0.05)。但TSCs联合水凝胶治疗组Ⅲ型胶原明显低于其他3组,差异有统计学意义(P<0.05)。各组之间SCX无明显差异(图3a、b)。
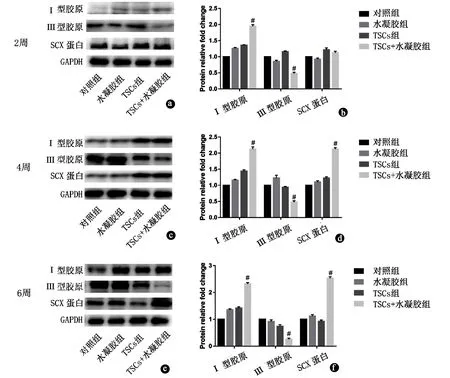
图3 WB检测相关蛋白的表达:检测2周(a、b)、4周(c、d)及6周(e、f)各组成肌腱相关蛋白及细胞外基质蛋白(Ⅰ型胶原、Ⅲ型胶原及SCX蛋白)的表达情况。各组以对照组数据为参照,评估各组间的表达量差异(n=3)。#:P<0.05;GAPDH:甘油醛-3-磷酸脱氢酶;TSCs:肌腱干细胞;protein relative fold change:蛋白质相对倍数差
损伤后4、6周,TSCs联合水凝胶治疗组的Ⅰ型胶原及SCX均明显高于其他3组,差异有统计学意义(P<0.05)。TSCs联合水凝胶治疗组的Ⅲ型胶原明显低于其他3组,差异有统计学意义(P<0.05,图3c~f)。
讨 论
肌腱是肌肉骨骼系统的重要组成部分,其作用是在肌肉和骨骼之间传递力量以实现关节运动[11]。肌腱损伤常在体育运动及其他剧烈活动中发生,是肌肉骨骼系统最常见的损伤之一,其病因是多因素的,包括创伤、长期过度使用、老龄、炎症和遗传因素[12]。由于肌腱的愈合能力差,损伤后不能有效修复,修复过程往往时间长,且常伴有瘢痕组织形成,导致损伤肌腱的机械性能下降,容易发生二次损伤或反复损伤[13]。肌腱损伤的治疗通常采用非手术治疗或手术治疗,然而无论何种治疗均有其局限性,不能恢复肌腱组织的天然成分、组织结构及机械性能[14-15]。
肌腱损伤临床治疗效果差,可导致持续不适、功能和活动能力受损,常伴有长时间的功能障碍。肌腱的血供较其他大部分结缔组织差,肌腱再生及修复缓慢,而且效果不理想。肌腱损伤后往往不能恢复其正常的生理功能及生物力学状态。肌腱损伤后,肌腱修复及瘢痕形成常同时发生。目前认为损伤肌腱的修复可以分为3个阶段,包括:炎症反应期、细胞增殖期、重塑与成熟期,这些阶段互相重叠、相互依赖。在早期炎症反应阶期,红细胞、炎症细胞,特别是中性粒细胞浸润至损伤部位,TSCs逐渐迁移至损伤部位,Ⅲ型胶原开始合成。损伤几天后,在细胞增殖期,Ⅲ型胶原的合成达到最高峰;损伤几周后,在重塑与成熟期,Ⅰ型胶原开始大量合成[16-17]。
干细胞是治疗肌腱损伤、促进损伤肌腱修复极具前景的方法。现有研究表明:间充质干细胞(mesenchymal stem cells,MSCs)、骨髓间充质干细胞(bone marrow derived mesenchymal stem cells,BMSCs)、脂肪间充质干细胞(adipose-derived mesenchymal stem cells,ADSCs)等均能促进肌腱损伤修复[18- 19]。TSCs是肌腱来源,具有异体移植潜力的免疫豁免细胞[20]。使用TSCs治疗肌腱损伤,促进肌腱损伤修复是最明智也是最有前景的治疗策略。局部注射TSCs至大鼠跟腱损伤区域很难避免干细胞渗漏等问题,而且TSCs也很难长时间在损伤部位发挥治疗作用,因此研究更适宜的干细胞移植技术显得十分重要。使用生物支架材料包裹干细胞注射至损伤部位以治疗肌腱损伤应是十分理想的策略,合适的生物支架材料应具有良好的生物相容性,不刺激宿主引起炎症反应。
理想的肌腱组织工程支架应尽可能模拟肌腱的天然ECM,以调节营养物质、氧气和代谢废物,且免疫和炎症反应较轻,同时应具有适当的机械性能、可降解性及良好的生物相容性,有利于细胞生长、增殖和分化[21]。水凝胶是一种具有生物活性、生物相容性及可生物降解的生物材料。现有研究表明:MSCs、BMSCs及ADSCs联合壳聚糖及β-甘油磷酸钠水凝胶,在体内及体外实验中均取得了良好的效果[22- 23]。笔者在前期的实验中制备并证实C/GP/Co水凝胶可充分模拟天然肌腱的ECM[10]。本研究证实C/GP/Co联合TSCs可明显促进I型胶原及SCX的表达。Ⅰ型胶原及SCX是肌腱在组织水平的特异标志[20]。与此同时,C/GP/Co联合TSCs可降低大鼠跟腱损伤区域Ⅲ型胶原的表达。肌腱损伤早期,Ⅲ型胶原及肉芽组织在损伤区域大量增殖。在肌腱损伤的自然愈合过程中,成功塑形的典型特征是损伤区域的Ⅰ型胶原逐渐替代Ⅲ型胶原[24]。
SCX是TSCs分化的关键调节因素,是肌腱的特异标志物[25]。Ⅰ型胶原是肌腱里的主要胶原,占胶原总量的90%[16,26]。本实验中Ⅰ型胶原和SCX的高表达表明损伤愈合的肌腱具有良好的胶原结构。Ⅰ型胶原和肌腱组织的机械强度密切相关,理想的Ⅰ/Ⅲ型胶原比例也与肌腱的愈合质量紧密相关[27]。本实验通过建立大鼠跟腱缺损模型,使用C/GP/Co水凝胶联合TSCs注射至损伤局部,结果证实C/GP/Co水凝胶联合TSCs可明显促进肌腱损伤愈合。具体表现为改善了细胞及胶原纤维的排列,增强了损伤愈合肌腱的生物力学性能等。本研究中,C/GP/Co水凝胶联合TSCs组的Ⅰ/Ⅲ胶原比例较对照组等明显升高,是其生物力学性能明显增强的关键因素。
TSCs单独治疗肌腱损伤无明显疗效,本研究结论和其他学者的研究结果相一致。Chen等[28]研究证实:富血小板血浆可促进肌腱损伤愈合,TSCs可明显增强PRP的治疗效果,但单独注射TSCs并不能促进肌腱损伤修复。其他证实干细胞有利于损伤肌腱修复的研究中,均使用了各种生物材料,包括肌腱凝胶[29]、纤维蛋白胶[30]及蚕丝胶原海绵状支架[20]等。
本研究存在一些不足:首先本研究仅观察了跟腱损伤后2、4、6 周的治疗效果,研究周期较短,缺乏更长时间治疗效果的研究资料;此外,本研究未进行C/GP/Co水凝胶联合TSCs治疗的作用机制研究。在下一步实验中,笔者团队将在C/GP/Co水凝胶的性能优化,及C/GP/Co水凝胶联合TSCs治疗肌腱损伤的作用机制等方面进行深入研究,为肌腱损伤的治疗提供更坚实的理论基础,以及为C/GP/Co水凝胶联合TSCs治疗肌腱损伤提供切实可行的策略。
作者贡献声明:杨志金:课题及实验设计、操作、记录,论文撰写、修改及审校; 徐江、徐雁华、陈康:文献检索、资料收集整理、数据整理; 谢美明:实验指导、论文修改及审校;唐康来:研究及课题指导、实验指导、论文修改