微生物菌剂对芦竹修复Pb污染土壤的影响
王柯懿, 陈霞霞, 莫 凌, 曾丹娟, 蒲高忠
(广西壮族自治区中国科学院广西植物研究所 广西喀斯特植物保育与恢复生态学重点实验室, 广西 桂林 541006)
Pb是一种生命非必需元素,在土壤中无法被生物降解,可通过食物链在人和动物体内不断积累,对土壤生态系统以及人类和动物健康造成严重威胁[1]。中国耕地土壤Pb的点位超标率为1.5%,在金属污染物点位超标率中排名第6位[2]。研究发现,Pb在广西中部岩溶地区农田土壤中的点位超标率和平均超标倍数均最高[3],因此,亟需解决该区域的土壤Pb污染问题。
植物修复技术是一种廉价、环境友好且可持续原位治理土壤重金属污染的方法,通过植物的吸收、固定、转移和蒸腾作用,达到降低或去除土壤中重金属的目的[4-5]。芦竹(ArundodonaxLinn.)为禾本科(Poaceae)多年生草本植物,具有生物量高、适应能力强和生长快等优点[6]。芦竹可作为非粮生物能源作物,能避免重金属元素在食物链中传递,被广泛应用于重金属污染土壤修复[7]。Pu等[8-9]认为,芦竹对Cd、As、Pb、Cr和Tl的耐受性较强,是修复重金属污染土壤的理想植物材料。Pb胁迫会破坏植物正常的生长发育过程及生理生化功能[10-13],这在一定程度上限制了芦竹在Pb污染土壤修复中的应用。因此,如何提高芦竹对土壤中Pb的吸收能力是利用芦竹修复Pb污染土壤面临的首要问题。
微生物菌剂为通过工业化加工方法以功能微生物活菌为原料制成的制剂,具有成本低、易操作、促进植物生长、提高植物吸收重金属能力等特性,在土壤改良与修复中应用广泛且成效显著[14]。微生物及其分泌物(如吲哚乙酸、赤霉素、细胞分裂素等)可以有效刺激和调节Pb胁迫下植物的生长发育及防御应答能力[15-18]。ETS微生物菌剂为一种商业微生物制剂,具有功能性强、经济效益高的优点,可明显提高土壤微生物多样性,促进植物生长[19],是一种极具强化植物修复Pb污染土壤潜力的微生物菌剂[20]。
鉴于此,本研究以未添加微生物菌剂和Pb为对照组,对微生物菌剂单一处理组、Pb单一处理组和微生物菌剂-Pb复合处理组芦竹的生长情况和光合特性以及Pb积累和迁移特征进行比较,以期为利用微生物菌剂强化植物修复Pb污染土壤提供参考。
1 材料和方法
1.1 材料
实验使用的ETS微生物菌剂购自ETS(天津)生物科技发展有限公司,产品名为金水土黑白液(每毫升有效活菌数大于等于2.0亿),由托马斯菌群和巴斯德菌群叠加而成,其中,好氧菌种类占40%,厌氧菌种类占60%。受试芦竹为2年生芦竹的四倍体组培苗。栽培土壤为红黏土,即广西壮族自治区中国科学院广西植物研究所内的表层(0~20 cm)土壤,土壤总氮含量1.078 g·kg-1、总磷含量0.932 g·kg-1、总钾含量0.812 g·kg-1、Pb含量22.36 mg·kg-1,pH 6.80。
栽培实验在顶部透光的温室(温度20 ℃~25 ℃)内进行,供试芦竹按“品”字型种植在长、宽和高均为100 cm且底部具1个出水口的水泥池(先填充10 cm高的砾石,再填充200 kg红黏土,相邻水泥池间隔50 cm)中,每池3丛,丛距50 cm。
1.2 方法
1.2.1 实验设计 实验设置4个处理组,分别为对照组(未添加微生物菌剂和Pb)、微生物菌剂单一处理组(每个水泥池200 mL微生物菌剂)、Pb单一处理组(土壤Pb终质量浓度300 mg·kg-1)、微生物菌剂-Pb复合处理组(每个水泥池200 mL微生物菌剂,土壤Pb终质量浓度300 mg·kg-1)。每个处理组各1个水泥池,每丛视为1个重复。依照产品使用说明书上的灌根方法配制微生物菌剂溶液,稀释300倍后灌施于芦竹根部;微生物菌剂溶液分2次灌施,每次100 mL,种植当天第1次灌施,1周后再次灌施。按照土壤质量,使用分析纯Pb(CH3COO)2·3H2O粉末配制质量浓度10 g·L-1Pb溶液,喷洒到相应处理组的土壤中。
1.2.2 生长指标测定 培养120 d时,使用卷尺(精度1 mm)测量每丛芦竹从基部到顶部的高度,即株高;统计每丛芦竹茎杆高度在1 m及以上的分蘖数;采集每丛芦竹的完整植株,分成根、茎、叶3个部分,先于105 ℃杀青30 min,再于80 °C烘干至恒质量,使用地秤(精度0.01 kg)称量单丛根、茎、叶的干质量,并计算单丛地上部干质量(即单丛茎干质量和单丛叶干质量的总和)。
1.2.3 光合指标测定
1.2.3.1 叶绿素相对含量(SPAD)测定 培养16周后,在晴朗日9:00,参照李泽等[21]的方法,采用SPAD-502叶绿素测定仪(日本Konica公司)测定供试植株旗叶(即花序下第1枚叶)的SPAD值,测定时避开叶片主脉。每个处理组测定3丛,每丛检测1枚旗叶,每枚旗叶测定2个点,结果取平均值。
1.2.3.2 气体交换参数测定 培养16周后,在晴朗日9:00,采用LI-6400xt便携式光合仪(美国LI-COR公司)测定芦竹叶片的气体交换参数。选取供试植株的旗叶,测定时保持叶片自然生长角度,记录叶片的净光合速率、气孔导度、胞间CO2浓度和蒸腾速率。测定过程中设定光合有效辐射为(1 200±1) μmol·m-2·s-1,空气温度为(20±1) ℃,空气相对湿度为40%,大气CO2浓度为(400±20) μmol·mol-1。每个处理组测定3丛,每丛检测1枚旗叶,每枚旗叶测定2个点,结果取平均值。根据检测结果计算水分利用效率,计算公式为水分利用效率=净光合速率/蒸腾速率[22]。
1.2.4 芦竹Pb含量测定及Pb富集系数和Pb转运系数的计算 培养120 d时,测定芦竹根、茎和叶中的Pb含量。使用不锈钢粉碎机将烘干的根、茎、叶粉碎,过60目尼龙筛,用于芦竹根、茎、叶Pb含量测定。每个处理组测定3丛,视为3个重复。使用Multiwave Pro微波消解仪(奥地利Anton Paar公司)对植物样品进行消解,利用7700e ICP-MS电感耦合等离子体质谱仪(美国Agilent公司)测定样品中的Pb含量。根据测定结果,参照文献[23]计算不同器官的Pb富集系数和Pb转运系数,计算公式分别为某器官的Pb富集系数=该器官的Pb含量/土壤Pb含量,Pb转运系数=地上部Pb含量/根Pb含量。其中,地上部Pb含量=(单丛茎Pb质量+单丛叶Pb质量)/单丛地上部干质量,单丛茎(叶)Pb质量为茎(叶)Pb含量和单丛茎(叶)干质量的乘积。
1.3 数据处理分析
采用EXCEL 2010软件整理数据和制图,采用SPSS 23软件进行数据统计分析,并采用单因素方差分析法(one-way ANOVA)和最小显著差异法(LSD)进行差异显著性检验。
2 结果和分析
2.1 不同处理组芦竹生长指标的比较
结果(表1)表明:在4个处理组中,微生物菌剂单一处理组(每个水泥池200 mL微生物菌剂)芦竹的株高、分蘖数和单丛地上部干质量均最高,其中,株高和分蘖数与对照组(未添加微生物菌剂和Pb)和微生物菌剂-Pb复合处理组(每个水泥池200 mL微生物菌剂,土壤Pb终质量浓度300 mg·kg-1)的差异不显著(P>0.05),而单丛地上部干质量显著(P<0.05)高于对照组和微生物菌剂-Pb复合处理组,增幅分别为36.6%和52.5%。Pb单一处理组(土壤Pb终质量浓度300 mg·kg-1)芦竹的株高、分蘖数和单丛地上部干质量显著低于对照组,降幅分别为59.4%、57.4%和88.1%。微生物菌剂-Pb复合处理组芦竹的株高、分蘖数和单丛地上部干质量显著高于Pb单一处理组,增幅分别为119.9%、64.9%和650.0%。
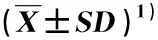
表1 不同处理组芦竹株高、分蘖数和单丛地上部干质量的比较Table 1 Comparisons on plant height, tiller number, and dry mass of above-ground part per clump of Arundo donax Linn. in different treatment groups
2.2 不同处理组芦竹光合指标的比较
结果(表2)表明:4个处理组间芦竹的叶绿素相对含量(SPAD)无显著(P>0.05)差异。微生物菌剂单一处理组(每个水泥池200 mL微生物菌剂)芦竹的气孔导度和胞间CO2浓度显著(P<0.05)高于对照组(未添加微生物菌剂和Pb),而净光合速率、蒸腾速率和水分利用效率与对照组无显著差异。Pb单一处理组(土壤Pb终质量浓度300 mg·kg-1)芦竹的气孔导度、胞间CO2浓度和蒸腾速率显著高于对照组,而净光合速率和水分利用效率与对照组无显著差异。微生物菌剂-Pb复合处理组(每个水泥池200 mL微生物菌剂,土壤Pb终质量浓度300 mg·kg-1)芦竹的净光合速率和蒸腾速率显著低于对照组,胞间CO2浓度和水分利用效率显著高于对照组,而气孔导度与对照组无显著差异。微生物菌剂-Pb复合处理组芦竹的净光合速率、气孔导度和蒸腾速率显著低于Pb单一处理组,降幅分别为24.9%、53.2%和58.0%,而水分利用效率显著高于Pb单一处理组,增幅为80.7%。
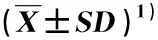
表2 不同处理组芦竹光合指标的比较Table 2 Comparisons on photosynthetic indexes of Arundo donax Linn. in different treatment groups
2.3 不同处理组芦竹Pb积累和迁移指标的比较
结果(表3)表明:微生物菌剂单一处理组(每个水泥池200 mL微生物菌剂)芦竹根、茎和叶的Pb含量不显著(P>0.05)高于对照组(未添加微生物菌剂和Pb),增幅分别为113.1%、94.1%和2.2%。Pb单一处理组(土壤Pb终质量浓度300 mg·kg-1)芦竹根的Pb含量显著(P<0.05)高于对照组和微生物菌剂单一处理组,茎的Pb含量显著高于对照组,叶的Pb含量显著低于微生物菌剂-Pb复合处理组(每个水泥池200 mL微生物菌剂,土壤Pb终质量浓度300 mg·kg-1)。微生物菌剂-Pb复合处理组芦竹根、茎和叶的Pb含量最高,分别较Pb单一处理组升高了15.2%、27.2%和141.6%。比较同一处理组不同器官Pb含量,对照组和微生物菌剂单一处理组表现为叶最高、茎次之、根最低,Pb单一处理组表现为根最高、茎次之、叶最低,而微生物菌剂-Pb复合处理组则表现为叶最高、根次之、茎最低。
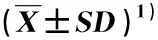
表3 不同处理组芦竹Pb含量、Pb富集系数和Pb转运系数的比较Table 3 Comparisons on Pb content, Pb concentration coefficient, and Pb translocation coefficient of Arundo donax Linn. in different treatment groups
结果(表3)表明:微生物菌剂单一处理组芦竹根、茎和叶的Pb富集系数均最高,其中,根和茎的Pb富集系数显著高于其他3个处理组;对照组芦竹根、茎、叶的Pb富集系数均次之,其中,茎和叶的Pb富集系数显著高于Pb单一处理组和微生物菌剂-Pb复合处理组;Pb单一处理组芦竹根、茎、叶的Pb富集系数均最低,微生物菌剂-Pb复合处理组芦竹根、茎、叶的Pb富集系数也较低,但芦竹根、茎、叶的Pb富集系数在这2个处理组间的差异不显著。比较同一处理组不同器官Pb富集系数,对照组和微生物菌剂单一处理组表现为叶最高、茎次之、根最低,Pb单一处理组表现为根最高、叶次之、茎最低,而微生物菌剂-Pb复合处理组则表现为叶最高、根次之、茎最低。
结果(表3)表明:4个处理组芦竹的Pb转运系数由高到低依次为对照组、微生物菌剂单一处理组、微生物菌剂-Pb复合处理组、Pb单一处理组,且芦竹的Pb转运系数在不同处理组间存在显著差异。值得注意的是,微生物菌剂-Pb复合处理组芦竹的Pb转运系数较Pb单一处理组升高了43.08%。
3 讨论和结论
重金属胁迫对植物生长发育具有毒害作用,微生物在辅助植物修复污染土壤方面表现出较大潜力,并且取得了良好的效果[24-25]。简敏菲等[26]对丁香蓼(LudwigiaprostrataRoxb.)的研究发现,Pb污染下丁香蓼的株高、根长和根质量等生长指标均下降;Punamiya 等[27]发现,香根草〔Chrysopogonzizanioides(Linn.) Rob.〕地上部干质量随着土壤Pb浓度的增加而降低。本研究结果显示:Pb单一处理组(土壤Pb终质量浓度300 mg·kg-1)芦竹株高、分蘖数和单丛地上干质量显著(P<0.05)低于其他处理组,说明土壤Pb污染抑制了芦竹的正常生长。江润海等[28]发现,微生物可以有效地刺激和调节Pb胁迫下植物的生长发育能力。Karimi等[29]发现,Pb胁迫下微生物可以显著提高黄瓜(CucumissativusLinn.)的地上部干质量。本研究对添加ETS微生物菌剂的Pb 污染土壤中芦竹的生长状况进行了研究,结果显示:微生物菌剂-Pb 复合处理组(每个水泥池200 mL微生物菌剂,土壤Pb终质量浓度300 mg·kg-1)芦竹的株高、分蘖数和单丛地上部干质量显著高于Pb单一处理组,表明微生物菌剂能够缓解Pb胁迫对芦竹生长的伤害。
已有研究结果表明:Pb胁迫可直接或间接影响植物的光合作用,高浓度Pb会对植物的叶绿素合成、CO2固定和细胞色素蛋白复合体等酶的正常运转产生抑制作用[30]。微生物菌剂-Pb复合处理组芦竹的叶绿素相对含量不显著低于Pb单一处理组,净光合速率显著低于Pb单一处理组,说明微生物菌剂对Pb胁迫下芦竹的光合能力具有一定的抑制作用。微生物菌剂-Pb复合处理组芦竹的气孔导度和蒸腾速率显著低于Pb单一处理组,胞间CO2浓度不显著低于Pb单一处理组。气孔是植物叶表皮与外界进行气体交换的主要通道,是植物体吸收CO2、发生蒸腾作用的重要器官[31]。植物通过调节气孔开度调控CO2吸收能力和蒸腾作用水平[32],以适应环境的变化。推测微生物菌剂-Pb复合处理组芦竹气孔导度、蒸腾速率和胞间CO2浓度的变化可能与微生物对气孔的影响[33-34]有关,具体作用机制有待后续研究。研究发现,植物的水分利用效率与其生长情况呈正相关[35]。本研究中,微生物菌剂-Pb复合处理组芦竹的水分利用效率显著高于Pb单一处理组,芦竹的株高、分蘖数和单丛地上部干质量也显著高于Pb单一处理组,验证了上述结论。总体来看,微生物菌剂会抑制Pb胁迫下芦竹的光合作用,但作用机制尚不清楚,有待深入研究。
Gupta等[36]的研究结果表明:Pb在植物体内主要以Pb3(PO4)2和PbCO3等形式存在,导致Pb胁迫下植物根系吸收的大部分Pb难以运输到地上部,仍停留在根系中。Su等[37]认为,Pb主要累积在植物根和茎的非活性代谢区域(即细胞壁和囊泡),这可能是植物缓解Pb胁迫的主要机制。本研究发现,Pb单一处理组芦竹根的Pb含量最高、茎次之、叶最低,在一定程度上印证了上述结论。微生物菌剂-Pb复合处理组芦竹不同器官的Pb含量则表现为叶最高、根次之、茎最低,说明添加微生物菌剂能够促进Pb胁迫下芦竹根系吸收的Pb向地上部尤其是叶的转移。
植物对重金属的富集系数和转运系数是评价植物修复重金属污染土壤能力的重要指标。一般认为,植物运输重金属的能力越强越有利于植物吸收重金属[38]。Rezvani等[39]发现,丛枝菌根真菌(arbuscular mycorrhizal fungi,AMF)能够显著提高大麦(HordeumvulgareLinn.)对Pb的吸收能力;Xiao等[40]研究发现,混合菌种制备的微生物菌剂能够显著提高五节芒〔Miscanthusfloridulus(Lab.) Warb. ex Schum. et Laut.〕地上部生物量和Pb修复效率。本研究中,微生物菌剂-Pb复合处理组芦竹叶的Pb含量显著高于Pb单一处理组,增幅达141.6%,根、茎和叶的Pb富集系数高于Pb单一处理组,Pb转运系数显著高于Pb单一处理组,说明添加微生物菌剂能够有效增强芦竹对Pb的积累和转运能力,从而提高芦竹对Pb污染土壤的修复能力。
综上所述,微生物菌剂能够显著促进Pb胁迫下芦竹的生长,提高芦竹的Pb积累和转运能力,增强芦竹对Pb污染土壤的修复能力。因此,ETS微生物菌剂作为一种商业微生物菌剂,经济效益明显,有望成为重金属污染土壤植物修复领域具有大规模应用前景的候选菌剂。

