应用多成分定量结合化学计量学分析评价不同陈化时长椪柑陈皮质量
张慧静,陆胜民,朱卫东,王佳俊,王阳光,*
(1.浙江海洋大学食品与药学学院,浙江舟山 316022;2.浙江省农业科学院食品科学研究所,浙江杭州 310021;3.衢州市农业林业科学研究院,浙江衢州 324000)
柑橘为世界第一大栽培水果作物,在世界各地均有种植,目前全球年产量超亿吨[1],其中约有30%可通过加工成果汁、果冻、果酱等形式进入消费者视野[2]。但在柑橘果实的消费和加工过程中易产生大量废弃物,如果皮、果渣、籽等,其中果皮废弃物占鲜果质量比重最大,部分可作为动物饲料处理,而大部分情况下被直接丢弃,对环境质量和经济发展造成了一定程度的损失。
我国是柑橘的原产地之一,品种丰富,历史悠久,栽培规模庞大。大量柑橘果皮中含有丰富的活性物质,如黄酮类、生物碱类、柠檬苦素类、精油、膳食纤维[3]等,具有具有抗氧化[4-6]、抗癌[7]、抗病毒[8]、抗炎[9],治疗心血管疾病[10-11]、脾虚[12]、调节胃肠道疾病[13]等生物或药理活性,在生物医药、食品保鲜和功能产品开发利用等领域具有广阔的发展前景。传统中医认为,采收新鲜成熟的柑橘并将果皮经过干燥加工后可制成陈皮,其具有理气健脾、燥湿化痰等功效,但质量受到品种、加工条件、贮藏方法等条件的影响[14-15]。世人多认为陈皮有“陈久者良”的特性,现有研究发现,随着贮藏时间的变化,陈皮中含有的活性物质,如黄酮类、挥发性油类等成分表现出一定差异[16-20],是导致该特性发生的内因。
椪柑(Citrus reticulataBlanco cv,Ponkan)是我国长期主栽的宽皮柑橘品种之一,主要分布在广东、浙江、福建等地[21]。目前有学者对椪柑陈皮中黄酮类成分进行了含量测定[15],优化了果胶提取工艺[22],对其挥发性油成分进行了含量测定和分析[23-24],但未见有椪柑陈皮指纹图谱的建立及多成分含量测定结合化学计量学分析方面的报道。本研究以椪柑为研究对象,通过模拟加速陈化试验对新鲜成熟的椪柑果皮进行加速陈化,以探究其中橙皮苷、新橙皮苷、柚皮苷、芸香柚皮苷、3,5,6,7,8,3',4'-七甲氧基黄酮(3,5,6,7,8,3',4'-heptamethoxyflavone,HMF)、5-羟基-6,7,8,3',4'-五甲氧基黄酮(5-hydroxy-6,7,8,3',4'-pentamethoxyflavone,5-HPMF)、桔皮素、川陈皮素等8 种黄酮类成分含量变化情况,通过构建指纹图谱及多成分含量测定,结合化学计量学分析为椪柑陈皮质量控制提供有力的支撑,研究黄酮类成分随陈化时间变化的规律,以期为椪柑陈皮的质量控制及造成不同陈化时长陈皮质量差异性的主要标志物分析提供参考方法,为促进椪柑果皮的高值化利用提供一定的思路。
1 材料与方法
1.1 材料与仪器
成熟椪柑鲜果 于2022 年12 月采自浙江省衢州市;3,5,6,7,8,3',4'-七甲氧基黄酮(HMF)、5-羟基-6,7,8,3',4'-五甲氧基黄酮(5-HPMF)、橙皮苷、新橙皮苷、柚皮苷、芸香柚皮苷、桔皮素、川陈皮素标准品(纯度≥98%) 上海源叶生物科技有限公司;甲醇、乙腈、磷酸 均为色谱纯,德国默克公司。
LC-2030C 3D Plus 高效液相色谱仪 日本SHIMADZU 公司;KQ-500DB 型数控超声波清洗器昆山市超声仪器有限公司;FA2204 型万分之一分析天平 常州市幸运电子设备有限公司;DHG-9146A型电热恒温鼓风干燥箱、DNP-9162 型电热恒温培养箱 上海精宏实验设备有限公司;YD-150 型多功能粉碎机 永康市速锋工贸有限公司。
1.2 实验方法
1.2.1 样品的制备 选择颜色均匀、大小相近、果形完整的新鲜椪柑果实,清洗外表皮,用白色毛巾擦干。利用四分法将果皮剖成大小一致的四片,取出果肉,将新鲜果皮放入热风干燥箱中,以模拟日晒时的温度(30 ℃)干燥至水分含量低于13%。取出后粉碎并过60 目筛,取100 g 粉末置于温度40 ℃、相对湿度80%的恒温培养箱中加速陈化[25],取加速0 d 时的样品记为S1,之后每隔14 d 取样一次,共进行126 d,按取样前后顺序依次记为S2~S10。
1.2.2 高效液相色谱(high performance liquid chromatography,HPLC)测定8 种成分含量
1.2.2.1 标准品溶液的制备 精密称取8 种标准品(HMF、5-HPMF、橙皮苷、新橙皮苷、柚皮苷、芸香柚皮苷、桔皮素、川陈皮素),用甲醇溶解并定容,分别得到对应浓度为1.020、0.425、4.100、2.000、1.200、2.080、1.040、3.260 mg/mL 的标准品贮备液备用。
1.2.2.2 供试品溶液的制备 参考文献[14],精密称取各样品粉末0.2 g,加入20 mL 甲醇溶液并在室温下超声(350 W,40 kHz)处理30 min,静置5~10 min后用甲醇补足缺失的重量,经0.22 μm 有机相微孔滤膜过滤,滤液即为供试品溶液,置于4 ℃保存,待上机检测。
1.2.2.3 HPLC 色谱条件 HPLC 色谱条件[26]:色谱柱:SunFire C18柱(250 mm×4.6 mm i.d.,5 μm);流动相:乙腈(A 相)-0.1%磷酸水溶液(B 相);流速:1.0 mL/min;柱温:25 ℃;进样量:10 μL;检测波长设为:283 nm(橙皮苷、新橙皮苷、柚皮苷、芸香柚皮苷)、310 nm(指纹图谱)、330 nm(川陈皮素、HMF、桔皮素、5-HPMF);梯度洗脱条件:0~15 min,20%A;15~35 min,20%~60% A;35~40 min,60%~100% A;40~42 min,100% A;42~45 min,100~20% A;45~50 min,20% A。
1.2.2.4 方法学考察 线性关系考察:精密吸取“1.2.2.1”项下标准品溶液,使用甲醇稀释成6 个浓度梯度,按“1.2.2.3”项下色谱条件进样分析,其中检测限和定量限分别为信噪比3:1 和10:1 时化合物的浓度。
精密度试验:取三个不同浓度梯度的混合标准品溶液按“1.2.2.3”项下色谱条件重复进样3 次。
稳定性试验:精密称取同一份椪柑陈皮样品粉末,按“1.2.2.2”项下条件制备同一份供试品溶液,按“1.2.2.3”项下色谱条件分别于0、2.5、5、10、15、25 h重复进样3 次。
重复性试验:精密称取同一椪柑陈皮样品粉末6 份,按“1.2.2.2”项下条件制备得到6 份供试品溶液,按“1.2.2.3”项下色谱条件进样。
加样回收率试验:精密称取同一椪柑陈皮样品粉末9 份,其中6 份分别加入一定体积的标准品溶液,另外3 份加入相同体积的甲醇溶液作为空白参照,按“1.2.2.2”项下条件制备得到供试品溶液,按“1.2.2.3”项下色谱条件进样。
1.2.3 HPLC 指纹图谱的建立 将得到的色谱图数据文件导入《中药色谱指纹图谱相似度评价系统(2012 年版)》中,以出峰较好的S7 号样品图谱为参照图谱,时间窗宽度设为 0.1 min,采用多点校正法和色谱峰Mark 峰匹配分析法建立叠加指纹图谱,使用平均数法得到对照指纹图谱。
1.3 数据处理
Origin 2023 软件(美国OriginLab 公司)绘制色谱图;IBM SPSS Statistics 22(美国International Business Machines Corporation 公司)进行方差分析、聚类分析(hierarchical cluster analysis,HCA)和主成分分析(principal component analysis,PCA);SIMCA 14.1(瑞典Umetrics 公司)软件绘制主成分分析可视化图,并进行正交偏最小二乘判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA),计算预测变量重要性投影(variable importance in projection,VIP);以VIP≥1 为条件筛选区分不同陈化时长的差异标志物。
2 结果与分析
2.1 HPLC 方法学考察
2.1.1 线性关系考察 以标准品质量浓度为横坐标(X),各组分峰面积值为纵坐标(Y),得到8 种成分的回归方程和线性范围,线性关系考察结果见表1,决定系数(R2)均>0.9998,8 种化合物检测限和定量限浓度均小于线性范围,表明建立的方法在线性范围内准确、可靠。
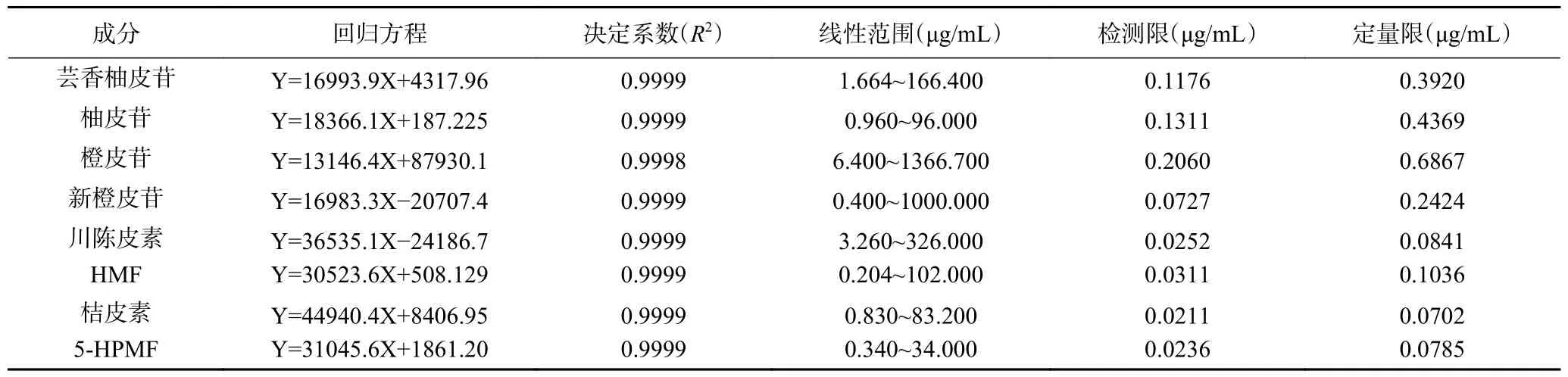
表1 线性关系考察Table 1 Investigation of linear relationship
2.1.2 精密度试验 以峰型对称且响应值较大的川陈皮素色谱峰为参照峰,测得8 种成分的相对保留(出峰)时间的RSD 值均分别小于0.380%、0.129%、0.288%,相对峰面积的RSD 值均分别小于0.138%、0.121%、0.173%,表明实验所用仪器精密度良好,具体见表2。

表2 精密度试验Table 2 Precision of the developed method
2.1.3 稳定性试验 以川陈皮素色谱峰为参照峰,测得8 种成分在4 ℃储藏条件下25 h 内的相对保留(出峰)时间RSD 值均小于0.905%,相对峰面积RSD 值均小于2.790%,表明供试品溶液在25 h 内稳定性良好,具体见表3。
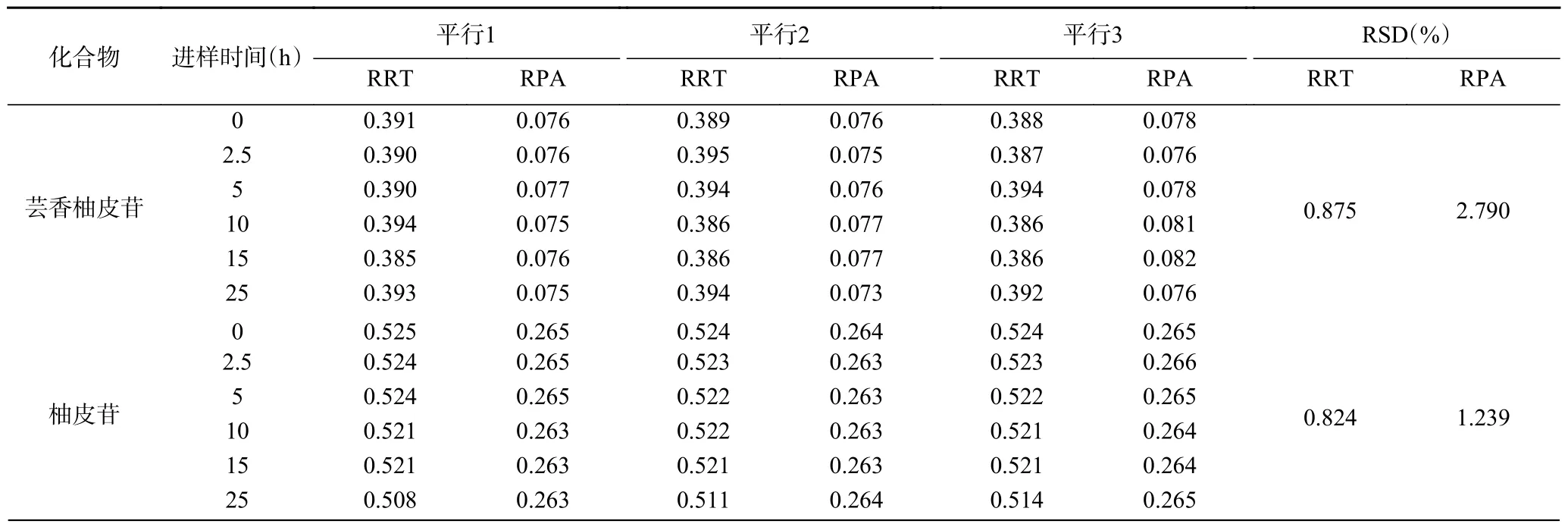
表3 稳定性试验Table 3 Stability of the developed method
2.1.4 重复性试验 以川陈皮素色谱峰为参照峰,测得8 种成分在六份供试品溶液中相对保留(出峰)时间RSD 值均小于0.180%,相对峰面积RSD 值均小于0.976%,表明该分析方法重复性良好,具体见表4。
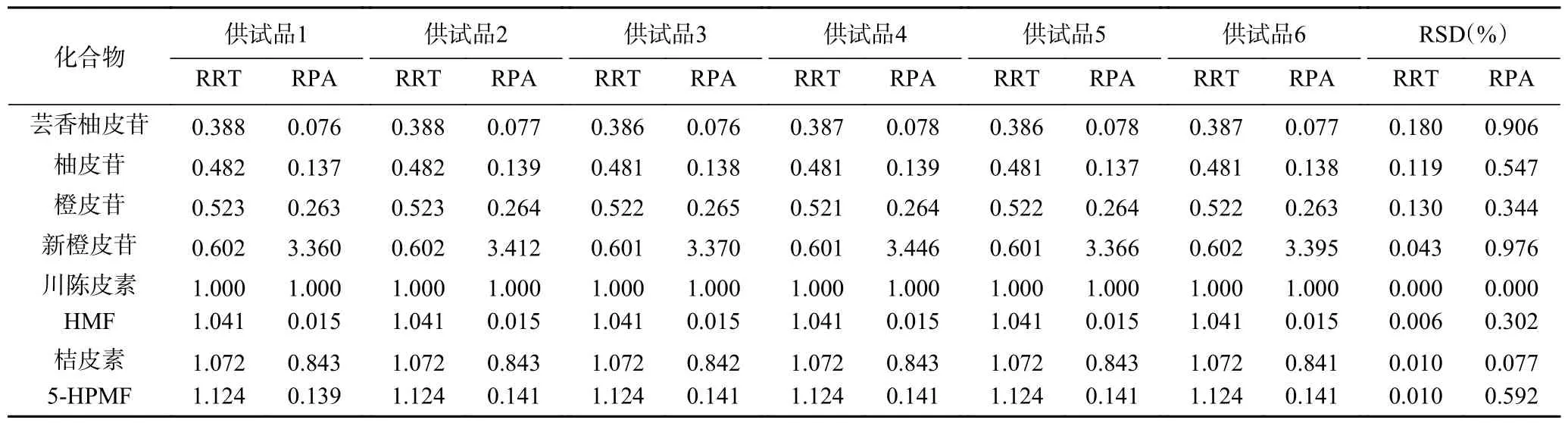
表4 重复性试验Table 4 Repeatability of the developed method
2.1.5 加样回收率试验 对供试品溶液中8 种成分含量进行计算,得到8 种成分的平均加样回收率为99.901%~102.229%,RSD 值为0.472%~2.627%,表明该分析方法准确度高,具体见表5。
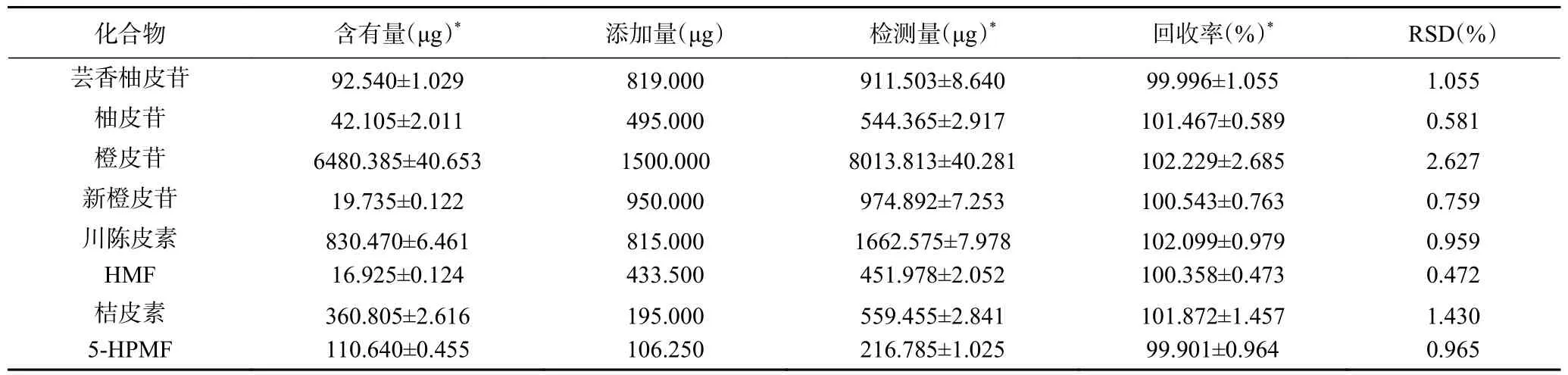
表5 加样回收率试验Table 5 Recovery data of the developed method
2.2 指纹图谱的建立及相似度分析
2.2.1 指纹图谱的建立及共有峰的指认 将得到的10 批次椪柑陈皮数据文件以CDF 文件格式导入《中药色谱指纹图谱相似度评价系统(2012 年版)》中,按“1.2.2”项下条件得到10 批次椪柑陈皮叠加指纹图谱以及对照指纹图谱(R),见图1。
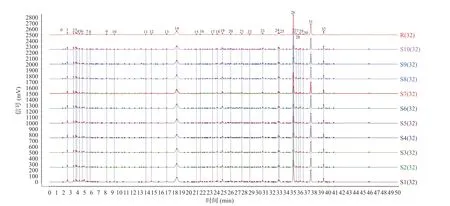
图1 10 批次加速陈化椪柑陈皮叠加指纹图谱和对照指纹图谱(R)Fig.1 HPLC fingerprint chromatograms of 10 batches of Ponkan Chenpi during accelerated aging and reference fingerprint chromatogram (R)
结果显示,10 批椪柑陈皮的色谱图中共匹配出32 个共有峰。通过与混合标准品溶液图谱(图2)对比,指认出其中8 个具有重要药理作用和研究意义的共有峰,依次为芸香柚皮苷(11 号峰)、柚皮苷(13 号峰)、橙皮苷(14 号峰)、新橙皮苷(15 号峰)、川陈皮素(26 号峰)、HMF(30 号峰)、桔皮素(31 号峰)、5-HPMF(32 号峰)。
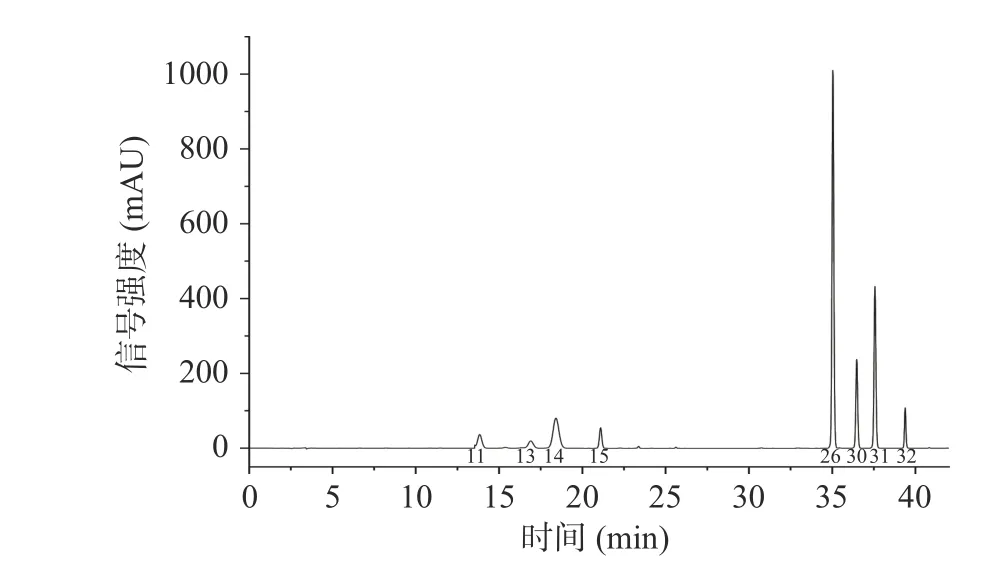
图2 混合标准品色谱图Fig.2 HPLC chromatogram of mixed standard
2.2.2 相似度分析 以生成的对照指纹图谱(R)为参照,对10 批次椪柑陈皮的指纹图谱进行相似度分析,分析结果见表6。10 批次样品相似度均大于0.995,表现出较强的相似性,表明了不同陈化时长得到的椪柑陈皮之间成分组成差异较小,椪柑陈皮整体质量相对稳定,建立的指纹图谱稳定可靠,可用于监测和综合评价椪柑陈皮质量。
2.3 8 种成分含量测定结果
精密称取10 批次椪柑陈皮样品粉末,按条件制备成供试样品溶液并进样检测,计算8 种成分在样品中的含量,结果以百分计(表7)。8 种黄酮类成分含量之间表现出一定的差异性,整体上可按含量大小排序依次为橙皮苷、川陈皮素、桔皮素、5-HPMF、芸香柚皮苷、柚皮苷、新橙皮苷、HMF,其中橙皮苷含量最高,在7.0469%~5.5445%之间波动变化,均大于《中国药典》2020 年版一部中规定的陈皮标准(橙皮苷含量≥3.5%);HMF 含量最低,在0.0132%~0.0171%之间波动变化。
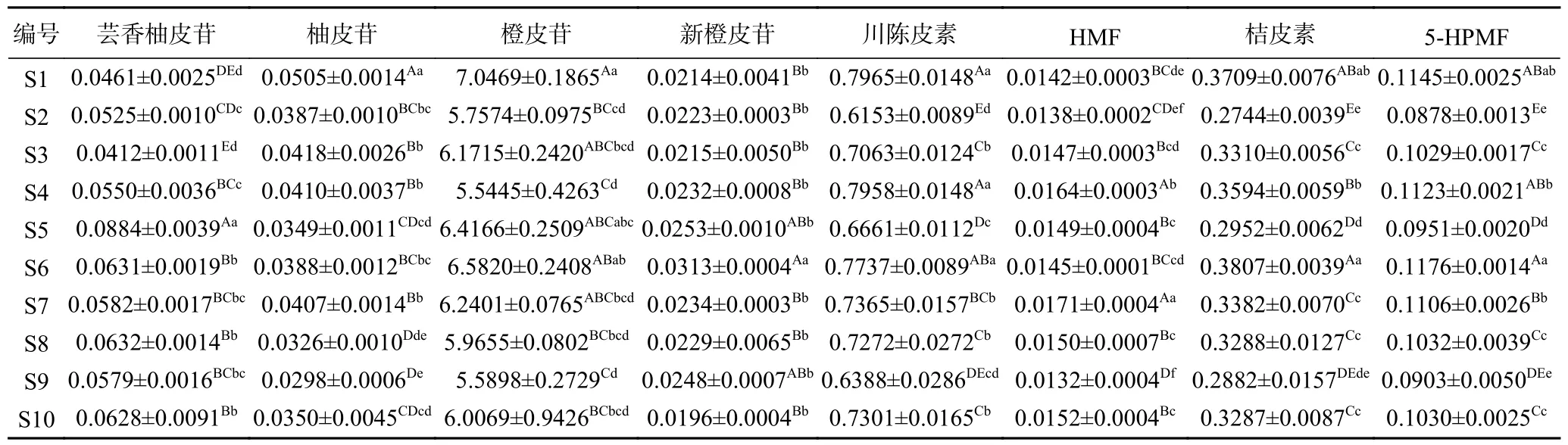
表7 10 批次椪柑陈皮中8 种成分含量(%)Table 7 Content determination of eight components in 10 batches of Ponkan Chenpi during accelerated aging (%)
从表7 可知,8 种黄酮类成分含量变化并非呈线性上升或下降趋势,而是呈波动变化,不同的加速陈化时长对不同成分造成的动态变化情况各不相同。
芸香柚皮苷含量在S1~S5 号样品中呈波动上升趋势,并在S5 号样品(即加速陈化56 d)中最大,在S6~S10 号等5 个样品之间变化不显著,但与S5 号相比呈极显著降低(P<0.01),与S1~S4 号样品相比呈显著上升,这与张鑫等[25]研究结果一致。HMF 含量在S7 号样品(即加速陈化84 d)中最大,且与其他样品差异显著(P<0.05)。与S1 号样品相比,芸香柚皮苷含量在其余样品(除S3 号)中呈显著上升(P<0.05);HMF 含量在S4、S5、S7、S8、S10 号等5 个样品中含量呈显著上升(P<0.05),在S3、S6 号样品中呈不显著上升(P>0.05)。因此芸香柚皮苷、HMF含量在加速陈化的126 d 内总体呈上升趋势,分别在加速陈化的56 d 和84 d 达到最大。
新橙皮苷含量在S6 号样品(即加速陈化70 d)中最大,且与其他样品差异显著(P<0.05),在S1~S5号样品等5 个样品中呈波动上升趋势,在S7~S10 号等4 个样品中呈波动下降趋势。因此新橙皮苷含量在加速陈化的126 d 内总体呈现先上升后下降的趋势,在加速陈化的70 d 达到最大。
柚皮苷含量在10 个样品间呈波动下降趋势,与S1 号样品相比,其余9 个样品均呈极显著性差异(P<0.01),在S9 号样品(即加速陈化112 d)中最小;橙皮苷含量在S4 号样品(即加速陈化42 d)中最小,且与S1、S6 号2 个样品差异极显著(P<0.01)。与S1 号样品相比,橙皮苷含量在S5、S6 号2 个样品中呈不显著下降趋势(P>0.05),在其余样品中呈显著下降(P<0.05)。因此柚皮苷、橙皮苷含量在加速陈化的126 d 内总体呈下降趋势,分别在加速陈化的112和42 d 达到最小。
川陈皮素、桔皮素、5-HPMF 含量均在S2 号样品(即加速陈化14 d)中最小,且与其余样品(除S9 号)差异显著(P<0.05)。与S1 号样品相比,川陈皮素含量在S4、S6 号2 个样品中呈不显著降低趋势(P>0.05),在其余样品中呈极显著下降趋势(P<0.01);桔皮素含量在S4 号样品中呈不显著降低(P>0.05),在其余样品(除S6 号)中呈极显著降低(P<0.01);5-HPMF 含量在S6 号样品中呈不显著升高(P>0.05),在S4、S7 号2 个样品中呈不显著降低(P>0.05),在其余样品中呈极显著下降趋势(P<0.01)。因此川陈皮素、桔皮素、5-HPMF 等三种化合物含量在加速陈化的126 d 内总体呈下降趋势,在加速陈化的14 d达到最小。
综上,在加速陈化的126 d 内,芸香柚皮苷和HMF 两种成分含量总体呈上升趋势,分别在加速陈化的56、84 d 达到最大;新橙皮苷含量呈先上升后下降趋势,在加速陈化的70 d 达到最大;柚皮苷、橙皮苷、川陈皮素、桔皮素、5-HPMF 等五种成分呈下降趋势,其中柚皮苷、橙皮苷含量分别在加速陈化的112、42 d 达到最小,川陈皮素、桔皮素、5-HPMF等三种化合物含量均在加速陈化的14 d 达到最小。
2.4 化学计量学分析
2.4.1 HCA 分析 以10 批次椪柑陈皮样品中8 种成分含量为变量,采用离差平方和法(Ward 法)联结、平方欧式距离为度量标准,对10 批次椪柑陈皮样品进行聚类,得到分析树状图(图3)。由图3 可知,当判别距离为10 时,10 批次椪柑陈皮样品可分为两类,其中S1、S5、S6 号聚为一类,其他样品聚为另一类。这说明不同陈化时间对椪柑陈皮类黄酮成分变化有一定的影响,其中加速陈化56 d、70 d 与陈化0 d 椪柑陈皮成分的变化较为接近,其他陈化时长的椪柑陈皮成分变化较为接近。
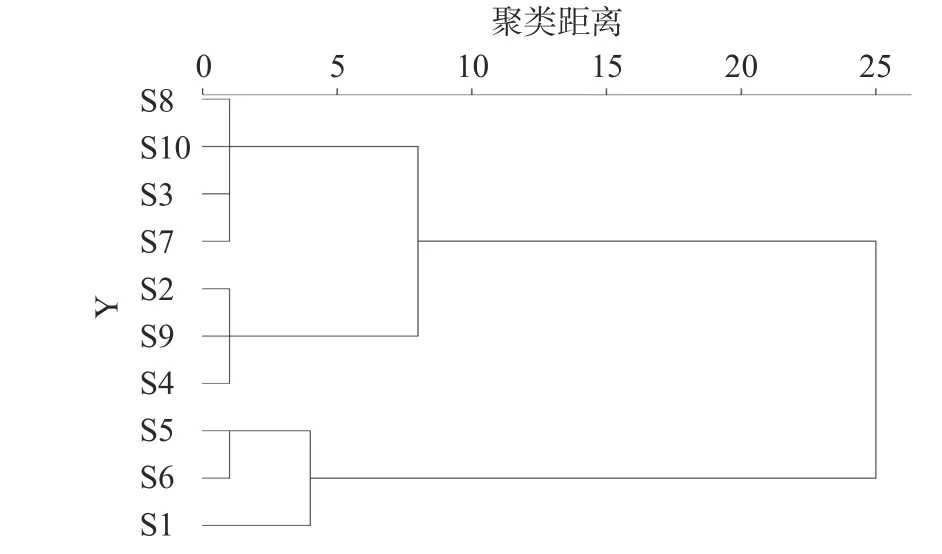
图3 10 批次加速陈化椪柑陈皮聚类分析树状图Fig.3 Hierarchical cluster analysis of 10 batches of Ponkan Chenpi during accelerated aging
2.4.2 PCA 分析 将10 批次批椪柑陈皮8 种成分含量导入SIMCA 14.1 软件中,得到PCA 分析结果图(图4)。共得到3 个主成分,累计Rx2=0.857,表明建立的主成分分析模型拟合度较好。由得分矩阵图可知,所有数据点均在95%置信区间内,不同加速陈化时长的椪柑陈皮样品区分明显,其中S1、S5、S6 号样品与聚集中心的偏离程度较高,这与聚类分析的结果一致。
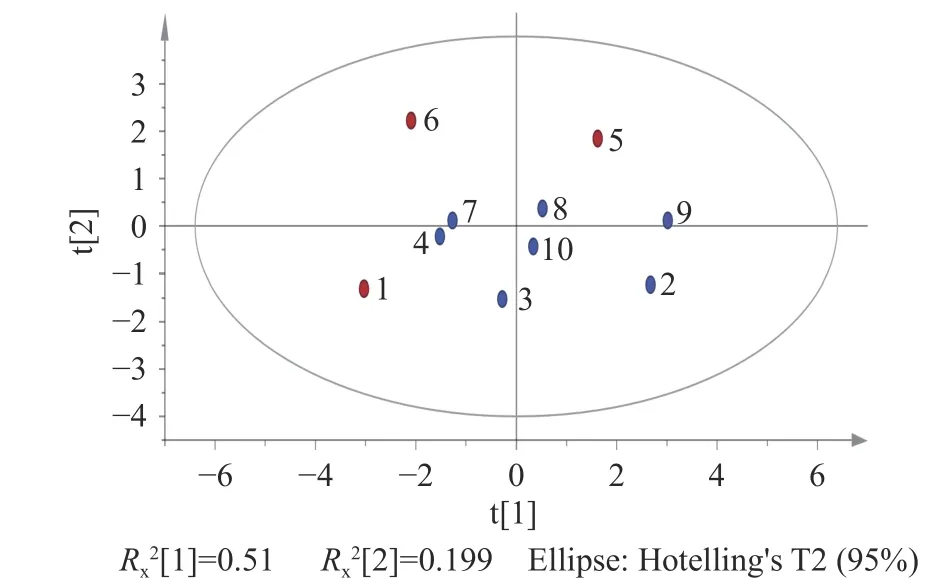
图4 10 批次加速陈化椪柑陈皮主成分得分图Fig.4 Principal component scores of 10 batches of Ponkan Chenpi during accelerated aging
将8 种成分含量导入至IBM SPSS Statistics 22 软件中,结果提取得到3 个特征值大于1 的主成分,主成分的特征值及其方差贡献率见表8。前3 个主成分累积贡献率为85.740%(>85%),说明提取的3 个主成分可代表10 批次椪柑陈皮的大部分信息。其中5-HPMF、桔皮素、川陈皮素、柚皮苷和橙皮苷在主成分1 上有较高的载荷;新橙皮苷、芸香柚皮苷在主成分2 上有较高的载荷,而HMF 在主成分3 上有较高的载荷,具体见表9。载荷的绝对值越大,表明因子对主成分的贡献越明显,对区分样品的影响越大,这表明以上成分是造成不同陈化时长椪柑陈皮成分含量变化差异性的主要成分。
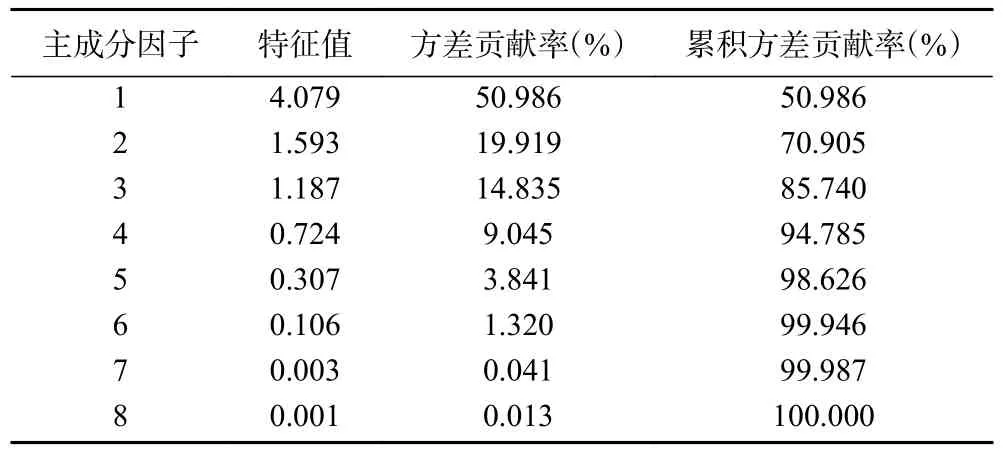
表8 主成分特征值及方差贡献率Table 8 Eigenvalues and variance contribution
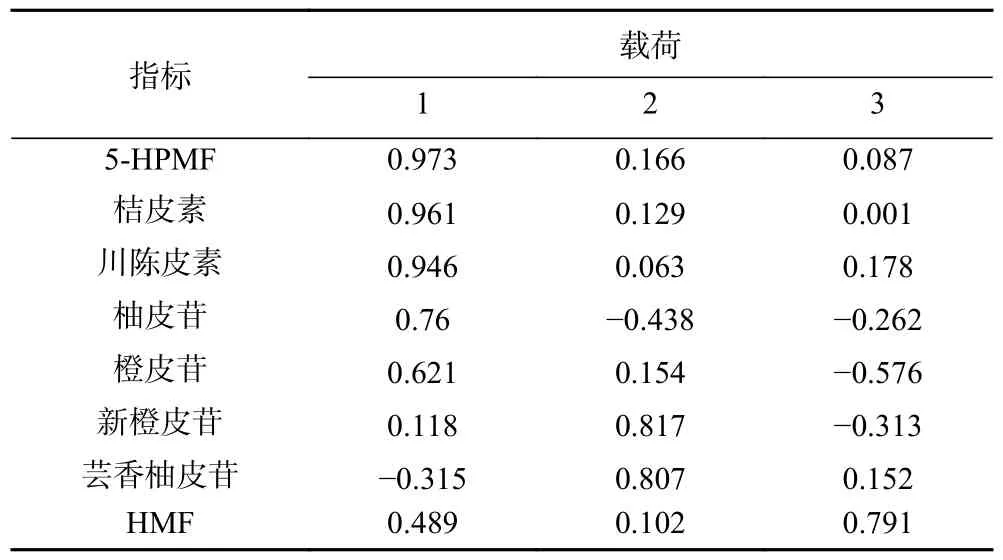
表9 因子载荷矩阵Table 9 Component matrix
2.4.3 OPLS-DA 分析 为更好地体现不同陈化时长的10 批次椪柑陈皮样品间差异性,进一步做了有监督模式的正交偏最小二乘判别分析识别[27],并筛选出对组间差异贡献率较大的成分。以10 批次椪柑陈皮8 种主要成分含量为变量将其导入SIMCA 14.1软件,进行OPLS-DA 建模分析,通过自动拟合建立模型,得分图如图5 所示。从图5 可以看出,S1、S5、S6 号样品与其他样品之间区分明显。本次分析汇总的自变量拟合指数(Rx2)为0.674,因变量拟合指数(Ry2)为0.922、模型预测指数(Q2)为0.508,R2和Q2均大于0.5,表明本次模型拟合结果可接受。
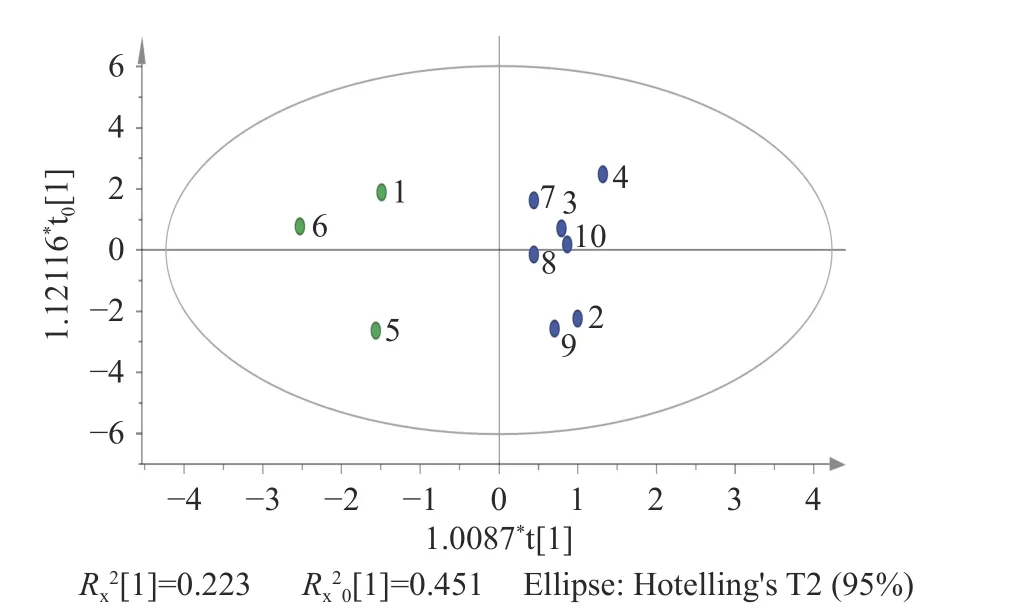
图5 10 批次加速陈化椪柑陈皮OPLS-DA 得分图Fig.5 OPLS-DA scores of 10 batches of Ponkan Chenpi during accelerated aging
变量重要性投影(Variable Importance in Projection,VIP)值是筛选差异性化合物的重要指标,其数值越大,对组间差异的影响越大。通过对VIP 值进行分析,得到差异性标志物的VIP 得分图(图6)。以VIP 值≥1 为筛选标准,得到4 个差异性化合物并根据VIP 值大小依次排序为橙皮苷、新橙皮苷、5-HPMF、桔皮素,表明这4 种成分对不同陈化时长的椪柑陈皮质量产生的影响最大,是区分不同陈化时长椪柑陈皮差异性的主要标志物。
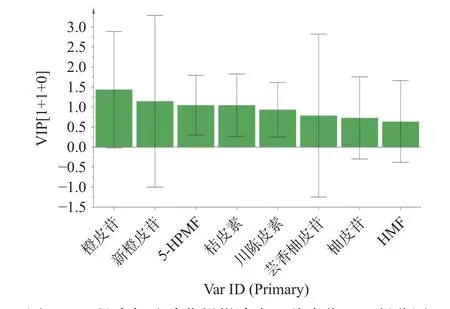
图6 10 批次加速陈化椪柑陈皮8 种成分VIP 得分图Fig.6 VIP scores for 8 components of 10 batches of Ponkan Chenpi during accelerated aging
3 讨论与结论
在陈皮贮藏陈化的过程中,黄酮类等成分含量发生了相应的变化,部分学者认为橙皮苷、川陈皮素、桔皮素、HMF、5-HPMF 五种成分通常随陈化时间的延长呈上升趋势[28],但研究也发现当橙皮苷含量下降时,桔皮素含量反而升高[29],同时有研究表明部分成分含量随陈化时长的变化呈波动变化[30]。本研究中,8 种黄酮类成分中柚皮苷、橙皮苷、川陈皮素、桔皮素、5-HPMF 等五种成分含量在陈化阶段呈下降趋势,而芸香柚皮苷、HMF 两种成分含量在呈上升趋势,新橙皮苷含量呈先上升后下降的趋势,这与部分学者的研究结果一致。研究表明能够有效水解橙皮苷、柚皮苷、新橙皮苷等黄酮类化合物的α-L-鼠李糖苷酶在30~60 ℃具有较高的酶活[31],该酶可通过柚皮苷[32]、橙皮苷[33]等物质诱导微生物产生。本研究设置的加速陈化温度为40 ℃,因此推测在长期陈化的过程中,α-L-鼠李糖苷酶诱导产生的微生物、酶自身活性和含量发生变化等因素导致了橙皮苷、柚皮苷、新橙皮苷含量降低。同时研究发现通过接种从陈皮中分离纯化得到的黑曲霉能够使陈皮中川陈皮素、桔皮素等成分含量上升[34-35],而川陈皮素、桔皮素、5-HPMF、HMF 均属于多甲氧基黄酮[36]。在本研究中HMF 含量升高,川陈皮素、桔皮素、5-HPMF 含量下降,推测在陈化过程中湿度、温度等环境因素对黑曲霉产酶种类及活性也产生了一定影响,从而使得HMF 含量升高,而川陈皮素、桔皮素、5-HPMF 含量下降,但具体是何种条件通过何种途径对何种酶产生的影响尚不明确。香石竹中含有的糖基转移酶可以利用活化的UDP-葡萄糖使柚皮素向芸香柚皮苷进行转化[37],柑橘类植物中同样含有黄烷酮-7-O-葡萄糖基转移酶,可促进黄烷酮-7-O-葡萄糖苷类化合物生物合成[38-39],据此可推测在椪柑陈皮中可能含有糖基转移酶,能够促进柚皮素等其他黄酮类成分向芸香柚皮苷进行转化,从而使得芸香柚皮苷含量升高。
通过聚类分析将10 批次椪柑陈皮样品分为两类,其中加速陈化56 d、70 d 与陈化0 d 的样品聚为一类,其他加速时长的样品聚为另一类,聚类结果并非按照陈化时长依次进行聚类。这与李晓芳等[40]对贮藏1~10 年的广陈皮聚类分析结果一致,无论是广陈皮或是椪柑陈皮,陈化时长是造成陈皮成分及质量发生变化的影响因素之一。现有研究表明在陈化过程中,微生物群落的代谢转化使得陈皮中含有的化学成分发生一定的变化[41],而不同陈化时长、条件导致了陈皮样品中优势菌属表现出差异性[42-44],由此可推测不同品种陈皮优势菌同样是造成陈皮成分及质量发生变化的因素之一。通过主成分分析和正交偏最小二乘判别分析,对区分10 批次椪柑陈皮陈化时长差异性的主要标志物进行筛选,发现橙皮苷、新橙皮苷、5-HPMF 和桔皮素等4 种成分是区分不同陈化时长椪柑陈皮的主要标志物。
本研究对不同陈化时长的椪柑陈皮进行指纹图谱和化学计量学分析,建立了椪柑陈皮指纹图谱,10 批次椪柑陈皮共标定出32 个共有峰,指纹图谱相似度大于0.995,表明不同陈化时长下的椪柑陈皮质量相对稳定;建立了准确度性高、操作简单、稳定性好的柚皮苷、橙皮苷、新橙皮苷、川陈皮素、桔皮素、5-HPMF、芸香柚皮苷、HMF 等8 种黄酮类成分含量测定方法,结果显示不同黄酮类成分含量在加速陈化的126 d 内呈现出不同的变化趋势,芸香柚皮苷和HMF 两种成分含量呈上升趋势,新橙皮苷呈先上升后下降趋势,柚皮苷、橙皮苷、川陈皮素、桔皮素、5-HPMF 等五种成分呈下降趋势。
通过HCA 分析可将10 批次椪柑陈皮样品分为两类,加速陈化0、56、70 d 的三批次样品聚为一类,其他批次样品聚为一类;PCA 分析共提取出三个主成分,累积方差贡献率为85.740%,可解释10 批次椪柑陈皮样品大部分信息;OPLS-DA 分析确定了橙皮苷、新橙皮苷、5-HPMF 及桔皮素等四种成分是区分不同陈化时长椪柑陈皮的差异性标志物。另外分析结果表明多成分定量结合化学计量学分析方法适用于不同陈化时长椪柑陈皮的指纹图谱研究和多成分含量测定,可为椪柑陈皮的陈化时长、贮藏条件等研究提供参考,为椪柑果皮资源的开发与利用提供理论参考。此外,本实验在陈化时长设置、样品基源批次以及检测手段方面具有一定的局限,8 种黄酮类成分含量变化结果并不能得出“陈久者良”的结论,而且部分成分未得到有效指认,因此上述成分的变化情况与“陈久者良”之间的相关性需要结合其他检测手段对陈皮中挥发性油成分和含量变化、微生物群落分布情况等作进一步分析验证。

