川陈皮素防治肝缺血再灌注损伤的作用机制研究
杨超君,王跃武,周开珩
川陈皮素防治肝缺血再灌注损伤的作用机制研究
杨超君,王跃武,周开珩
宁波市医疗中心李惠利医院 药剂科,浙江 宁波 315000
探究川陈皮素防治肝缺血再灌注损伤(hepatic ischemia reperfusion injury,HIRI)的作用及机制。SD大鼠随机分为对照组、模型组和川陈皮素(10 mg/kg)组,采用ELISA法检测各组大鼠血清中丙氨酸转氨酶(alanine aminotransferase,ALT)和天冬氨酸转氨酶(aspartate aminotransferase,AST)活性;采用苏木素-伊红(HE)染色法考察各组大鼠肝组织病理变化;采用透射电子显微镜(TEM)观察各组大鼠肝细胞线粒体结构;采用Western blotting和qRT-PCR考察各组大鼠肝组织自噬相关蛋白Beclin1、微管相关蛋白1轻链3-II(microtubule associated protein 1 light chain 3-II,LC3-II)、自噬相关基因-7(autophagy-related gene-7,ATG-7)、p62蛋白和mRNA表达情况。采用H2O2诱导大鼠肝细胞BRL建立氧化损伤细胞模型,设置对照组、模型组和川陈皮素(10 μmol/L)组,采用Western blotting和qRT-PCR考察各组细胞Beclin1、LC3-II、ATG-7、p62蛋白和mRNA表达情况;采用MitoTracker染色和免疫荧光法考察各组细胞自噬蛋白与线粒体的共定位情况;考察自噬抑制剂和诱导剂对川陈皮素细胞保护作用的影响。与对照组比较,模型组大鼠血清ALT和AST活性均显著升高(<0.05),肝组织病变,肝细胞线粒体数目增加,结构错乱,受损的线粒体被吞噬,肝组织中LC3-II、Beclin1、ATG-7蛋白和mRNA表达水平显著升高(<0.05),p62蛋白和mRNA表达水平显著降低(<0.05);与模型组比较,川陈皮素组大鼠血清ALT和AST活性明显降低(<0.05),肝组织病变程度减轻,线粒体形态变化得到明显改善,肝组织中LC3-II、Beclin1、ATG-7蛋白和mRNA表达水平显著降低(<0.05),p62蛋白和mRNA表达水平显著升高(<0.05)。氧化损伤细胞模型中BRL细胞LC3-II、Beclin1、ATG-7蛋白和mRNA表达水平显著升高(<0.05),p62蛋白和mRNA表达水平显著降低(<0.05),Beclin1和MitoTracker的共定位数目增加;与模型组比较,川陈皮素组BRL细胞中LC3-II、Beclin1、ATG-7蛋白和mRNA表达水平显著降低(<0.05),p62蛋白和mRNA表达水平显著升高(<0.05),Beclin1和MitoTracker的共定位数目减少;自噬抑制剂3-MA(1、5 mmol/L)显著增强川陈皮素对BRL细胞的保护作用(<0.05),自噬诱导剂雷帕霉素显著抑制川陈皮素对BRL细胞Beclin1蛋白和mRNA表达水平的下调作用(<0.05)。川陈皮素对HIRI具有较好的防治作用,其机制可能与抑制线粒体自噬有关。
川陈皮素;线粒体;自噬;肝脏;缺血再灌注损伤
肝损伤、失血性休克、肝移植术、肝切除术等情况下会发生肝缺血再灌注损伤(hepatic ischemia reperfusion injury,HIRI),导致肝脏甚至多器官衰竭,造成肝脏手术围手术期的死亡率上升[1-2]。尽管目前已有药物防治HIRI的相关报道[3-5],但目前尚无公认有效的治疗方法。HIRI过程中,活性氧(reactive oxygen species,ROS)水平升高,内源性抗氧化剂大量消耗,导致其对肝细胞的保护作用减弱。线粒体是ROS的主要来源,极易受到氧化损伤的影响[6]。线粒体自噬是氧化应激损伤的线粒体被溶酶体吞噬的过程,微管相关蛋白1轻链3-II(microtubule associated protein 1 light chain 3-II,LC3-II)、Beclin1、自噬相关基因-7(autophagy- related gene-7,ATG-7)和p62的表达水平与线粒体自噬过程密切相关[7-12]。线粒体可以抑制氧化应激等过程,从而保护HIRI[13-16]。川陈皮素是柑橘皮中一种常见的多甲氧基黄酮,具有抗氧化、抗炎等作用,常用于治疗哮喘、结肠炎、阿尔茨海默病、缺血性脑卒中等疾病[17]。川陈皮素能够保护心肌缺血再灌注、脓毒症小鼠肝损伤[18-19]。本研究通过体内、外实验,探究川陈皮素防治HIRI的作用机制及其对线粒体功能的影响。
1 材料
1.1 动物
SPF级雄性SD大鼠30只,6~8周龄,体质量200~220 g,购自北京维通利华实验动物技术有限公司,动物许可证号SYXK(京)2017-0033。动物于无特殊病原体环境中适应性饲养1周,温度25~27 ℃,湿度45%~50%,自由进食饮水。动物实验经温州医科大学动物伦理委员会批准(批准号wydw2019-0561)。
1.2 细胞
大鼠肝细胞BRL购自中国科学院细胞库。
1.3 药品与试剂
川陈皮素(质量分数>98%,批号182001)购自上海同田生物科技股份有限公司;DAPI(批号183212412)购自梯希爱(上海)化成工业发展有限公司;丙氨酸转氨酶(alanine aminotransferase,ALT)试剂盒(批号A171301B)购自上海一研生物科技有限公司;天冬氨酸转氨酶(aspartate aminotransferase,AST)试剂盒(批号KT17019TO)购自上海哈灵生物科技有限公司;TRIzol试剂(批号17596-026)、MitoTracker Red CMXRos试剂盒(批号1583080)、LC3-II抗体(批号VB2934447)、Beclin1抗体(批号RE2205142)、ATG-7抗体(批号VB2947563)、p62抗体(批号UA2708368C)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(批号QB216541)、FITC标记的山羊抗大鼠IgG抗体(批号1825822)购自美国Thermo Fisher Scientific公司;3-甲基腺嘌呤(3-methyladenine,3-MA)、雷帕霉素购自美国Sigma-Aldrich公司;10%中性福尔马林缓冲溶液(批号180382)、无水乙醇(批号180613)购自成都科龙化工试剂有限公司;二甲苯(批号1861634)、2.5%戊二醛(批号1784161)、多聚甲醛(批号1853827)、PBS缓冲液(批号00915270)购自青岛捷世康生物科技有限公司。
1.4 仪器
分光光度计(郑州宏朗仪器设备有限公司);酶标仪、显微镜(美国Thermo Fisher Scientific公司);透射电子显微镜(TEM,日本电子株式会社);荧光显微镜(日本Olympus有限公司)。
2 方法
2.1 动物模型制备、分组与给药
根据前期研究[20],SD大鼠随机分为对照组、模型组和川陈皮素(10 mg/kg)组,每组10只。大鼠禁食12 h,自由饮水,模型组和川陈皮素组大鼠ip氯胺酮(25 mg/kg)麻醉,打开腹腔,充分暴露肝门,用非创伤性血管钳夹闭肝蒂的左、中支,当肝脏颜色从鲜红色变为深紫色时,缺血45 min,然后取下夹子进行肝脏血液再灌注;对照组大鼠仅打开腹腔,暴露肝门。川陈皮素溶于含0.5%聚山梨酯80的生理盐水中,配制成质量浓度为10 mg/mL的溶液,造模前30 min川陈皮素组ip川陈皮素,对照组和模型组ip等体积含0.5%聚山梨酯80的生理盐水。HIRI 6 h后肝功能发生明显损害[21],大鼠脱颈椎处死,取血和肝组织。
2.2 川陈皮素对HIRI大鼠血清中ALT和AST活性的影响
收集各组大鼠下腔静脉血液,室温静置1 h,1000×离心15 min,分离血清,按照试剂盒说明书测定大鼠血清中ALT和AST活性。
2.3 川陈皮素对HIRI大鼠肝组织病理变化的影响
取各组大鼠肝组织,于10%中性福尔马林缓冲溶液固定48 h,乙醇脱水、二甲苯透明、石蜡包埋后切片(厚5 μm),进行苏木素-伊红(HE)染色,于显微镜下观察并拍照。
2.4 川陈皮素对HIRI大鼠肝细胞线粒体结构的影响
取各组大鼠肝组织,于含2.5%戊二醛的PBS溶液中固定2 h,于1%四氧化锇中固定1 h,环氧树脂包埋后切片(厚100 nm),于TEM观察样品的超微结构。
2.5 川陈皮素对HIRI大鼠肝组织Beclin1、LC3-II、ATG-7和p62蛋白表达的影响
各组大鼠肝组织加入含蛋白酶抑制剂的RIPA裂解液,于冰上裂解,4 ℃、12 000×离心15 min,吸取上清液,采用BCA蛋白定量试剂盒测定蛋白质量浓度。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,封闭后,分别加入LC3-II抗体(1∶500)、Beclin1抗体(1∶500)、ATG-7(1∶200)抗体、p62抗体(1∶500)和GAPDH抗体(1∶1000),4 ℃孵育过夜;洗涤后加入FITC标记的山羊抗大鼠IgG抗体,孵育后洗涤,加入发光液显影,采用Image J软件分析图像。
2.6 川陈皮素对HIRI大鼠肝组织Beclin1、LC3-II、ATG-7和p62 mRNA表达的影响
按照试剂盒说明书提取各组大鼠肝组织总RNA并合成cDNA,进行qRT-PCR分析。引物序列:上游引物5’-GATGTCCGACTTATTCG- AGAGC-3’,下游引物5’-TTGAGCTGTAAGCGC- CTTCTA-3’;上游引物5’-CTGGACACG- AGTTTCAAGATCCT-3’,下游引物5’-TCGCCTG- GGCTGTGGTA-3’;上游引物5’-TGCTATC- CTGCCCTCTGTCTT-3’,下游引物5’-TGCCTC- CTTTCTGGTTCTTTT-3’;上游引物5’-ACCC- ATCCACAGGTGAACTC-3’,下游引物5’-GTGG- GAGATGTGGGTACAGG-3’;上游引物5’-TGAGACCTTCAACACCCCAG-3’,下游引物5’-GCCATCTCTTGCTCGAAGTC-3’。
2.7 细胞培养
BRL细胞用含10%胎牛血清的DMEM培养基,于37 ℃、5% CO2的培养箱中培养。
2.8 川陈皮素对BRL细胞Beclin1、LC3-II、ATG-7和p62蛋白表达的影响
取处于对数生长期的BRL细胞,以2×105/mL接种于6孔板中,培养12 h。设置对照组、模型组和川陈皮素(10 μmol/L)组[22]。模型组和川陈皮素组加入H2O2(200 µmol/L)处理18 h,建立氧化损伤细胞模型,川陈皮素组在加入H2O2前加入川陈皮素预处理2 h,对照组加入不含药物的培养基。按“2.5”项下方法检测BRL细胞Beclin1、LC3-II、ATG-7和p62蛋白表达情况。
2.9 川陈皮素对BRL细胞Beclin1、LC3-II、ATG-7和p62 mRNA表达的影响
按“2.8”项下处理细胞,按“2.6”项下方法检测BRL细胞、、和mRNA表达情况。
2.10 川陈皮素对BRL细胞自噬蛋白与线粒体的共定位的影响
按“2.8”项下处理细胞,收集细胞,于5%多聚甲醛固定15 min,制备冷冻切片(厚10 µm),PBS溶液洗涤。加入1%山羊血清,室温封闭30 min,使内源过氧化物酶失活;加入Beclin1抗体(1∶200),4 ℃孵育过夜,PBS溶液洗涤3次,加入FITC标记的山羊抗大鼠IgG抗体(1∶150),室温孵育60 min,PBS溶液洗涤3次;加入DAPI(1 mg/mL)染色细胞核,按照MitoTracker Red CMXRos试剂盒说明书染色线粒体,于荧光显微镜下观察并拍照。
2.11 自噬抑制剂对BRL细胞活性的影响
取处于对数生长期的BRL细胞,以2×105/mL接种于96孔板中,培养12 h。设置对照组、模型组、川陈皮素(10 μmol/L)组和川陈皮素(10 μmol/L)联合自噬抑制剂3-MA(1、5、10 mmol/L)组。模型组、川陈皮素组和川陈皮素联合3-MA组加入H2O2(200 µmol/L)处理18 h,建立氧化损伤细胞模型,川陈皮素组和川陈皮素联合3-MA组在加入H2O2前加入相应药物预处理2 h,对照组加入不含药物的培养基。加入100 µL CCK-8溶液,孵育1 h,采用酶标仪测定450 nm处的吸光度()值。
2.12 自噬诱导剂对BRL细胞Beclin1蛋白和mRNA表达的影响
取处于对数生长期的BRL细胞,以2×105/mL接种于6孔板中,培养12 h。设置对照组、模型组、川陈皮素(10 μmol/L)组和川陈皮素(10 μmol/L)联合自噬诱导剂雷帕霉素(10 nmol/L)组,按“2.11”项下方法处理细胞。按“2.5”和“2.6”项下方法检测BRL细胞Beclin1蛋白和mRNA表达。
2.13 统计分析
3 结果
3.1 川陈皮素对HIRI大鼠血清中ALT和AST活性的影响
如表1所示,与对照组比较,模型组大鼠血清中ALT和AST活性均显著升高(<0.05);与模型组比较,川陈皮素组大鼠血清中ALT和AST活性明显降低(<0.05)。
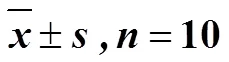
表1 川陈皮素对HIRI大鼠血清中ALT和AST活性的影响()
与对照组比较:#<0.05;与模型组比较:*<0.05
#< 0.05control group;*< 0.05model group
3.2 川陈皮素对HIRI大鼠肝组织病理变化的影响
如图1所示,对照组大鼠肝组织形态正常,模型组大鼠肝细胞水样变性和大片状点状坏死,有出血灶;川陈皮素组大鼠肝组织结构发生轻度改变。
3.3 川陈皮素对HIRI大鼠肝细胞线粒体结构的影响
如图2所示,对照组大鼠肝细胞线粒体均匀分布在细胞质中,结构排列合理;模型组大鼠肝细胞线粒体数目增加,集中分布在细胞核周围,且十字型结构发生错乱,受损的线粒体被吞噬;川陈皮素组大鼠线粒体形态变化得到明显改善。

箭头表示有出血灶

箭头表示有受损的线粒体被吞噬
3.4 川陈皮素对HIRI大鼠肝组织Beclin1、LC3-II、ATG-7、p62蛋白和mRNA表达的影响
如图3、4所示,与对照组比较,模型组大鼠肝组织中LC3-II、Beclin1、ATG-7蛋白和mRNA表达水平显著升高(<0.05),p62蛋白和mRNA表达水平显著降低(<0.05);与模型组比较,川陈皮素组大鼠肝组织中LC3-II、Beclin1、ATG-7蛋白和mRNA表达水平显著降低(<0.05),p62蛋白和mRNA表达水平显著升高(<0.05)。
3.5 川陈皮素对BRL细胞Beclin1、LC3-II、ATG-7、p62蛋白和mRNA表达的影响
如图5、6所示,与对照组比较,模型组BRL细胞中LC3-II、Beclin1、ATG-7蛋白和mRNA表达水平显著升高(<0.05),p62蛋白和mRNA表达水平显著降低(<0.05);与模型组比较,川陈皮素组BRL细胞中LC3-II、Beclin1、ATG-7蛋白和mRNA表达水平显著降低(<0.05),p62蛋白和mRNA表达水平显著升高(<0.05)。

与对照组比较:#P<0.05;与模型组比较:*P<0.05,下图同

图4 川陈皮素对HIRI大鼠肝组织Beclin1 (A)、LC3-II(B)、ATG-7 (C) 和p62 (D)mRNA表达的影响 ()

图5 川陈皮素对BRL细胞Beclin1 (A)、LC3-II(B)、ATG-7 (C) 和p62 (D)蛋白表达的影响 ()
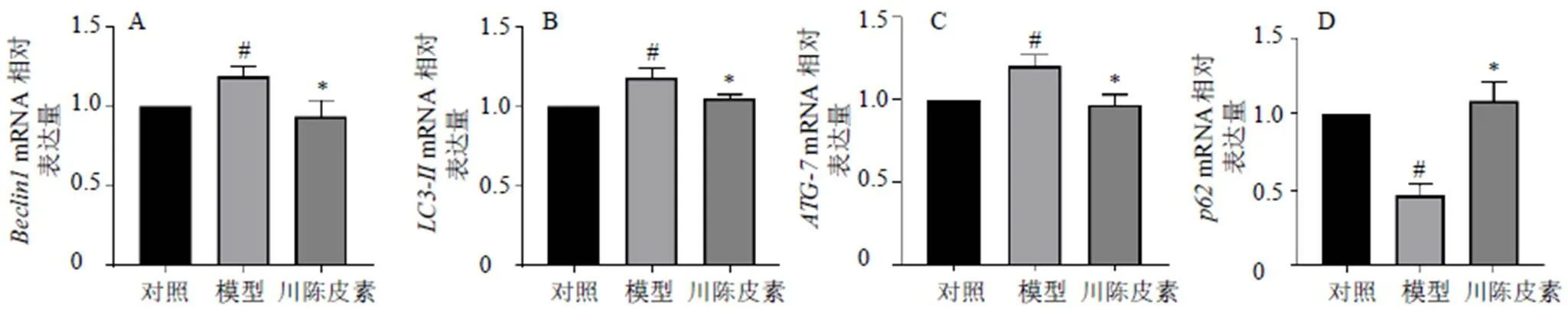
图6 川陈皮素对BRL细胞Beclin1 (A)、LC3-II(B)、ATG-7 (C) 和p62 (D)mRNA表达的影响 ()
3.6 川陈皮素对BRL细胞自噬蛋白与线粒体的共定位的影响
如图7所示,模型组BRL细胞中Beclin1和MitoTracker的共定位数目增加,川陈皮素组BRL细胞中Beclin1和MitoTracker的共定位数目降低,表明川陈皮素可以减少自噬蛋白与线粒体的共定位,川陈皮素可以通过抑制线粒体自噬减轻HIRI。
3.7 自噬抑制剂和诱导剂对川陈皮素细胞保护作用的影响
如图8所示,与对照组比较,模型组BRL细胞活力显著降低(<0.05);与模型组比较,川陈皮素组、川陈皮素联合自噬抑制剂3-MA(1、5 mmol/L)组BRL细胞活力显著升高(<0.05)。
如图9所示,与对照组比较,模型组BRL细胞Beclin1蛋白和mRNA表达水平均显著升高(<0.05);与模型组比较,川陈皮素组BRL细胞Beclin1蛋白和mRNA表达水平均显著降低(<0.05),川陈皮素联合自噬诱导剂雷帕霉素组BRL细胞Beclin1蛋白和mRNA表达水平无明显变化,表明雷帕霉素能够抑制川陈皮素对BRL细胞氧化损伤的改善作用,川陈皮素可能通过调控线粒体自噬过程,从而保护肝细胞。
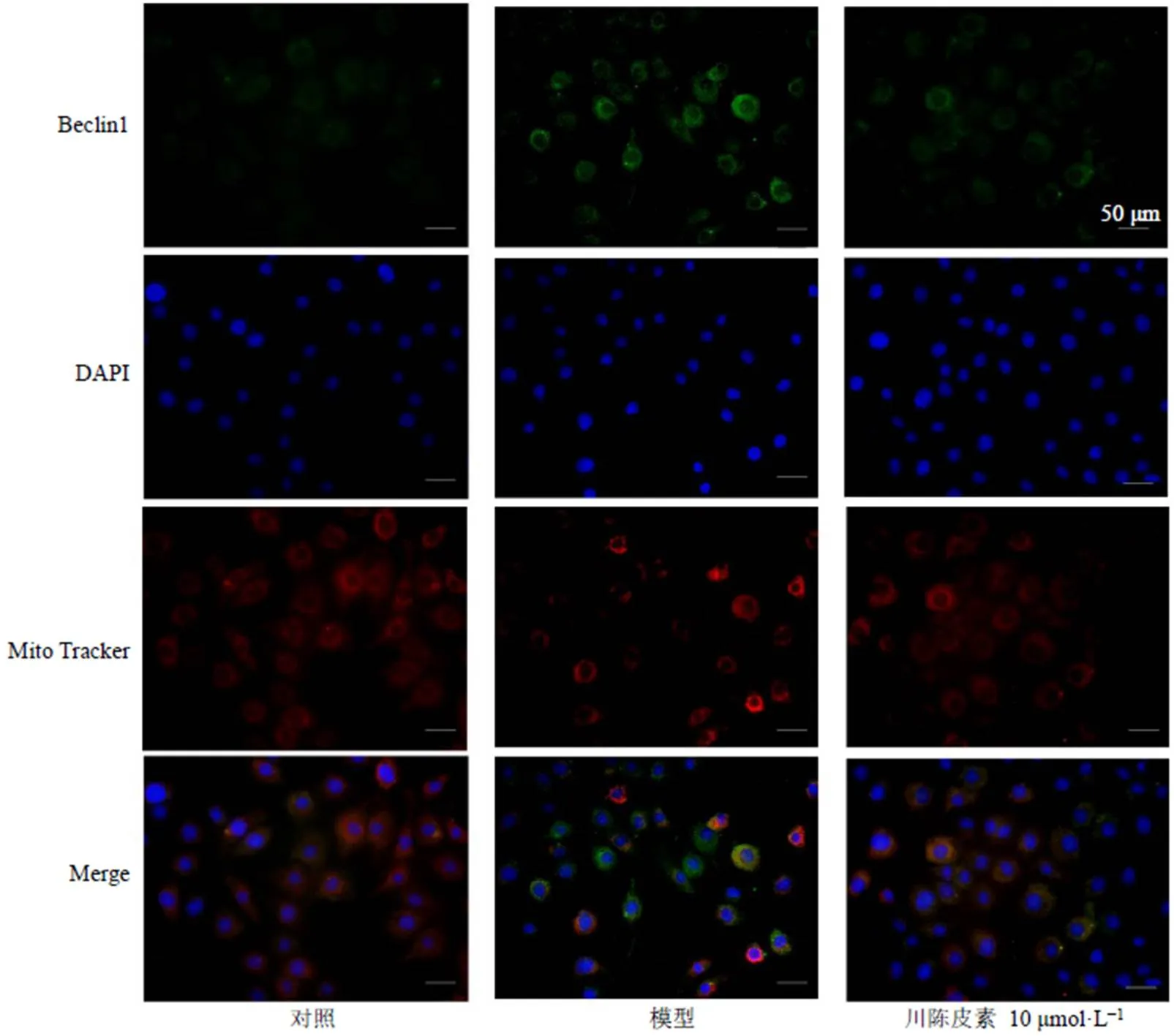
图7 川陈皮素对BRL细胞自噬蛋白与线粒体共定位的影响(×200)

图8 3-MA对BRL细胞存活率的影响()
4 讨论
HIRI发病机制涉及多种细胞和结构,线粒体自噬在此过程中尤其重要[23]。线粒体受损后,细胞内ROS水平升高,促进细胞死亡;自噬效应可通过清除功能异常的线粒体,从而保护细胞[11,24]。本研究发现,作为抗氧化剂和抗炎药物,川陈皮素对HIRI大鼠具有一定保护作用,可改善HIRI大鼠肝细胞线粒体形态;川陈皮素可显著上调HIRI大鼠肝组织和H2O2诱导的BRL细胞中LC3-II、Beclin1、ATG-7蛋白和mRNA表达水平,显著下调p62蛋白和mRNA表达水平,表明川陈皮素可以通过调控线粒体自噬,从而发挥对HIRI的防治作用。
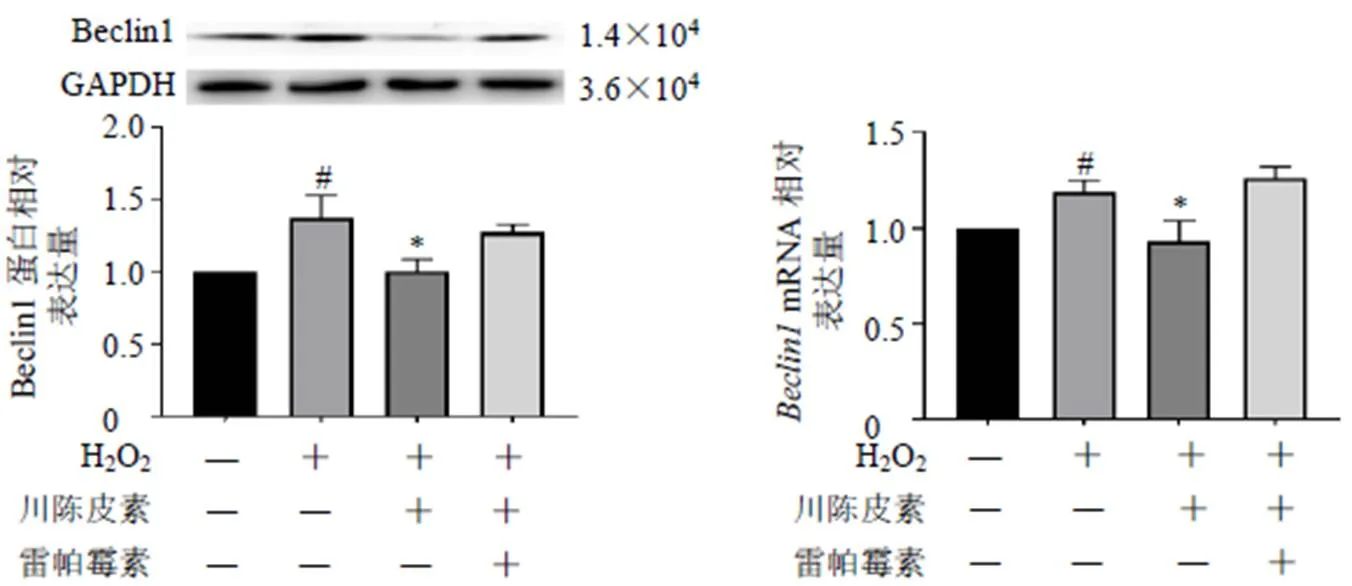
图9 雷帕霉素对BRL细胞Beclin1蛋白和mRNA表达的影响 ()
研究发现,川陈皮素对大鼠缺血后氧化应激的产生具有一定的疗效[17];川陈皮素对神经细胞氧化损伤具有保护作用[25]。本研究结果显示,川陈皮素可减少H2O2诱导的BRL细胞中自噬蛋白与线粒体的共定位数量,表明川陈皮素可以逆转氧化损伤后线粒体产生的变化。本研究采用自噬抑制剂3-MA和自噬诱导剂雷帕霉素,验证川陈皮素是否通过调控线粒体自噬过程保护肝细胞,发现川陈皮素可改善BRL细胞氧化损伤,雷帕霉素可抑制川陈皮素对BRL细胞氧化损伤的改善作用,3-MA(1、5 mmol/L)可增强川陈皮素对BRL细胞氧化损伤的改善作用,3-MA(10 mmol/L)抑制川陈皮素对BRL细胞氧化损伤的改善作用。自噬的增强可以提高肝脏对HIRI的耐受性,但过度的自噬会造成HIRI后肝细胞大量死亡[26-27]。这可能是本研究中川陈皮素联用过量自噬抑制剂后疗效减弱的原因。
综上所述,本研究发现川陈皮素对HIRI具有较好的防治作用,其机制与调控线粒体自噬有关。
利益冲突 所有作者均声明不存在利益冲突
[1] 王清卿, 赵鑫, 陈玉超, 等. 肝脏缺血再灌注损伤机制及干预的研究进展 [J]. 临床肝胆病杂志, 2016, 32(6): 1225-1229.
[2] Zhai Y, Busuttil R W, Kupiec-Weglinski J W. Liver ischemia and reperfusion injury: New insights into mechanisms of innate-adaptive immune-mediated tissue inflammation [J]., 2011, 11(8): 1563-1569.
[3] 王希红, 张超. 匹立尼酸对小鼠肝缺血再灌注损伤的防治作用 [J]. 广东医学, 2019, 40(21): 2985-2990.
[4] 傅天啸, 朱星喻, 钱苏海, 等. 联合应用参附注射液与葛根素注射液对大鼠肝脏缺血再灌注损伤防治的实验研究 [J]. 浙江中医药大学学报, 2016, 40(4): 306-311.
[5] 闫书鸣, 王建国, 李泽信, 等. 门冬氨酸鸟氨酸治疗肝癌切除术患者对肝脏缺血再灌注损伤的保护作用研究 [J]. 实用肝脏病杂志, 2018, 21(6): 932-935.
[6] 李欢, 熊静, 杨树龙, 等. 线粒体通路、氧化应激在肝脏缺血再灌注损伤细胞凋亡中作用机制的研究进展 [J]. 山东医药, 2018, 58(40): 99-102.
[7] Feng J, Zhang Q H, Mo W H,. Salidroside pretreatment attenuates apoptosis and autophagy during hepatic ischemia-reperfusion injury by inhibiting the mitogen-activated protein kinase pathway in mice [J]., 2017, 11: 1989-2006.
[8] Liu T, Zhang Q H, Mo W H,. The protective effects of shikonin on hepatic ischemia/reperfusion injury are mediated by the activation of the PI3K/Akt pathway [J]., 2017, 7: 44785.
[9] Xu S Z, Niu P Q, Chen K,. The liver protection of propylene glycol alginate sodium sulfate preconditioning against ischemia reperfusion injury: Focusing MAPK pathway activity [J]., 2017, 7(1): 15175.
[10] Sun Y X, Yao X, Zhang Q J,. Beclin-1-dependent autophagy protects the heart during sepsis [J]., 2018, 138(20): 2247-2262.
[11] Ueno T, Komatsu M. Autophagy in the liver: Functions in health and disease [J]., 2017, 14(3): 170-184.
[12] Song S B, Jang S Y, Kang H T,. Modulation of mitochondrial membrane potential and ROS generation by nicotinamide in a manner independent of SIRT1 and mitophagy [J]., 2017, 40(7): 503-514.
[13] Lu Y, Kan H, Wang Y,. Asiatic acid ameliorates hepatic ischemia/reperfusion injury in rats via mitochondria-targeted protective mechanism [J]., 2018, 338: 214-223.
[14] Yu W, Gao D P, Jin W,. Propofol prevents oxidative stress by decreasing the ischemic accumulation of succinate in focal cerebral ischemia-reperfusion injury [J]., 2018, 43(2): 420-429.
[15] Panel M, Ruiz I, Brillet R,. Small-molecule inhibitors of cyclophilins block opening of the mitochondrial permeability transition pore and protect mice from hepatic ischemia/reperfusion injury [J]., 2019, 157(5): 1368-1382.
[16] Chen H H, Chen Y T, Yang C C,. Melatonin pretreatment enhances the therapeutic effects of exogenous mitochondria against hepatic ischemia- reperfusion injury in rats through suppression of mitochondrial permeability transition [J]., 2016, 61(1): 52-68.
[17] Zhang L, Zhang X, Zhang C,. Nobiletin promotes antioxidant and anti-inflammatory responses and elicits protection against ischemic stroke[J]., 2016, 1636: 130-141.
[18] 陈才, 吴继雄, 王靓, 等. 川陈皮素后处理减轻心肌缺血再灌注损伤时细胞凋亡 [J]. 安徽医科大学学报, 2016, 51(7): 944-950.
[19] 何振兴. 川陈皮素对脓毒症小鼠肝损伤的保护作用及分子机制研究 [D]. 重庆: 重庆医科大学, 2016.
[20] Wang T, Wang F, Yu L,. Nobiletin alleviates cerebral ischemic-reperfusion injury via MAPK signaling pathway [J]., 2019, 11(9): 5967-5977.
[21] 宋虎, 张建军, 王振, 等. FOXO3a调控线粒体自噬在肝脏缺血再灌注损伤中的作用 [J]. 天津医药, 2017, 45(12): 1242-1247.
[22] Wang J X, Yu S N, Li J G,Protective role of-acetyl--tryptophan against hepatic ischemia- reperfusion injury via the RIP2/caspase-1/IL-1β signaling pathway [J]., 2019, 57(1): 385-391.
[23] Lee S, Kim J S. Mitophagy: therapeutic potentials for liver disease and beyond [J]., 2014, 30(4): 243-250.
[24] 何大立. 一氧化碳在大鼠肝脏缺血再灌注损伤中的保护作用及其机制研究 [D]. 西安: 第四军医大学, 2017.
[25] 苏明媛. 柑橘黄酮类成分对神经细胞氧化损伤的保护及作用机制研究 [D]. 上海: 华东理工大学, 2011.
[26] Boya P, Reggiori F, Codogno P. Emerging regulation and functions of autophagy [J]., 2013, 15(7): 713-720.
[27] Cheng P, Wang F, Chen K,. Hydrogen sulfide ameliorates ischemia/reperfusion-induced hepatitis by inhibiting apoptosis and autophagy pathways [J]., 2014, 2014: 935251.
Protective effect and mechanism of nobiletin on hepatic ischemia reperfusion injury
YANG Chao-jun, WANG Yue-wu, ZHOU Kai-heng
Department of Pharmacy, Ningbo Medical Center Lihuili Hospital, Ningbo 315000, China
To explore the effect and mechanism of nobiletin on preventing and treating hepatic ischemia reperfusion injury (HIRI).SD rats were randomly divided into control group, model group, and nobiletin (10 mg/kg) group. Activities of alanine aminotransferase (ALT) and aspartate aminotransferase (AST) in serum of rats in each group were detected by ELISA; Hematoxylin-eosin (HE) staining method was used to observe the pathological changes of liver tissue in rats; Transmission electron microscope (TEM) was used to observe the mitochondrial structure of hepatocytes in rats; Western blotting and qRT-PCR were used to investigate protein and mRNA expressions of autophagy-related protein Beclin1, microtubule associated protein 1 light chain 3-II (LC3-II) and autophagy-related gene-7 (ATG-7) and p62. H2O2was used to induce BRL cells to establish oxidative damage cell models. Control group, model group and nobiletin (10 μmol/L) group were set up, Western blotting and qRT-PCR were used to investigate the protein and mRNA expressions of Beclin1, LC3-II, ATG-7 and p62 in BRL cells; MitoTracker staining and immunofluorescence were used to investigate the co-localization of autophagy proteins and mitochondria in BRL cells of each group; Effects of autophagy inhibitors and inducers on protective effect of cells of nobiletin was investigated.Compared with control group, activities of ALT and AST in serum of rats in model group were significantly increased (< 0.05), liver tissue was diseased, number of hepatocyte mitochondria was increased and structure was disordered, the damaged mitochondria were phagocytosed, protein and mRNA expressions of LC3-II, Beclin1, ATG-7 were significantly increased (< 0.05), p62 protein and mRNA expressions were significantly reduced (< 0.05); Compared with model group, activities of ALT and AST in serum of rats in nobiletin group was significantly reduced (< 0.05), liver tissue lesions were reduced, mitochondrial morphological changes were improved, protein and mRNA expressions of LC3-II, Beclin1, ATG-7 in liver tissue were significantly reduced (< 0.05), p62 protein and mRNA expressions were significantly increased (< 0.05). In oxidative damage cells model, protein and mRNA expressions of LC3-II, Beclin1, ATG-7 in BRL cells were significantly increased (< 0.05), p62 protein and mRNA expressions were significantly reduced (< 0.05), Co-localization numbers of Beclin1 and MitoTracker were increased; Compared with model group, protein and mRNA expressions of LC3-II, Beclin1, ATG-7 in BRL cells of nobiletin group were significantly reduced (< 0.05), p62 protein and mRNA expressions were significantly increased (< 0.05), co-localizations numbers of Beclin1 and MitoTracker was reduced; Autophagy inhibitor 3-MA (1, 5 mmol/L) significantly enhanced the protective effect of nobiletin on BRL cells (< 0.05), autophagy inducer rapamycin significantly inhibited the down-regulation of nobiletin on protein and mRNA expressions of Beclin1 in BRL cells (< 0.05).Nobiletin has a good preventive effect on HIRI, and the mechanism may be related to the inhibition of mitochondrial autophagy.
nobiletin; mitochondria; autophagy; liver; ischemia-reperfusion injury
R285.5
A
0253 - 2670(2021)08 - 2343 - 08
10.7501/j.issn.0253-2670.2021.08.017
2020-11-23
国家自然科学基金资助项目(82003755)
杨超君(1982—),女,主管药师,研究方向为药学。Tel: 13456166729 E-mail: woshiyangcj@126.com
[责任编辑 李亚楠]

