球面对称设计结合遗传神经网络优选黄芪-红花药对水提工艺
陈光玮,金伟锋,许守超,张 玲,王 玉,何 昱
球面对称设计结合遗传神经网络优选黄芪-红花药对水提工艺
陈光玮,金伟锋,许守超,张 玲,王 玉,何 昱*
浙江中医药大学,浙江 杭州 310053
采用球面对称设计及遗传神经网络优选黄芪-红花药对的水提工艺。将黄芪-红花药对水提液中8种有效成分(羟基红花黄色素A、紫丁香苷、毛蕊异黄酮苷、脱水红花黄色素B、山柰酚-3--芸香糖苷、芒柄花苷、毛蕊异黄酮、黄芪甲苷)的含量进行赋权,以计算得到的综合得分作为水提工艺的评价指标。在单因素实验基础上,选择液料比、提取时间、提取温度3个因素,依据球面对称设计进行实验,并结合遗传神经网络模型进一步优选黄芪-红花药对水提工艺参数。球面对称设计得到的最佳提取条件为液料比20∶1、提取时间30 min、提取温度87 ℃、提取次数2次,其综合评分为4.877;以遗传神经网络得到的最佳提取条件为液料比22.7∶1、提取时间30 min、提取温度87 ℃、提取次数2次,经验证该条件下的综合得分为5.004。实验结果显示,遗传神经网络能够提高水提工艺条件的综合评分。球面对称设计和遗传神经网络能够优化黄芪-红花药对水提工艺参数,可为中药及其制剂中多种有效成分提取的工艺优选提供参考。
黄芪-红花药对;球面对称设计;遗传神经网络;工艺优化;羟基红花黄色素A;紫丁香苷;毛蕊异黄酮苷;脱水红花黄色素B;山柰酚-3--芸香糖苷;芒柄花苷;毛蕊异黄酮;黄芪甲苷
黄芪为补气健脾之要药,具有补气升阳、生津养血、托毒生肌的功效。陶弘景的《本草经集注》认为其兼具活血功效,可“逐五脏间恶血”,而红花活血通经,两者相使配伍可增强补气活血的作用。黄芪-红花药对常出现于补阳还五汤、溶栓通脉汤等经典方剂中,用于心脑血管疾病如中风(卒中)、厥心痛等的治疗[1]。临床应用中黄芪-红花药对的剂量比例在1∶1~40∶1,其中以3∶1的剂量比例最为常见[1]。
在不同领域的工艺研究中,研究者为节约时间和成本、提高提取效率,往往会通过试验设计或数学模型进行参数的优化。球面对称设计(spherical symmetry design,SSD)是一种在多维空间中的球面确定试验点的试验设计,正逐渐被国内不同领域所接受[2-4]。球面对称的空间维数为所考察的因素个数(),空间维数平方根为球面半径[6],试验次数为2+2+1。其试验次数比析因设计少,试验精密度比均匀设计高[5],通过球面对称设计得到的多元回归方程式能够预测范围内所有实验点的理论值,而传统的正交设计仅对已有因素水平进行考察。近年来,研究者已开始将集成学习方法应用于中医药研究中,如支持向量机[6]、人工神经网络[7-8]、随机森林[9-12]、决策树[10]等。由于遗传神经网络拥有优良的容错性和逼近能力[13],近年来许多学者将其应用于中药提取工艺参数优选领域中,使该领域的研究更加方便快捷、科学有效。由于以往在中药提取分离领域尚无将球面对称设计与遗传神经网络结合运用的报道,本实验拟以黄芪-红花药对的水提工艺为例,为中药多成分提取条件优化提供新的模式。
据文献报道,羟基红花黄色素A[14]、紫丁香 苷[15]、毛蕊异黄酮苷[16]、脱水红花黄色素B[17]、山柰酚-3--芸香糖苷[18-19]、芒柄花苷[20]、毛蕊异黄 酮[21]、黄芪甲苷[22]对于心脑血管疾病均有不同的治疗效果。本课题组在前期研究过程中发现黄芪-红花药对水提液中的这8种主要成分均能够被检出且峰形良好;不同的提取条件对黄芪-红花药对水提液中这些有效成分的提取效果存在较大影响。为最大程度地提取黄芪-红花药对中多种的有效成分,发挥其最佳药效,本实验将这8种成分的含量作为评价提取工艺优劣的指标,首先利用熵权法对8种成分含量进行赋权,得到的综合得分作为评价指标,通过单因素试验筛选影响较大的提取因素,并确定相应水平;然后以CRITIC(criteria importance through inter-criteria correlation)赋权法进行赋权,利用球面对称设计结合遗传神经网络对水提工艺条件进行优选,以有效提取黄芪-红花药对的化学组分,为后续药理学研究的开展奠定基础。
1 仪器与试药
1.1 仪器
Agilent 1260 infinity型高效液相色谱仪,配备G1315D型DAD检测器,美国安捷伦科技有限公司;RE-2000A旋转蒸发仪,上海亚荣生化仪器厂;TG16-WS台式离心机,湖南湘仪实验室仪器开发有限公司;FA1104N十万分之一电子分析天平,上海精密科学仪器有限公司;超纯水仪,美国Millipore公司。
1.2 试药
黄芪(批号190702)、红花(批号200313),浙江中医药大学中药饮片有限公司,经浙江中医药大学药学院黄绳武教授鉴定,黄芪为豆科黄芪属植物膜荚黄芪(Fisch.) Bge.的干燥根,红花为菊科红花属植物红花L.的干燥花。饮片经粉碎后得黄芪、红花粉末。对照品毛蕊异黄酮苷、芒柄花苷、毛蕊异黄酮、黄芪甲苷,批号分别为SZ20180608MRYHTG、SZ20180324MBHG、SZ20180425MRYHT、SZ20180506HQJG,南京世洲生物科技有限公司;对照品羟基红花黄色素A、紫丁香苷、山柰酚-3--芸香糖苷,批号分别为19100931、19111241、19110643,上海同田生物技术股份有限公司;对照品脱水红花黄色素B,实验室自制;以上对照品质量分数均大于98%。甲醇、乙腈,色谱级,美国天地公司;三氟乙酸,上海麦克林生化科技有限公司,批号C11196166。
2 方法与结果
2.1 含量测定方法
黄芪-红花药对水提液的成分含量通过HPLC- DAD法进行测定,色谱条件为Alltech Alltima C18色谱柱(250 mm×4.6 mm,5 μm)及Alltech Alltima C18保护柱(12.5 mm×4.6 mm);流动相为0.01%三氟乙酸-乙腈,梯度洗脱:0~7 min,12%乙腈;7~8 min,12%~18%乙腈;8~22 min,18%~20%乙腈;22~27 min,20%~21%乙腈;27~29 min,21%~26%乙腈;29~35 min,26%~32%乙腈;35~58 min,32%乙腈;柱温30 ℃;体积流量1.0 mL/min;检测波长:210 nm(毛蕊异黄酮苷、黄芪甲苷)、260 nm(紫丁香苷、山柰酚-3--芸香糖苷、芒柄花苷、毛蕊异黄酮)、403 nm(羟基红花黄色素A、脱水红花黄色素B);进样量20 μL。
按出峰时间先后顺序各成分的含量分别表示为羟基红花黄色素A(R=6.90 min)、紫丁香苷(R=9.47 min)、毛蕊异黄酮苷(R=19.66 min)、脱水红花黄色素B(R=22.16 min)、山柰酚-3--芸香糖苷(R=26.90 min)、芒柄花苷(R=35.29 min)、毛蕊异黄酮(R=40.48 min)、黄芪甲苷(R=57.52 min),经前期方法学考察,8种待测成分的质量浓度与峰面积均呈现良好的线性关系(≥0.999 7),精密度、稳定性和重复性均良好,RSD值均小于3%,平均加样回收率在96.26%~101.31%,RSD为0.74%~2.79%。
2.2 单因素考察
2.2.1 指标权重及综合得分的计算 在单因素考察过程中发现,黄芪-红花药对水提液中8种有效成分的含量随着因素水平变化趋势并不一致,给后续试验选取合适的因素水平造成一定困难。因此本实验通过熵权法确定黄芪-红花药对水提液中的8种成分在5个提取影响因素下含量的权重系数(w),计算最终的综合评分(S),以此直观衡量黄芪-红花药对水提液中不同成分受各因素变化的影响[8]。具体计算过程如下。
(1)指标的标准化处理:由于黄芪-红花药对水提液中的8种成分均对治疗心脑血管疾病有一定疗效,但各成分含量差异较大,不宜直接计算指标权重,故均进行标准化处理。其中x为第个样品中第个指标成分的含量(=1,2,…,;=1,2,…,8);而x′为正向化处理后数据,为方便表达,仍将其记为x。
x′={x-min{1j,…,x}}/{max{1j,…,x}-min{1j,…,x}}
(2)计算各样品下的第个指标在该指标下的比重(p)。

(3)计算各项指标的熵值(e)。
e=−plnp,其中=1/ln
(4)计算第项指标的信息熵冗余度(d)。
d=1-e
(5)计算第项指标的权重(w)。

(6)计算各单因素实验中的S。

2.2.2 提取次数考察 精密称取黄芪粉末15 g和红花粉末5 g,按30∶1的液料比加水,提取前不浸泡,分别提取1、2、3、4、5次,每次提取30 min,提取温度为100 ℃,提取液抽滤后合并,减压浓缩近干后以10%甲醇复溶,定容至25 mL量瓶中,以10%甲醇定容,摇匀,得供试品溶液A。精密吸取2 mL供试品溶液A至50 mL量瓶中,以10%甲醇定容,摇匀,得供试品溶液B,按“2.1”项下色谱条件测定样品中各成分含量,其中供试品溶液A用于测定毛蕊异黄酮和黄芪甲苷,供试品溶液B用于测定其余6种成分。每组单因素试验重复3次,由“2.2.1”项下公式计算各样品S,结果见表1。当提取次数为3次时,S值最大,但由于提取2次和3次的S值相近,为节省提取时间,故在球面对称设计中提取次数选择综合评分相对较低的2次。
2.2.3 浸泡时间考察 精密称取黄芪粉末15 g和红花粉末5 g,按30∶1的液料比加水,提取前分别浸泡0、10、20、30、40、50 min,提取2次,每次提取30 min,提取温度为100 ℃,每组单因素试验重复3次。测定各成分含量并计算各样品S,结果见表2。由结果可知浸泡时间对S值影响较小,综合考虑时间成本,将该因素剔除。
2.2.4 提取温度考察 精密称取黄芪粉末15 g和红花粉末5 g,按30∶1的液料比加水,提取前不浸泡,提取2次,每次提取30 min,提取温度分别为50、60、70、80、90、100 ℃,每组单因素试验重复3次,试验过程中以温度计严格控温。测定各成分含量并计算各样品S,结果见表3。当提取温度为70 ℃时,S值最大,故选择提取温度70 ℃作为球面对称设计的因素水平中心点。
2.2.5 提取时间考察 精密称取黄芪粉末15 g和红花粉末5 g,按30∶1的液料比加水,提取前不浸泡,提取2次,每次分别提取10、20、30、40、50、60 min,提取温度为70 ℃,每组单因素试验重复3次,试验过程中以温度计严格控温。测定各成分含量并计算各样品S,结果见表4。当提取时间为30 min时S值最大,故选择提取时间30 min作为球面对称设计的因素水平中心点。
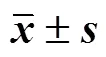
表1 提取次数对各成分含量的影响 (,n = 3)
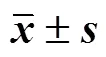
表2 浸泡时间对各成分含量的影响(,n = 3)
2.2.6 液料比考察 精密称取黄芪粉末15 g和红花粉末5 g,分别按10∶1、15∶1、20∶1、25∶1、30∶1的液料比加入水,提取前不浸泡,提取2次,每次提取30 min,提取温度为100 ℃,每组单因素试验重复3次。测定各成分含量并计算各样品S,结果见表5。可见当液料比为25∶1时S值最大,但由于黄芪-红花药对水提液中部分成分在浓缩过程中可能易受热分解,溶剂体积越大,浓缩时间越长,故选择液料比20∶1作为球面对称设计的因素水平中心点。
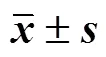
表3 提取温度对各成分含量的影响(,n = 3)
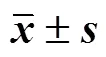
表4 提取时间对各成分含量的影响(,n = 3)
2.3 球面对称设计及结果
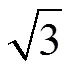
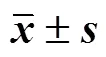
表5 液料比对各成分含量的影响(,n = 3)
在诸多赋权法中,CRITIC赋权法是集熵权法和标准离差法优势于一体的客观赋权法,CRITIC赋权法不仅吸取熵权法中考察因素对指标影响的思想,还兼顾了指标间的影响。在多因素试验设计法中,其可兼顾评价指标的对比强度及指标间冲突性来衡量各指标客观权重,能够提高其在球面对称设计中权重分配的合理性,因此,本实验采用CRITIC赋权法对球面对称设计的各实验组进行评分,将所得分数作为评价指标,进行统计学分析。球面对称设计试验分组及结果见表6。CRITIC赋权法具体计算步骤如下。
(1)数据标准化处理:参照“2.2.1”项下方法处理。
(2)考察指标变异性:CRITIC法以标准差表示各指标内差异波动情况,其中S为第个指标的标准差。S越大表示该指标变异性越大,评价强度越强。

(3)考察指标冲突性:CRITIC法以相关系数表示指标间冲突性(R),其中r为第个指标与第个指标间的相关系数。

(4)计算各指标信息量(C)、客观权重(W)及综合得分(Q)。
C=SR


将上述实验结果经多项式回归处理,所得的回归方程为=4.331+3.001 A+1.751 B-4.944 C-2.223 A2-0.123 B2+2.738 C2-1.815 AB+1.635 AC+0.390 BC,该方程回归系数2=0.660 4,且 各项系数的显著性均大于0.05,说明本研究以多项式回归不适合预测黄芪-红花药对水提工艺的最佳参数。
2.4 遗传神经网络模型的建立与预测
2.4.1 遗传神经网络模型的建立 以球面对称设计中的液料比、提取时间、提取温度作为遗传神经网络的输入变量,黄芪-红花药对水提液中的8种成分含量经CRITIC赋权法计算得到的综合得分Q值作为输出变量。根据留一法,将其中球面对称设计中的13组数据作为神经网络模型的训练集,2组数据作为测试集。根据不同隐含神经元数目下训练集最大决定误差(the maximum absolute error of training data,MAEtrian)、验证集最大决定误差(the maximum absolute error of testing data,MAEtest)、训练集决定系数(the determination coefficient of training data,2train)、训练集相关系数(the correlation coefficient of training data,train)作为确定隐含神经元合适数量的指标。其中2train和train趋近于1,MAEtrain和MAEtest较小时的隐含神经元数目为较合适的,具体结果见表7。为保证神经网络模型预测的准确性,尽可能减少模型学习时间和避免过拟合现象发生,本实验选择输入层×隐藏层×输出层为3×4×1的遗传神经网络模型,如图1所示;该遗传神经网络模型的相应权重如表8所示。图2为模型预测值与试验实测值之间的关系,表明含有4个隐藏层神经元的遗传神经网络模型与实验数据是基本一致的。
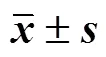
表6 球面对称设计实验结果(,n = 3)
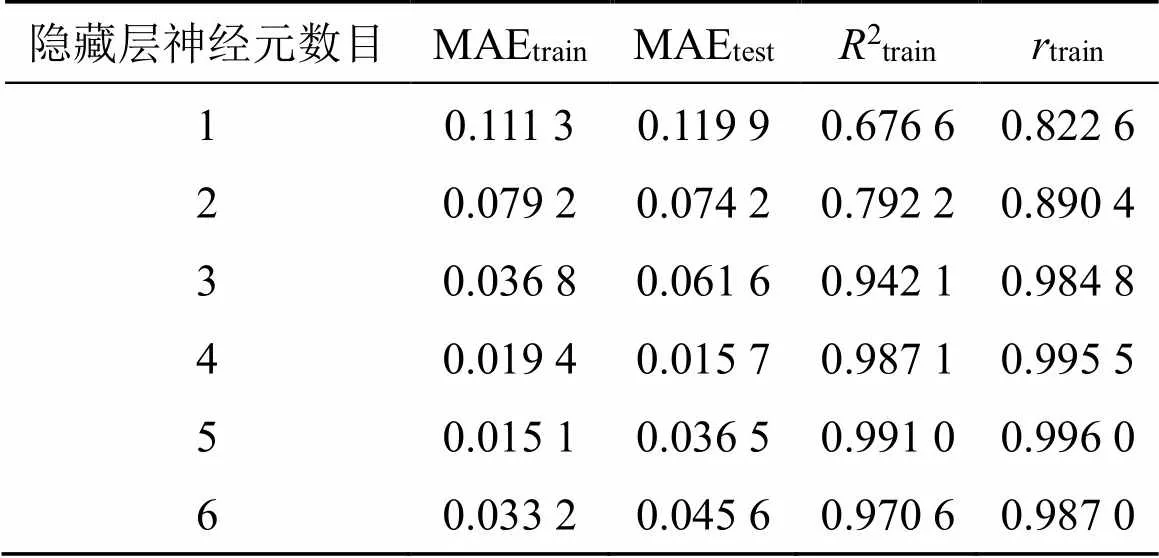
表7 隐含神经元数目对训练数据和测试数据的MAEtrian、MAEtest、R2train、rtrain的影响

当j=1时,vij和bj为输入层与隐藏层间权重和截距,yj为隐藏层神经元输出函数;当j=2时,vij和bj为隐藏层与输出层间权重和截距,yj为输出层神经元输出函数
2.4.2 基于遗传神经网络模型的目标寻优 利用MATLAB 2015a软件,设定种群大小为1000,最大迭代次数为200,最终预测得到最佳提取工艺参数为液料比22.7∶1,提取时间30 min,提取温度87 ℃,综合得分为4.960。
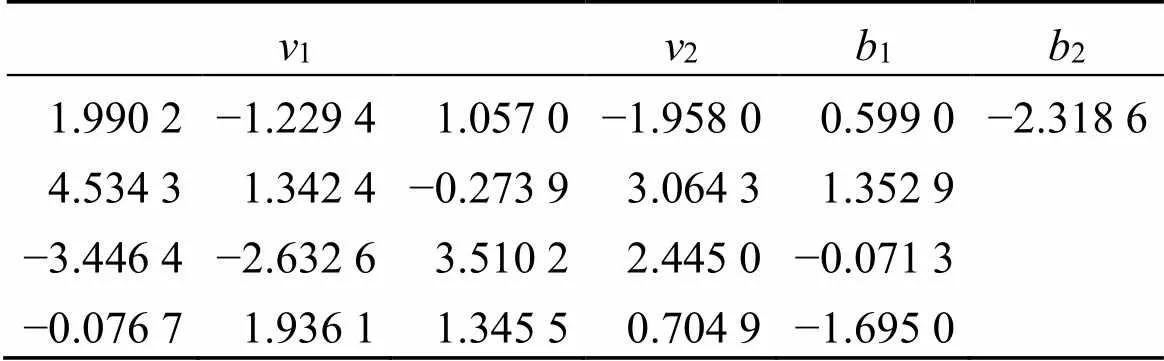
表8 用于预测黄芪-红花药对水提液水提工艺综合评分的4个隐藏层神经元的权重和截距
1和1分别为输入层与隐藏层间权重和截距;2和2分别为隐藏层与输出层间权重和截距
1and1are the weights and intercepts between the input and hidden layers;2and2are the weights and intercepts between the hidden and output layers
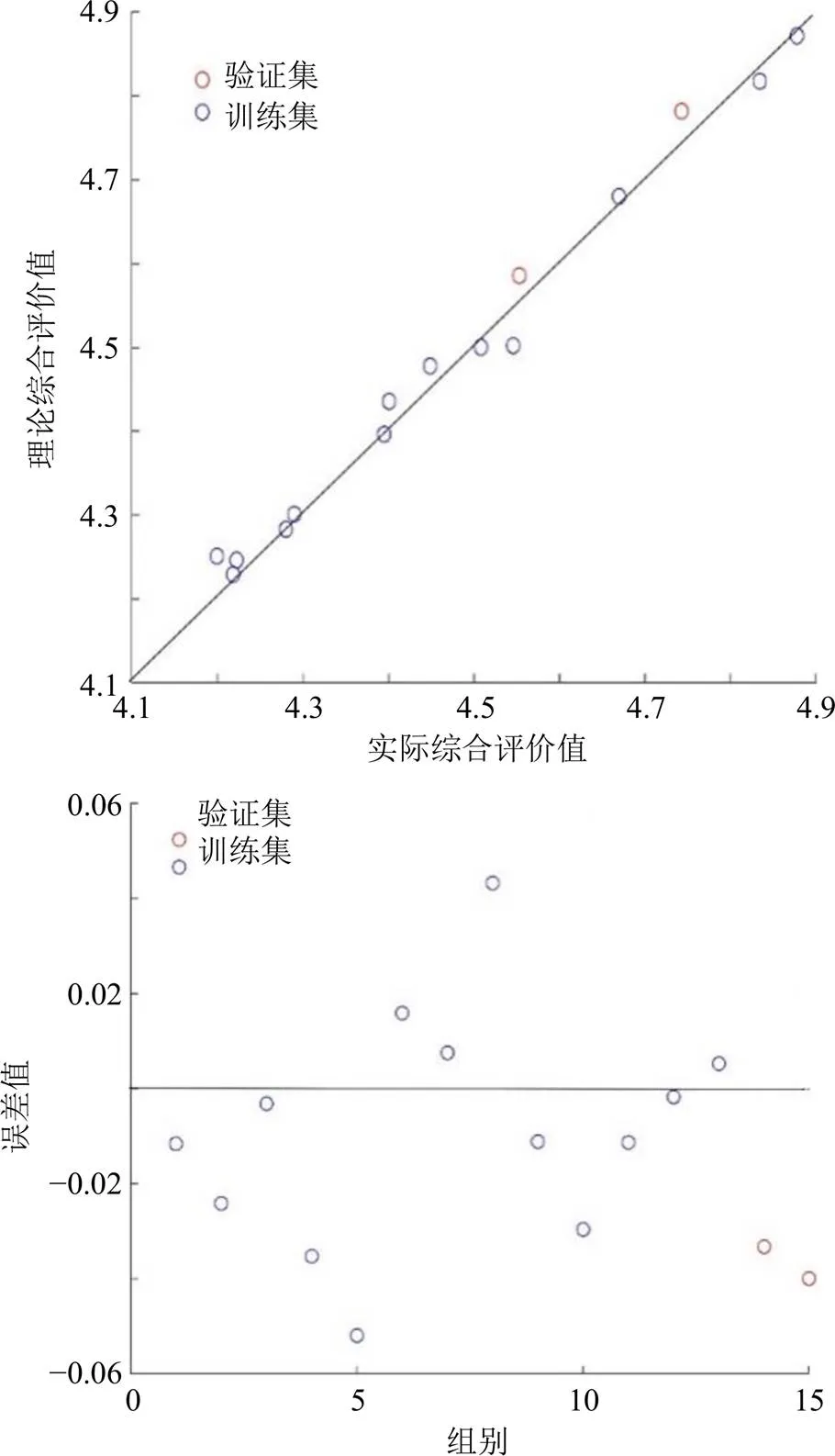
图2 实验数据与模型预测数据误差分析结果
2.5 最优工艺条件的验证性实验
以遗传神经网络模型预测得到的最优提取工艺条件,精密称取黄芪粉末15 g和红花粉末5 g,共3份,按上述得到的最优工艺条件进行操作,测定各成分含量,计算得到综合评分,结果见表9。通过遗传神经网络模型预测的最佳提取工艺条件得到的平均综合评分为5.004,RSD为0.46%,高于球面对称设计试验中的最高综合评分。

表9 遗传神经网络模型预测最优工艺参数的验证性实验
3 讨论
本实验依据传统汤剂制备方法用水提取黄芪-红花药对组分,通过HPLC-DAD法测定其中羟基红花黄色素A、紫丁香苷、毛蕊异黄酮苷、脱水红花黄色素B、山柰酚-3--芸香糖苷、芒柄花苷、毛蕊异黄酮、黄芪甲苷8种有效成分的含量,并将多指标通过客观赋权法整合为单一的综合得分以评价不同条件提取工艺的优劣。
熵权法是一种仅以指标离散程度确定权重的赋权法。指标的离散程度越大,其权重也越大。与之相对应的,单因素试验是假设各因素之间不存在相互作用且仅存在因素对指标影响为前提而设计的。因此,单因素试验与熵权法结合应用具有一定合理性。以熵权法计算各单因素实验中的综合评分,通过比较综合评分及联系实际确定球面对称设计各因素水平中心点。
与单因素试验不同,球面设计等多因素试验设计承认不同因素之间的相互作用,在数据分析方面也应考虑指标间的影响,而CRITIC赋权法兼顾评价指标的对比强度及指标间冲突性,可提高多因素试验设计中权重分配合理性,因此本研究选用CRITIC赋权法计算球面对称设计中的各指标权重及综合评分,考察“工艺参数-指标”和“指标-指标”的影响,能够提高其在球面对称设计中权重分配的合理性。
球面对称设计由于其相比于正交设计、析因设计、均匀设计等具有提取次数少、试验精度高等优势,正逐渐应用于中药提取分离领域当中。因为提取次数只能为整数,故在球面对称设计试验中不能将其作为考察因素。为完善黄芪-红花药对水提工艺条件,本研究在单因素试验过程中筛选合适的提取次数,结合其他单因素试验结果确定球面对称设计的因素与水平。
遗传神经网络是一种模拟生物进化过程、适合处理非线性数据的优选算法[23],现已被成功应用于中药质量评价[24]、中药制剂建模研究[25]等领域当中。大量研究证明遗传神经网络具有较好的全局寻优能力和抗过拟合能力,可大大减少研究时间和精力,适用于中药提取多因素试验设计。
因此,本实验最后利用建立的遗传神经网络数学模型,以红花黄芪水提液中的8种成分的CRITIC赋权法综合评分为指标进行工艺模拟优化。通过验证确定黄芪-红花药对水提工艺的最佳条件为液料比22.7∶1,提取温度87 ℃,提取次数2次,每次30 min,其综合评分为5.004,RSD为0.46%,高于任何一组球面对称设计实验的综合评分,表明在球面对称设计实验的基础上,通过遗传神经网络模型的预测能够有效优化黄芪-红花药对水提工艺参数。
利益冲突 所有作者均声明不存在利益冲突
[1] 周国赢, 杨锋. 脑血管病妙方特技精粹 [M]. 北京: 人民军医出版社, 2001: 152-234.
[2] 彭霞, 饶秋华, 李卓, 等. 基于球面对称设计的离散元细观参数定量确定方法 [J]. 中南大学学报: 自然科学版, 2019, 50(11): 2801-2812.
[3] 刘喜舞, 郑礼胜, 谢霞, 等. 细柱五加叶多糖提取分离纯化及保湿性能研究 [J]. 中草药, 2015, 46(8): 1167-1173.
[4] 刘岩雪. 荧光原位杂交技术检测乳腺癌Her-2/neu基因扩增的方法学研究 [D]. 天津: 天津医科大学, 2005.
[5] 刘娟, 谭红玲. 球面对称设计优化毛蕊老鹳草总黄酮的提取工艺 [J]. 安徽农业科学, 2014, 42(17): 5398-5399.
[6] 杨岩, 肖佳妹, 周晋, 等. 支持向量机法及其在中药研究中的应用 [J]. 中草药, 2020, 51(8): 2258-2266.
[7] 黄鹏程, 金伟锋, 万海同, 等. 遗传神经网络与遗传算法优选黄芪皂苷微波提取工艺条件 [J]. 中草药, 2019, 50(16): 3815-3823.
[8] 杨岩, 肖佳妹, 王韧, 等. 人工神经网络在中药相关研究领域的应用 [J]. 中草药, 2019, 50(13): 3230-3236.
[9] 万浩宇, 张洋洋, 虞立, 等. 基于随机森林模型的超声提取优化红花中两种有效成分工艺研究 [J]. 中药材, 2020, 43(3): 673-677.
[10] 张佳颖. 以含三七皂苷成分中药注射液为例建立ADR前置预测系统 [D]. 成都: 电子科技大学, 2020.
[11] 夏伯候, 胡玉珍, 熊苏慧, 等. 随机森林算法在中药指纹图谱中的应用: 以不同品牌夏桑菊颗粒指纹图谱分析为例 [J]. 中国中药杂志, 2017, 42(7): 1324-1330.
[12] 苑婕, 李晓杰, 陈超, 等. 基于随机森林算法的川芎成分-靶点-疾病网络的预测研究 [J]. 中国中药杂志, 2014, 39(12): 2336-2340.
[13] 刘红梅, 李可意. 基于BP神经网络和遗传算法优化莪术超临界萃取工艺 [J]. 中国药学杂志, 2006, 41(5): 371-374.
[14] Bai X, Wang W X, Fu R J,. Therapeutic potential of hydroxysafflor yellow A on cardio-cerebrovascular diseases [J]., 2020, 11: 01265.
[15] Tan J Y, Luo J, Meng C C,. Syringin exerts neuroprotective effects in a rat model of cerebral ischemia through the FOXO3a/NF-κB pathway [J]., 2021, 90: 107268.
[16] 王圣鑫, 闫向丽, 郑昊圳, 等. 毛蕊异黄酮苷和芍药苷联用对氧糖剥夺再灌注HT22细胞PI3K/AKT信号通路的影响 [J]. 中药新药与临床药理, 2020, 31(2): 138-142.
[17] Yue S, Wu L, Qu C,. Development and validation of a UFLC-MS/MS method for the determination of anhydrosafflor yellow B in rat plasma and its application to pharmacokinetic study [J]., 2015, 1003: 54-59.
[18] Yu L, Chen C, Wang L F,. Neuroprotective effect of kaempferol glycosides against brain injury and neuroinflammation by inhibiting the activation of NF-κB and STAT3 in transient focal stroke [J]., 2013, 8(2): e55839.
[19] Gaowa S, Bao N, Da M,. Traditional Mongolian medicine Eerdun Wurile improves stroke recovery through regulation of gene expression in rat brain [J]., 2018, 222: 249-260.
[20] Zhang W W, Xu F, Wang D,. Buyang Huanwu Decoction ameliorates ischemic stroke by modulating multiple targets with multiple components:evidences [J]., 2018, 16(3): 194-202.
[21] 张彐宁, 高维娟, 周晓红, 等. 毛蕊异黄酮对脑缺血/再灌注大鼠神经细胞凋亡的影响 [J]. 中国药理学通报, 2020, 36(12): 1775-1776.
[22] Sun L, Han R L, Guo F,. Antagonistic effects of IL-17 and Astragaloside IV on cortical neurogenesis and cognitive behavior after stroke in adult mice through Akt/GSK-3β pathway [J]., 2020, 6: 74.
[23] 吴思佳, 金伟锋, 王航, 等. 基于遗传神经网络的双目标甘草提取工艺优化 [J]. 中华中医药杂志, 2019, 34(4): 1719-1721.
[24] 王泽, 顾勤兰, 王志祥. 基于遗传神经网络的中药葛根及同属植物的质量评价研究 [J]. 中草药, 2005, 36(10): 1580-1582.
[25] 刘瑞新, 刘南岑, 史新元, 等. 基于遗传算法和BP网络的清开灵注射液增溶工艺优化研究 [J]. 中国中药杂志, 2009, 34(19): 2469-2472.
Decocting process optimization ofdrug pair based on spherical symmetry design and genetic neural network
CHEN Guang-wei, JIN Wei-feng, XU Shou-chao, ZHANG Ling, WANG Yu, HE Yu
Zhejiang Chinese Medical University, Hangzhou 310053, China
To determine the appropriate aqueous extract craft forvia spherical symmetry design and genetic neural network.In this study, the contents of eight active components, including hydroxysafflor yellow A, syringin, calycosin-7-glycoside, anhydrosafflor yellow B, kaempferol-3--rutinoside, ononin, calycosin, and astragaloside IV, in the aqueous extract ofwere weighted, and the calculated comprehensive score was applied as the evaluation index. According to the single factor experiment, the ratio of material to liquid, extraction duration and extraction temperature were taken as three factors of spherical symmetric design for the experiment. The genetic neural network model was established to further optimize the aqueous extraction process parameters of.The optimal extraction conditions obtained by spherical symmetry design were liquid to solid ratio of 20:1, extracting at 87 ℃, decocting twice and 30 min every time, and the comprehensive score was 4.877; The optimum extraction conditions obtained by the genetic neural network were liquid to solid ratio of 22.7:1, extracting at 87 ℃, decocting twice and 30 min every time, and the comprehensive score was 5.004. The experimental results showed that the genetic neural network can improve the comprehensive score of water extraction process conditions.Spherical symmetric design combined with genetic neural network mathematical model has ability to optimize the water extraction process parameters of, which provides a reference for optimizing the extraction process of various effective components from traditional Chinese medicine and its preparations.
-drug pair; spherical symmetry design; genetic neural network; process optimization; hydroxysafflor yellow A; syringin; calycosin-7-glycoside; anhydrosafflor yellow B; kaempferol-3--rutinoside; ononin; calycosin; astragaloside IV
R284.2
A
0253 - 2670(2021)08 - 2257 - 10
10.7501/j.issn.0253-2670.2021.08.008
2020-12-15
国家自然科学基金项目(81873226);国家科技重大专项重大新药创制(2019ZX09301101);浙江省自然科学基金项目(LZ18H270001);浙江省“万人计划”科技创新领军人才项目(2019)
陈光玮,硕士研究生,主要从事中药有效成分提取分离方向研究。E-mail: 657275426@qq.com
何 昱,教授,博士生导师。Tel: (0571)61768145 E-mail: heyu0923@sina.com
[责任编辑 郑礼胜]

