基于网络药理学研究艾片抗脑缺血再灌注损伤的作用机制及验证
付 尹,杨显娟,王 建*,王立映,王佳俊,龚道银,邓钦清
基于网络药理学研究艾片抗脑缺血再灌注损伤的作用机制及验证
付 尹1, 2, 3,杨显娟1, 2, 3,王 建1, 2, 3*,王立映1, 2, 3,王佳俊1, 2, 3,龚道银4*,邓钦清1, 2, 3
1. 成都中医药大学药学院,四川 成都 611137 2. 成都中医药大学 西南特色中药资源重点实验室,四川 成都 611137 3. 西南特色中药资源国家重点实验室,四川 成都 611137 4. 成都中医药大学附属医院,四川 成都 610075
探明艾片抗脑缺血再灌注损伤的作用及其机制。借助PharmMapper等数据库获得艾片(左旋龙脑)抗脑缺血再灌注损伤(cerebral ischemia-reperfusion injury,CIRI)的潜在靶点并进行基因本体(gene ontology,GO)功能富集分析和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析。分别设置假手术组、模型组、溶剂模型(1%聚山梨酯-80)组、阳性药(尼莫地平)组及艾片高、中、低剂量(0.20、0.10、0.05 g/kg)组,采用预防和治疗给药的方式对线栓法制备的CIRI模型大鼠进行干预,Zea Longa评分法对不同时间点(再灌注4、22.5、46.5、70.5 h)模型大鼠神经功能进行评价;2,3,5-氯化三苯基四氮唑(2,3,5-triphenyltetrazoliumchloride,TTC)染色法观察大鼠脑梗死率;蛋白质印迹(Western blotting)和免疫组织化学法对预测的通路进行初步验证。网络药理学预测显示,艾片抗CIRI的潜在靶点有63个,可能与调控生物过程及叉头转录因子O亚族(forkhead transcription factor of the O class,FOXO)信号通路、磷脂酰肌醇-3激酶(phosphatidylinositol-3-kinases,PI3K)/蛋白激酶B(protein kinase B,Akt)信号通路、雌激素信号通路等有关。实验结果显示,艾片0.20、0.10 g/kg组能极显著降低模型大鼠脑梗死率,显著升高模型大鼠缺血侧皮层中磷酸化叉头转录因子O亚族3a(phosphorylated-forkhead box O3a,p-FOXO3a)蛋白表达量和p-Akt/Akt和p-FOXO3a/FOXO3a值,极显著降低细胞死亡调解因子(Bcl-2 interacting mediator of cell death,Bim)和半胱氨酸天冬氨酸蛋白酶-3(cysteinyl aspartate specific proteinase 3,Caspase-3)蛋白表达量,艾片0.20 g/kg组还能不同程度改善模型大鼠各时间点神经功能损伤。艾片可能是通过调节Akt/FOXO3a/Bim信号通路改善CIRI,发挥抗细胞凋亡作用。
艾片;脑缺血再灌注;网络药理学;Akt/FOXO3a/Bim信号通路;凋亡
脑卒中因其高发病率和高死亡率,是造成全球老年人死亡的主要原因[1],在我国,缺血性脑卒中的发病率占脑卒中的85%[2],且呈逐年增长和年轻化的趋势[3],对患者、家庭及社会都带来沉重的负担[4-5]。当前对于缺血性脑卒中的首要治疗原则是尽早重建血液再灌,恢复脑部的血氧供应,临床上主要采用阿替普酶治疗或机械溶栓,但在短时间内恢复血氧供应,很大几率会发生2次损伤,导致脑水肿、脑出血和神经元死亡[1,6],且溶栓治疗受病理生理窗(pathophysiological window,PW)的限制[7-9],故急需新的方法和药物来缓解脑缺血再灌注损伤(cerebral ischemia- reperfusion injury,CIRI)。
艾片(主含左旋龙脑)为菊科植物艾纳香(L.) DC新鲜叶经提取加工制成的结晶,《中国药典》2020年版记载其味辛、苦,性微寒,归心、脾、肺经,因辛香走窜的特性,具有良好的开窍醒神功效,兼可清热止痛,常用于治疗热病神昏、中风痰厥[10]。课题组前期研究表明,艾片预防性给药3 d可改善CIRI模型大鼠的脑水肿,抑制造模引起的体温升高[11]。但目前关于艾片抗CIRI的具体机制尚未完全清楚,本研究在前期研究的基础上,从网络药理学角度初步预测艾片抗CIRI的可能机制,采用预防结合治疗给药的方式,从分子水平予以验证,探明艾片抗CIRI的通路机制,揭示其“开窍醒神”的科学内涵,为临床使用提供理论及实验依据。
1 材料与方法
1.1 基于网络药理学的机制预测
因艾片成分较单一,故针对其主要成分抗CIRI的机制进行预测。通过PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)获得艾片主要成分左旋龙脑的化学结构,保存为mol2或SDF格式,再利用PharmMapper数据库(http://www.lilab-ecust. cn/pharmmapper/)预测其潜在靶点,建立化合物靶点数据集。借助GeneCards数据库(https://www. genecards.org/)筛选与CIRI相关的基因靶点,建立疾病靶点数据集。为了便于统一分析,以上所有靶点通过UniProt数据库(https://www.uniprot.org/)转化成UniProt ID格式。绘制艾片(左旋龙脑)靶点与CIRI靶点的韦恩图,运用Cytoscape 3.7.2软件将二者共有靶点(即艾片抗CIRI的潜在靶点)进行可视化。
运用Metascape数据库(https://metascape.org/)对艾片(左旋龙脑)抗CIRI的潜在靶点进行基因本体(gene ontology,GO)功能富集分析和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析,用以说明相关靶点在基因功能和信号通路中的作用。GO功能富集分析主要包括生物过程(biological process,BP)、分子功能(molecular function,MF)和细胞组成(cellular component,CC)。通过在线作图平台微生信(http://www.bioinformatics.com.cn/)对富集分析结果进行可视化处理。
1.2 实验验证
1.2.1 药物及试剂 艾片(左旋龙脑)为菊科植物艾纳香(L.) DC.的新鲜叶经提取加工制成的结晶,产地贵州罗甸,购于贵州罗甸,经绵阳师范学院生命科学与技术学院田徽副教授鉴定,采用气相色谱法测得其中左旋龙脑含量91.3%>85%,符合《中国药典》规定。尼莫地平(批号190501,亚宝药业集团股份有限公司);聚山梨酯-80、2,3,5-氯化三苯基四氮唑(2,3,5-triphenyltetrazolium- chloride,TTC)、多聚甲醛(批号分别为2019070801、2019030101、2019052001,成都市科隆化学品有限公司);兔抗β-肌动蛋白(β-actin)抗体(批号LS194235,武汉Servicebio公司);兔抗蛋白激酶B(protein kinase B,Akt)抗体、兔抗叉头转录因子O亚族3a(forkhead box transcription factorof the O class 3a,FOXO3a)抗体、兔抗细胞死亡调解因子(Bcl-2 interacting mediator of cell death,Bim)抗体(批号分别为6、5、9,美国Cell Signaling Technology公司);兔抗p-Akt(phospho T308)多克隆抗体、重组兔抗p-FOXO3a(phospho S253)多克隆抗体(批号分别为GR3348566-1、GR113981-8,美国Abcam公司);兔抗半胱氨酸天冬氨酸蛋白酶-3(cysteinyl aspartate specific proteinase 3,批号42214,美国GeneTex公司);过氧化酶标记的山羊抗兔IgG抗体(美国Jackson ImmunoResearch公司,批号143146)。
1.2.2 药物的配制及剂量设置 龙脑作为一种小分子脂溶性单萜类物质,难溶于水,课题组前期使用5%聚山梨酯-80作为助溶剂,但由于其具有一定的刺激性和溶血毒性,且过敏反应强度与剂量、浓度及给药速率呈正相关[12],故在前期基础上进行了预实验,发现1%聚山梨酯-80也可溶解艾片,因此本实验采用1%聚山梨酯-80作为助溶剂。尼莫地平是一种二氢吡啶类钙通道阻滞药物,具有扩张脑血管、抗血管痉挛、促进血液循环、保护神经元等作用,是临床当中常用的脑保护剂[13],故选择其作为本实验的阳性药。精确称取艾片6.00 g,置于研钵中充分研匀后加入3 mL 1%聚山梨酯-80,充分研磨,加入纯水297 mL(少量多次加入),依次配制成0.020、0.010、0.005 mg/mL的药液,置于4 ℃冰箱保存备用,给药前将药液于37 ℃预温并摇匀。精确称取尼莫地平4片(20 mg/片),置研钵内充分研匀后加入74 mL纯水,配制成1.08 mg/mL的溶液,配制好的药液置4 ℃冰箱保存备用,给药前将药液于37℃预温并摇匀。
艾片剂量参考课题组前期实验结果,按照成人(60 kg)艾片日用量分别设置为0.20、0.10、0.05 g/kg。尼莫地平给药剂量为0.010 8 g/kg。
1.2.3 实验动物 健康雄性SPF级SD大鼠84只,7~8周龄,体质量220~240 g,购于重庆恩斯维尔生物科技有限公司,合格证号为SYXK(湘)2019- 0004,实验前在成都中医药大学动物房(NO.TCM-09-315)进行适应性喂养3 d,自由饮水及饮食,室温维持在25 ℃左右,湿度维持(50±5)%,同时室内保持明暗交替周期为12 h/12 h。在成都中医药大学国家中医药管理局中药药理三级科研实验室(NO.TCM-09-315)进行本次实验。动物实验经成都中医药大学实验动物伦理委员会批准,批准号为TCM-2016-312。
1.2.4 动物分组及给药 将SD雄性大鼠84只适应性饲养3 d后,按体质量随机分为7组,假手术组、模型组、溶剂模型(1%聚山梨酯-80)组、阳性药(尼莫地平)组及艾片0.20、0.10、0.05 g/kg组,每组12只。
按照10 mL/kg ig给予艾片各剂量药液,阳性药组给予尼莫地平,假手术组和模型组给予同体积生理盐水,溶剂模型组给予同体积1%聚山梨酯-80溶液,1次/d,连续给药3 d。第3次预防性给药30 min后对大鼠施予CIRI手术,造模成功后继续治疗给药,1次/d,连续3 d(实验周期6 d)。
1.2.5 CIRI模型大鼠的制备 造模前12 h大鼠禁食不禁水。第3次预防性给药30 min后,根据线栓法[14]制备大脑中动脉栓塞(middle cerebral artery occlusion,MCAO)局灶性脑缺血模型大鼠,小心地分离迷走神经、左侧颈总动脉(common carotid artery,CCA)、颈外动脉(external carood artery,ECA)、颈内动脉(internal carotid artery,ICA),微动脉夹暂时夹闭ICA,近心端结扎CCA、ECA。用注射器针头将CCA戳一小孔,将预先标记制备好的直径为0.286 mm的蘸蜡鱼线插入CCA,松开动脉夹,使鱼线经ICA,大脑中动脉(middle cerebral artery,MCA)到达大脑前动脉(anterior cerebral artery,ACA)近端,深度至颈内外动脉分叉处(20±2)mm,稍有阻力即停止进线,固定栓线并记录此刻时间,作为大脑局灶性缺血开始的时间,缝合切口并消毒,待缺血时间达到90 min,将栓线向外抽出1 cm,剪去多余部分,碘伏消毒,回笼饲养并观察。假手术组除不插入栓线外,其余操作同其他组。
1.2.6 判断造模成功的标准 大鼠术后不能直线行走,向右转圈,严重时向右侧倾倒,提尾时右前肢屈曲,不能伸展,视为造模成功。选取Zea Longa评分[2]≥1分的大鼠进行后续实验。
1.2.7 神经功能评分 于再灌注4 h及每天治疗性给药30 min后根据Zea Longa神经功能评分法对84只模型大鼠进行神经功能评分。
1.2.8 脑梗死率的测定 每组取8只大鼠末次治疗性给药30 min后进行上述神经功能评分,随后将其进行深度麻醉,通过颈椎脱臼处死,迅速取出大脑并清洗干净,沿冠状面切为6片,每片2 mm,置于预温好的2% TTC溶液中避光温孵30 min,最后固定在4%多聚甲醛溶液24 h。固定完成后将脑组织取出,吸干水分,分离出梗死区域与正常区域,分别称质量。梗死区域呈白色、正常区域呈玫瑰红色。计算脑梗死率。
脑梗死率=梗死区域总质量/切片总质量
1.2.9 蛋白质印迹法测定模型大鼠缺血侧皮层相关蛋白表达量 依据药效研究结果,结合文献报道阳性药尼莫地平为钙离子通道阻滞剂,其与细胞凋亡关系不显著,故机制部分选择假手术组、溶剂模型(1%聚山梨酯-80)组及艾片0.20、0.10 g/kg组进行研究。
另取SPF级健康雄性SD大鼠24只(不与药效研究部分共用),随机分为假手术组、溶剂模型(1%聚山梨酯-80)组及艾片0.20、0.10 g/kg组,每组6只,给药、造模方法同“1.2.4”和“1.2.5”项。
末次给药后30 min,将各组大鼠进行深度麻醉,颈椎脱臼处死,迅速取出大脑并清洗干净,置于冰上迅速分离出皮层梗死半暗带,使用高效RIPA裂解液提取组织中总蛋白,BCA蛋白试剂盒对其进行定量。配制12.5%十二烷基硫酸钠-聚丙烯酰胺凝胶,依次上样、电泳、转膜、5%脱脂牛奶封闭后,滴加一抗β-actin(1∶1000)、Akt(1∶1000)、p-Akt(1∶1000)、FOXO3a(1∶1000)、p-FOXO3a(1∶1000)、Bim(1∶1000)及Caspase-3(1∶1000),4 ℃摇床孵育过夜,TBST洗膜后滴加二抗(1∶10 000),于摇床室温孵育1.5 h,经TBST洗膜,ECL显影后,用Image Lab软件分析条带灰度值。蛋白表达量=目的条带灰度值/β-actin条带灰度值。
1.2.10 免疫组织化学法测定模型大鼠缺血侧皮层相关蛋白表达量 取“1.2.4”项下各组大鼠3只(与Zea Longa评分共用),末次给药30 min后进行神经功能评分,随后将其进行深度麻醉,通过颈椎脱臼处死,迅速取出大脑于冰冷的生理盐水中,滤纸吸去多余生理盐水后,置于4%多聚甲醛中固定24 h,然后转移至三氯甲烷和丙酮的混合液(三氯甲烷-丙酮1∶1)中浸泡24 h进行脱脂处理[15],在靠近后脑1/3处进行取材,经脱水、石蜡包埋、切片(片厚2 μm)、脱蜡、水化、抗原修复、阻断、封闭后,滴加一抗p-FOXO3a(1∶100)、Bim(1∶50)及Caspase-3(1∶600),4 ℃孵育过夜,经孵育二抗、显色后,置于400倍显微镜下观察目的蛋白的阳性表达情况,随机选取5个视野使用Image J软件对其进行定量分析。
1.2.11 统计学分析

2 结果
2.1 网络药理学预测机制
基于“药物-靶点”筛选出艾片有132个靶点;基于“疾病-靶点”筛选出CIRI靶点有1328个;将艾片的靶点与CIRI的靶点映射取交集,得到艾片抗CIRI的潜在靶点共63个,见图1。
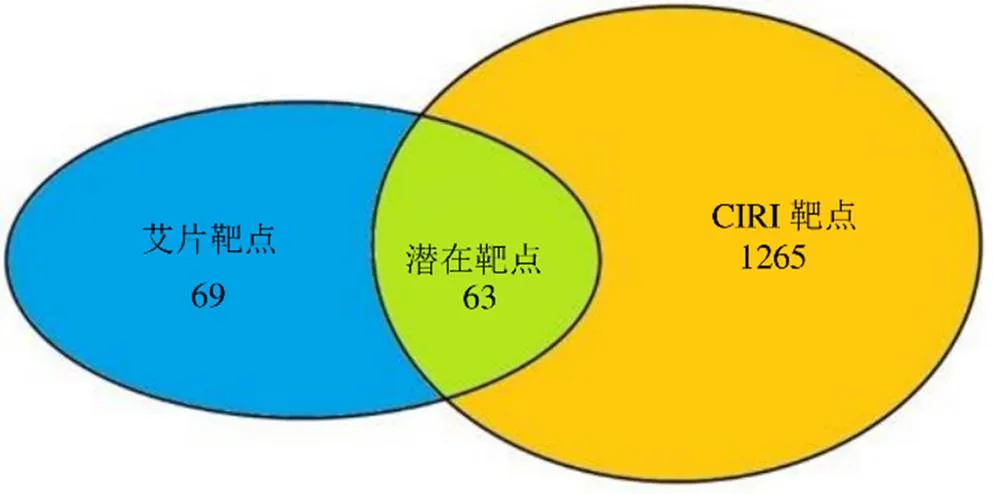
图1 艾片(左旋龙脑)抗CIRI的潜在靶点
针对63个潜在靶点运用Cytoscape 3.7.2绘制出“艾片-靶点-CIRI”网络图,其中橙色八边形代表CIRI疾病,绿色六边形代表艾片,紫色四边形代表CIRI的靶点,蓝色三角形代表艾片的靶点,黄色V形代表艾片抗CIRI的潜在靶点,见图2。
将艾片抗CIRI的潜在靶点导入Metascape数据库,下载分析结果保存为csv格式,打开结果文件,运用POWER函数将log(-value)值转化为值,根据<0.001进行筛选并按从小到大进行排序,分别选择前20条通路进行可视化,见图3。结果显示,与生物过程有关的条目共447个,主要参与调控酶活性、丝裂原活化蛋白激酶(mitogenactivated protein kinase,MAPK)和磷脂酰肌醇-3激酶(phosphatidylinositol-3-kinases,PI3K)信号通路以及炎症反应等;与细胞组成有关的条目共9个,主要参与构成生物膜;与分子功能有关的条目共23个,主要与酶的活性、核受体的活性和转录因子的活性等相关。与92条KEGG信号通路有关,主要涉及FOXO信号通路、PI3K/Akt信号通路、白细胞介素- 17(interleukin-17,IL-17)信号通路、雌激素信号通路以及血管内皮生长因子(vascular endothelia growth factor,VEGF)信号通路。
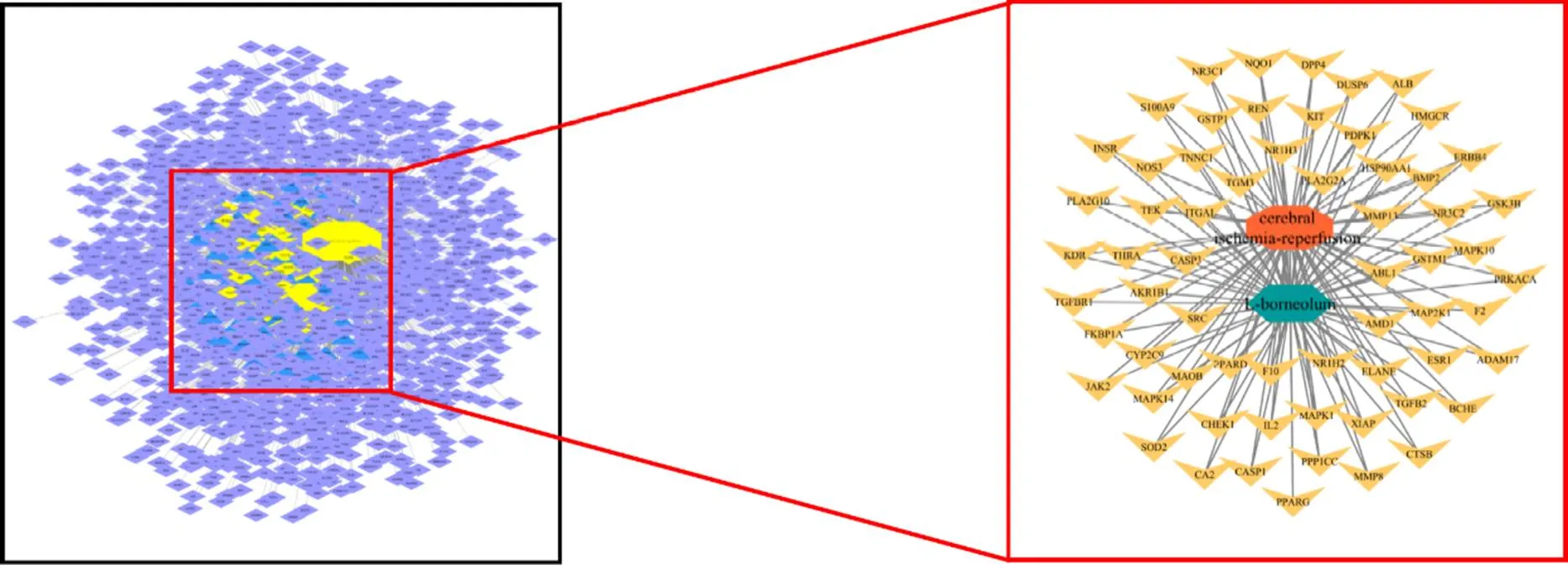
图2 艾片-靶点-CIRI网络图
2.2 实验验证结果
2.2.1 艾片对大鼠神经功能评分的影响 结果见表1,模型组和溶剂模型组大鼠各时间点神经功能评分均极显著高于假手术组(<0.01),溶剂模型组与模型组之间无显著性差异;尼莫地平组能极显著降低模型大鼠再灌注22.5、46.5、70.5 h的Zea Long评分(<0.01)。与溶剂模型组比较,艾片0.20 g/kg组能极显著降低模型大鼠再灌注22.5、46.5、70.5 h的Zea Long评分(<0.01);艾片0.10 g/kg组有降低各时间点Zea Longa评分的趋势,但无显著性差异。
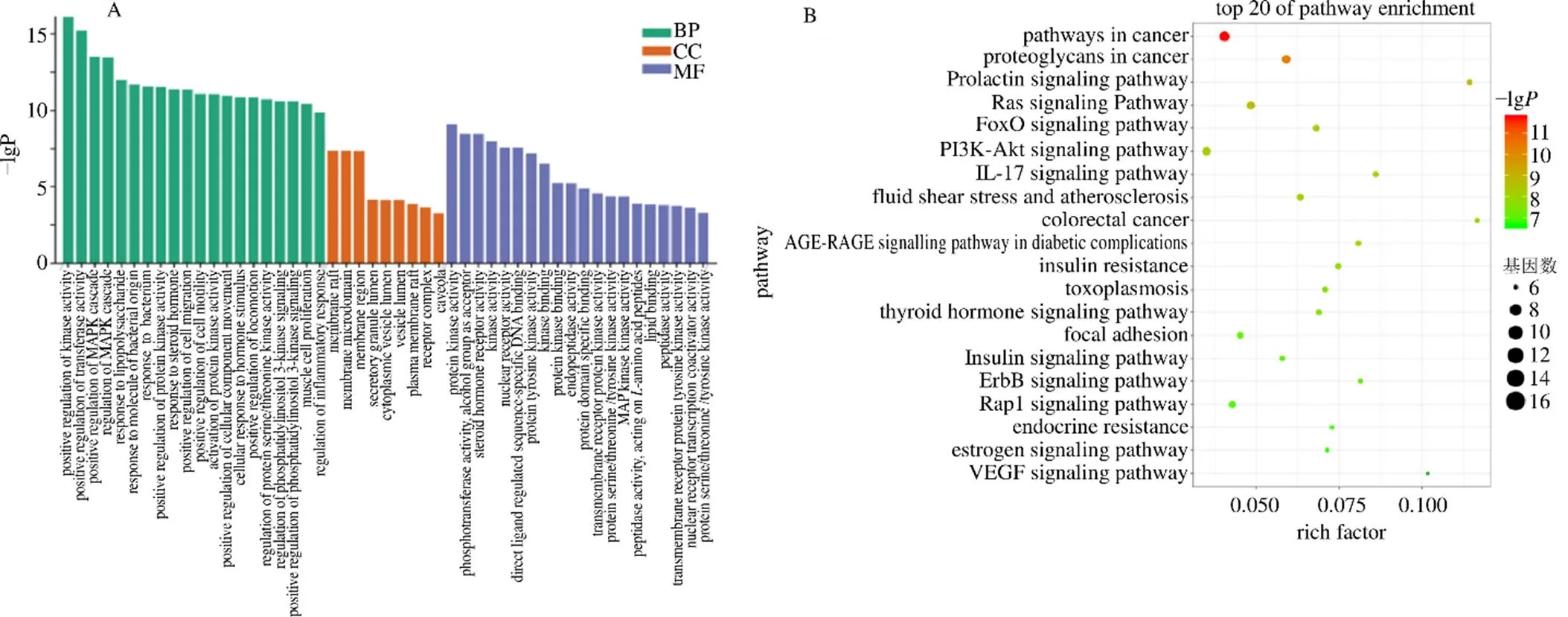
A-潜在靶点GO富集 B-潜在靶点KEGG富集 rich factor为潜在靶点富集在该条通路上的个数与该条通路上全部靶点个数的比值
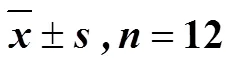
表1 各组大鼠Zea Longa评分()
与模型组比较:*<0.05**<0.01;与溶剂模型组比较:△△<0.01
*< 0.05**< 0.01model group;△△< 0.01solvent model group
2.2.2 艾片对大鼠脑梗死率的影响 如图4所示,经TTC染色后,假手术组脑组织完整呈正常玫瑰红色,未见梗死区域,其余各组可见不同程度苍白梗死区域。结果如表2所示,模型组与溶剂模型组大鼠的脑梗死率均极显著高于假手术组(<0.01),溶剂模型组与模型组之间无显著性差异,尼莫地平组能极显著降低模型大鼠脑梗死率(<0.01)。与溶剂模型组比较,艾片0.20、0.10 g/kg组大鼠的脑梗死率极显著降低(<0.01);艾片0.05 g/kg组虽有降低趋势,但无显著性差异。
2.2.3 艾片对大鼠缺血侧皮层Akt、p-Akt、FOXO3a、p-FOXO3a、Bim及Caspase-3蛋白表达的影响 结果如图5和表3所示,溶剂模型组大鼠缺血侧皮层中p-Akt/Akt和p-FOXO3a/FOXO3a值均极显著低于假手术组,Bim和Caspase-3蛋白相对表达量均极显著高于假手术组(<0.01)。与溶剂模型组比较,艾片0.20、0.10 g/kg组大鼠缺血侧皮层中p-Akt/Akt和p-FOXO3a/FOXO3a的值显著升高,Bim和Caspase-3蛋白相对表达量则极显著降低(<0.05、0.01)。
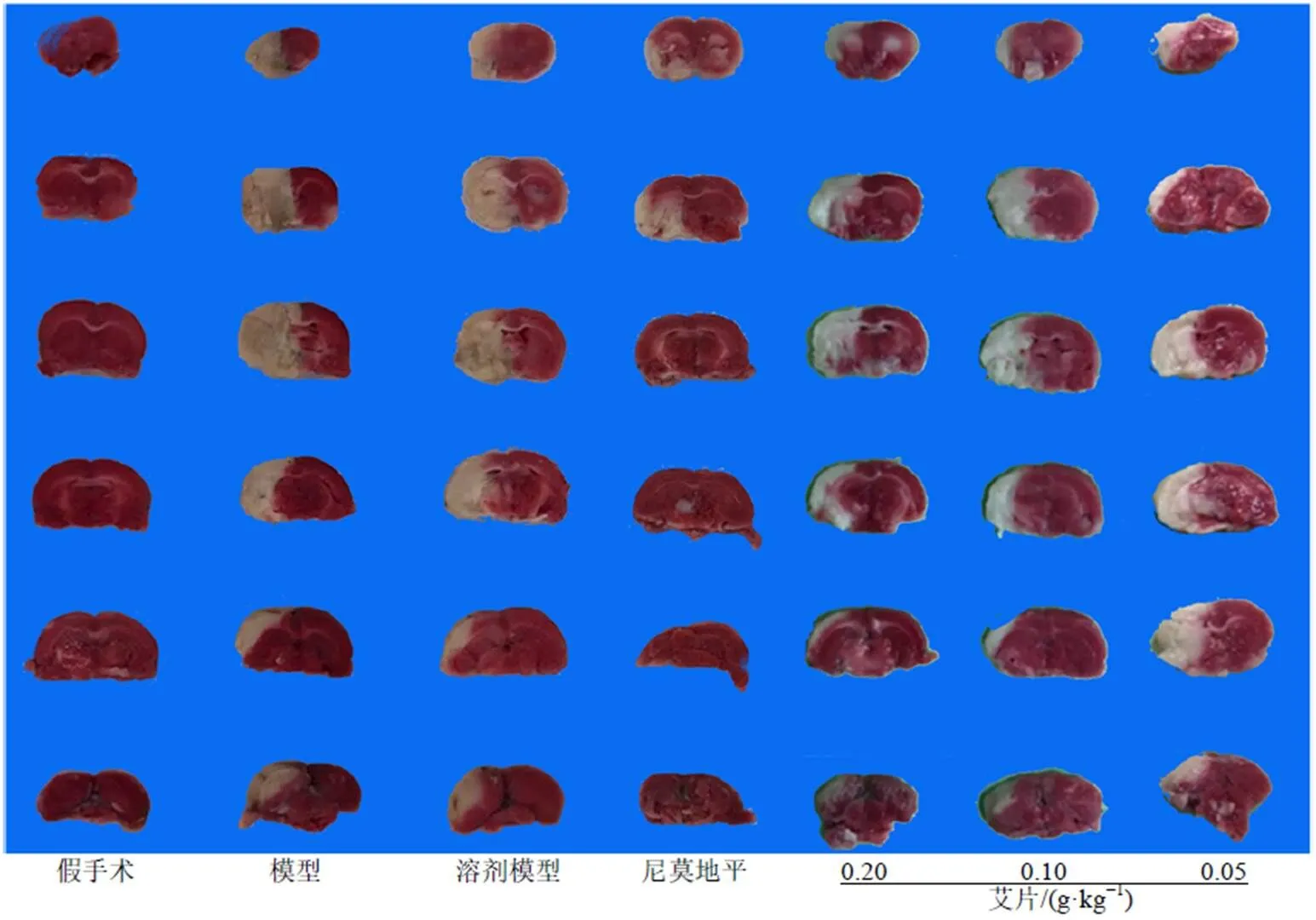
图4 各组大鼠TTC染色
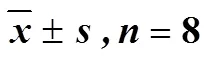
表2 各组大鼠脑梗死率()
与模型组比较:**<0.01;与溶剂模型组比较:△△<0.01
**< 0.01model group;△△< 0.01solvent model group
2.2.4 艾片对大鼠缺血侧皮层p-FOXO3a、Bim及Caspase-3蛋白表达的影响 如图6所示,假手术组p-FOXO3a强表达于大部分神经细胞胞浆,在血管内皮细胞胞浆和基底膜表达极弱;Bim较弱表达于大部分神经细胞胞核,在血管内皮细胞胞浆和基底膜表达极弱;Caspase-3极弱表达于少许神经细胞胞浆、血管内皮细胞胞浆和基底膜。结果如表4所示,溶剂模型组大鼠缺血侧皮层中p-FOXO3a蛋白表达量极显著低于假手术组,Bim和Caspase-3蛋白表达量均极显著高于假手术组(<0.01)。与溶剂模型组比较,艾片0.20、0.10 g/kg组大鼠缺血侧皮层中p-FOXO3a蛋白表达量极显著升高,Bim和Caspase-3蛋白表达量则极显著降低(<0.01)。

图5 各组大鼠缺血侧皮层Akt、p-Akt、FOXO3a、p-FOXO3a、Bim及Caspase-3蛋白表达情况
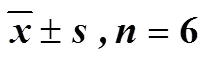
表3 各组大鼠缺血侧皮层Akt、p-Akt、FOXO3a、p-FOXO3a、Bim及Caspase-3蛋白相对表达量()
与溶剂模型组比较:△<0.05△△<0.01
△< 0.05△△< 0.01solvent model group
3 讨论
脑缺血被认为是造成85%神经系统疾病的主要原因之一[16],缺血发生后,大脑血流供应中断,导致大脑葡萄糖、营养及氧气供应不足[17],随着缺血时间的延长,将不可避免地对脑组织造成损伤,常会存在一些肢体障碍,如口眼㖞斜和语言障碍,以及半身不遂的情况。脑缺血的病理损害主要为局部血液循环障碍和神经元缺失,缺血、缺氧4 min即可造成神经元的死亡[18]。当前临床对于脑缺血的首要治疗原则是尽早实现再灌注,但有研究表明,再灌注可通过产生活性氧(reactive oxygen species,ROS)、细胞内Ca2+超载、兴奋性氨基酸毒性、线粒体功能障碍及血脑屏障异常从而对脑缺血患者产生更为严重的损伤[6,17]。总之,CIRI将引起细胞氧化应激、炎症及细胞凋亡的平衡失调,导致严重的神经功能损伤和不可逆的神经元凋亡,最终导致记忆和运动功能障碍[17,19-20]。因此,寻找能减少CIRI引起的神经元凋亡的药物具有重要意义。
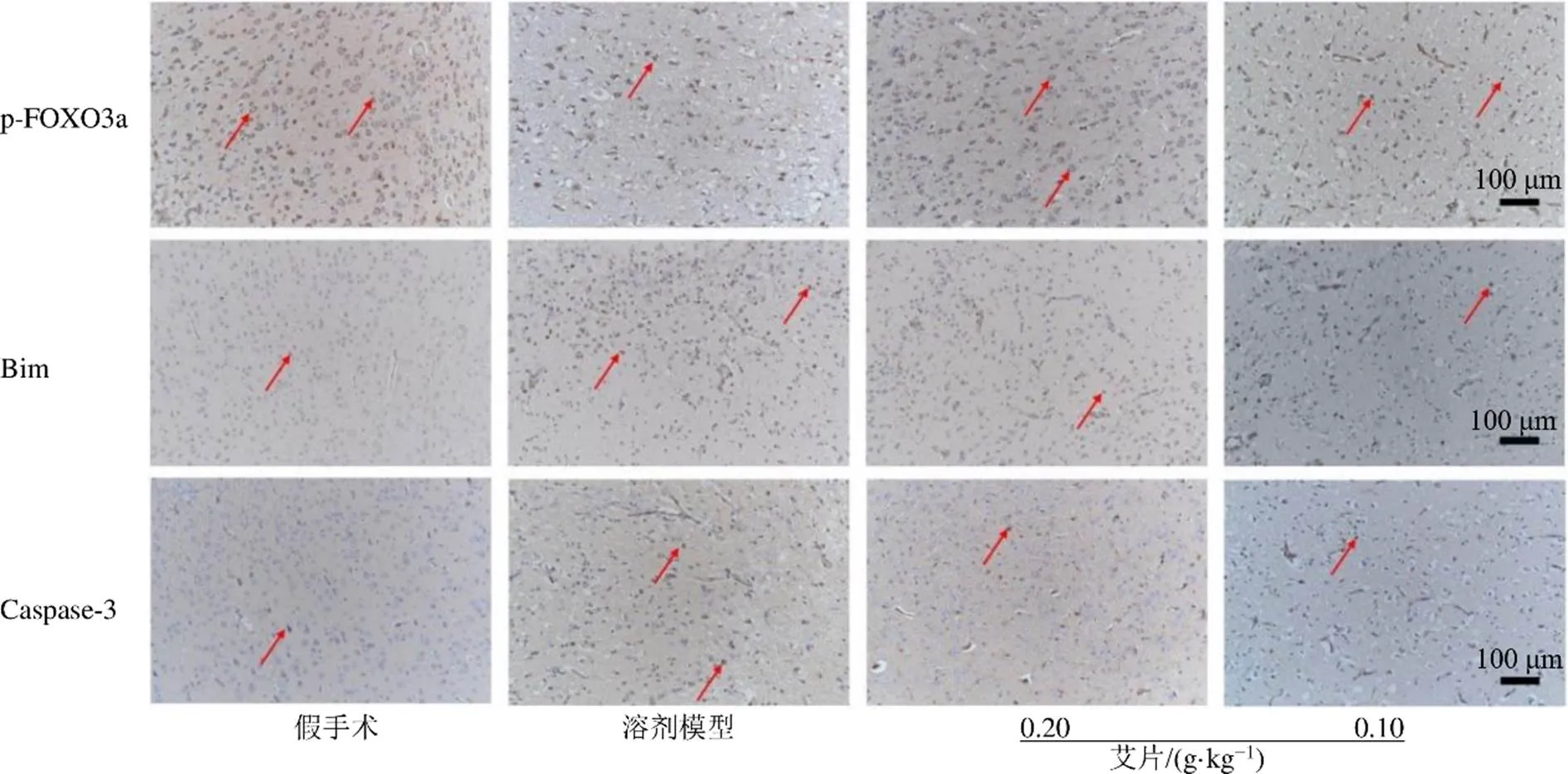
图6 各组大鼠缺血侧皮层p-FOXO3a、Bim及Caspase-3蛋白表达情况(×200)
表4 各组大鼠缺血侧皮层p-FOXO3a、Bim及Caspase-3蛋白表达量()
与溶剂模型组比较:△<0.05△△<0.01
△< 0.05△△< 0.01solvent model group
艾片为艾纳香叶片的提取物,首载于《增订伪药条辨》,临床使用的银丹心脑通软胶囊(含艾片)能活血化瘀、行气止痛,用于脑动脉硬化、中风、中风后遗症[10]。课题组前期已证实,艾片预防性给药3 d,对CIRI模型大鼠具有保护作用[11]。但目前关于艾片抗CIRI的具体机制尚未明确,同时预防性给药在临床中难以实现,多数人仍保持“无病不吃药”的观念,治疗性给药更为符合临床用药实际,再者因本实验使用的是艾片单味药而非复方,提前给药以使模型大鼠能维持一定血药浓度而发挥药效,因此,本研究基于中药多靶点的思路,运用网络药理学,预测艾片抗CIRI的潜在机制,采用预防与治疗给药的方式,缩短缺血时间,降低艾片给药剂量,从多个时间点评价模型大鼠神经功能,并从分子角度对预测结果进行验证。本研究发现艾片0.20、0.10 g/kg组能极显著降低CIRI模型大鼠的脑梗死率,且呈剂量相关性,艾片0.20 g/kg组还能不同程度地改善模型大鼠各时间点的神经功能损伤,体现了其“开窍醒神”的功效。
本研究通过网络药理学筛选得到艾片抗CIRI的63个潜在靶点,GO功能富集分析结果显示,艾片抗CIRI涉及调控酶、核受体和转录因子活性以及炎症反应,参与生物膜的构成,体现了中药多靶点的特点。KEGG通路富集分析结果显示,艾片抗CIRI与92条信号通路有关,在富集程度前20的信号通路中,FOXO信号通路是一条涉及调节细胞增殖、分化、凋亡、细胞周期、氧化应激、DNA损伤修复和细胞代谢的关键通路[21]。
哺乳动物的FOXO亚族包含:FOXO1/FKHR/ FOXO1a、FOXO3/FKHRL1/FOXO3a、FOXO4/AFK和FOXO6。其中FOXO3a在大脑、直肠、肝脏等组织均有分布,其转录功能亦是最强的[21-23]。FOXO3a是调节细胞凋亡的关键转录因子,正常情况下,FOXO3a在细胞质和细胞核均有分布,且处于磷酸化(失活)和非磷酸化(激活)之间的动态平衡状态[24]。Bcl-2家族在调节细胞凋亡、线粒体功能和凋亡因子的释放中起着重要作用,Bim作为Bcl-2家族的成员,是一种重要的促凋亡蛋白[25-26],亦是FOXO3a的重要靶点,FOXO3a可通过与Bim启动子区的2个FOXO转录因子结合域结合而激活Bim启动子,过度表达的FOXO3a可促进Bim的表达,并导致细胞凋亡[27],脑缺血后,神经元凋亡与FOXO转录因子活性增高有关[28]。
FOXO转录因子活性受磷酸化、乙酰化、泛素化、糖基化和甲基化等调节[21,28]。其中PI3K/Akt信号通路是调节FOXO3a的最重要的一种方式,活化的Akt进入细胞核,直接磷酸化FOXO3a的苏氨酸32、丝氨酸253、丝氨酸315(T32、S253、S315)位点,降低其与DNA的结合,并促进与14-3-3伴侣蛋白形成复合物,从细胞核向细胞质转移,因其在细胞质中仍处于结合状态,也防止了复合物逆向向细胞核转移,从而抑制了Bim介导的细胞凋亡,促进细胞存活[21-22,29-33]。在FOXO3a的3个磷酸化位点中,活化的Akt首先选择磷酸化S253位点[34]。抑制Akt的活性将导致FOXO3a的去磷酸化,通过核易位诱导靶基因Bim的表达,随后线粒体释放细胞色素C并激活Caspase-3,导致细胞凋亡[29,31-32,35]。有研究显示,白藜芦醇[36]、维生素A[37]、H2O2[38]、脂多糖[33]等可通过降低Akt和FOXO3a蛋白的磷酸化程度,增加促凋亡蛋白Bim的表达,从而导致细胞凋亡。本研究显示,艾片0.20、0.10 g/kg组能显著升高CIRI模型大鼠缺血侧皮层中p-FOXO3a和p-Akt的表达,降低促凋亡蛋白Bim及Caspase-3的表达,且免疫组化结果显示,p-FOXO3a主要表达于神经细胞胞浆,这与文献报道一致,提示艾片可能是通过Akt/FOXO3a/Bim信号通路对CIRI模型大鼠发挥抗凋亡作用,验证了前期预测结果。
综上所述,艾片可以改善CIRI模型大鼠的神经功能损伤,降低脑梗死率,同时通过调控Akt/FOXO3a/Bim信号通路,抑制促凋亡蛋白Bim和Caspase-3的表达,从而发挥抗凋亡作用,并呈剂量相关性,本研究体现了艾片多靶点的作用特点,对明确艾片抗CIRI的机制具有重要意义。
利益冲突 所有作者均声明不存在利益冲突
[1] Kishimoto M, Suenaga J, Takase H,. Oxidative stress-responsive apoptosis inducing protein (ORAIP) plays a critical role in cerebral ischemia/reperfusion injury [J]., 2019, 9(1): 13512.
[2] 郭晓庆, 王建, 谢倩, 等. 安息香防治结合给药对脑缺血模型大鼠的作用 [J]. 中药药理与临床, 2019, 35(6): 77-82.
[3] 《中国脑卒中防治报告2019》编写组.《中国脑卒中防治报告2019》概要 [J]. 中国脑血管病杂志, 2020, 17(5): 272-281.
[4] 刘冬华. 中医中药辨证治疗脑梗死的临床分析 [J]. 中国实用医药, 2019, 14(6): 118-119.
[5] 刘涛, 项耀钧. 急性脑梗死患者住院费用构成及影响因素分析 [J]. 解放军医院管理杂志, 2019, 26(2): 145-148.
[6] Zhang Y, Chen W A, Huang S S,. Protective effects of mangiferin on cerebral ischemia-reperfusion injury and its mechanisms [J]., 2016, 771: 145-151.
[7] 刘明慧. Orexin-A对大鼠局灶性脑缺血再灌注损伤的保护作用及机制研究 [D]. 曲阜: 曲阜师范大学, 2018.
[8] 郎丰山, 黄云霞, 薛云, 等. 脑缺血再灌注损伤病理生理机制研究进展 [J]. 食品与药品, 2018, 20(4): 312-316.
[9] 孙作艳, 岳少乾, 唐巍巍, 等. 芳香开窍药对脑卒中保护作用的实验研究进展 [J]. 天津中医药, 2018, 35(1): 77-80.
[10] 中国药典[S]. 一部. 2020: 90-91.
[11] 周宗元, 王建, 田徽, 等. 艾片与合成冰片对脑缺血再灌注损伤大鼠脑保护的比较研究 [J]. 时珍国医国药, 2014, 25(10): 2349-2351.
[12] 谭志高, 巢志茂, 刘海萍, 等. 聚山梨脂80的化学稳定性研究进展 [J]. 中国实验方剂学杂志, 2012, 18(1): 251-254.
[13] 王亚萍. 尼莫地平改善急性脑梗塞脑缺血缺氧的方法 [J]. 临床医药文献电子杂志, 2020, 7(47): 13.
[14] Dong T W, Chen N, Ma X,. The protective roles of-borneolum,-borneolum and synthetic borneol in cerebral ischaemia via modulation of the neurovascular unit [J]., 2018, 102: 874-883.
[15] 陈余朋, 胡力文, 张声, 等. 脑组织样本免疫组化过程存在问题与对策 [J]. 诊断病理学杂志, 2018, 25(10): 728-729.
[16] Kumar M, Nishad D K, Kumar A,. Enhancement in brain uptake of vitamin D3nanoemulsion for treatment of cerebral ischemia: Formulation, gamma scintigraphy and efficacy study in transient middle cerebral artery occlusion rat models [J]., 2020, 37(7): 492-501.
[17] Wen Y L, Gu Y M, Tang X D,. PINK1overexpression protects against cerebral ischemia through Parkin regulation [J]., 2020, 35(2): 188-193.
[18] 杨艺敏. Notch信号通路对大鼠脑缺血后神经再生的调控及辛伐他汀与神经再生关系的实验研究 [D]. 长春: 吉林大学, 2010.
[19] Jin Z, Guo P P, Li X Y,. Neuroprotective effects of irisin against cerebral ischemia/ reperfusion injury via Notch signaling pathway [J]., 2019, 120: 109452.
[20] Song J, Park J, Oh Y,. Glutathione suppresses cerebral infarct volume and cell death after ischemic injury: Involvement of FOXO3 inactivation and Bcl2 expression [J]., 2015, 2015: 426069.
[21] Shukla S, Rizvi F, Raisuddin S,. FoxO proteins’ nuclear retention and BH3-only protein Bim induction evoke mitochondrial dysfunction-mediated apoptosis in berberine-treated HepG2 cells [J]., 2014, 76: 185-199.
[22] 陈康. 低温对氧糖剥夺PC12细胞凋亡及FoxO3a表达的影响 [D]. 昆明: 昆明医科大学, 2016.
[23] Urbich C, Knau A, Fichtlscherer S,. FOXO- dependent expression of the proapoptotic protein Bim: Pivotal role for apoptosis signaling in endothelial progenitor cells [J]., 2005, 19(8): 974-976.
[24] 郑世茹. 姜黄素通过IGF-1/Akt/FoxO3a通路保护多巴胺能神经元细胞 [D]. 郑州: 郑州大学, 2016.
[25] 周波, 钱坤, 胡明珠, 等. PI3K/Akt/FoxO3a/Bim信号通路介导硫化氢后处理对缺氧H9c2心肌细胞的保护作用 [J]. 中国药理学通报, 2017, 33(7): 971-976.
[26] Song J K, Zhang W, Wang J H,. Inhibition of FOXO3a/BIM signaling pathway contributes to the protective effect of salvianolic acid A against cerebral ischemia/reperfusion injury [J]., 2019, 9(3): 505-515.
[27] Liu M H, Yuan C, He J,. Resveratrol protects PC12 cells from high glucose-induced neurotoxicity via PI3K/ Akt/FoxO3a pathway [J]., 2015, 35(4): 513-522.
[28] 王涛, 徐恩. FOXO转录因子在脑缺血后神经元凋亡诱导中的作用 [J]. 国际脑血管病杂志, 2009, 17(3): 220-224.
[29] Li D Y, Qu Y, Mao M,. Involvement of the PTEN-AKT-FOXO3a pathway in neuronal apoptosis in developing rat brain after hypoxia-ischemia [J]., 2009, 29(12): 1903-1913.
[30] Zhang M Q, Zheng Y L, Chen H,. Sodium tanshinone IIAsulfonate protects rat myocardium against ischemia-reperfusion injury via activation of PI3K/ Akt/FOXO3A/Bim pathway [J]., 2013, 34(11): 1386-1396.
[31] Liu Z X, Shi Z C, Lin J R,. Piperlongumine-induced nuclear translocation of the FOXO3A transcription factor triggers BIM-mediated apoptosis in cancer cells [J]., 2019, 163: 101-110.
[32] Abd El-Aal S A, Abd El-Fattah M A, El-Abhar H S. CoQ10 augments rosuvastatin neuroprotective effect in a model of global ischemiainhibition of NF-κB/ JNK3/baand activation of Akt/FOXO3A/bim cues [J]., 2017, 8: 735.
[33] 徐玲, 周爱玲, 赵敏. Toll样受体4通过Akt/ FoxO3a/Bim信号通路参与海马神经元凋亡 [J]. 生理学报, 2014, 66(3): 315-322.
[34] 张莉. 姜黄素诱导MDA-MB-468乳腺癌细胞凋亡中Akt-FoxO1通路的初步研究 [D]. 上海: 华东师范大学, 2012.
[35] Weston C R, Balmanno K, Chalmers C,. Activation of ERK1/2 by deltaRaf-1: ER* represses Bim expression independently of the JNK or PI3K pathways [J]., 2003, 22(9): 1281-1293.
[36] Liu M H, Lin X L, Li J,. Resveratrol induces apoptosis through modulation of the Akt/FoxO3a/Bim pathway in HepG2 cells [J]., 2016, 13(2): 1689-1694.
[37] 包建忠, 张震宇, 叶红波, 等. 维生素A对结肠癌细胞增殖、凋亡的影响及其机制研究 [J]. 中国地方病防治杂志, 2016, 31(11): 1289-1290.
[38] 刘米华. PI3K/Akt/FoxO3a信号通路在FGF-2拮抗心肌细胞凋亡中的作用研究 [D]. 衡阳: 南华大学, 2014.
Prediction of anti-cerebral ischemia-reperfusion injury effect of-borneolum based on network pharmacology and experimental verification
FU Yin1, 2, 3, YANG Xian-juan1, 2, 3, WANG Jian1, 2, 3, WANG Li-ying1, 2, 3, WANG Jia-jun1, 2, 3, GONG Dao-yin4, DENG Qin-qing1, 2, 3
1. College of Pharmacy, Chengdu University of Traditional Chinese Medicine, Chengdu 611137, China 2. Key Laboratory of Systematic Research of Distinctive Chinese Medicine Resources in Southwest China, Chengdu University of Traditional Chinese Medicine, Chengdu 611137, China 3. State Key Laboratory of Characteristic Chinese Medicine Resources in Southwest China, Chengdu 611137, China 4. Affiliated Hospital of Chengdu University of Traditional Chinese Medicine, Chengdu 610075, China
To investigate the role and possible mechanism of different doses of-borneolum prevention plus treatment in cerebral ischemia-reperfusion injury (CIRI).With the help of databases such as PharmMapper, the potential targets of-borneolum against CIRI was obtained, then the gene ontology (GO) functional and Kyoto Encyclopedia of Genes and Genomes (KEGG) pathway enrichment analyses were processed. The chosen rats were randomly divided into seven groups (sham group, model group, vehicle (1% tween) group, positive drug (nimodipine) group, and high, medium and low doses of-borneolum (0.20 g/kg, 0.10 g/kg, 0.05 g/kg) groups. The rat model of CIRI was established by suture method and administrated in the manner of pretreatment plus treatment. Zea Longa scoring was used to detect neurobehavioral changes at various time (reperfusion 4, 22.5, 46.5, and 70.5 h) of CIRI rats. Cerebral infarction volume was detected by 2,3,5-triphenyltetrazoliumchloride (TTC) staining. In addition, Western blotting and immunohistochemistry analysis were performed to verify the predicted pathway.Network pharmacology predicted that there were 63 potential targets of-borneolum against CIRI, these targets were enriched in the forkhead transcription factor of the O class (FOXO) signaling pathway, phosphatidylinositol-3-kinases (PI3K)/protein kinase B (Akt) signaling pathway, and estrogen signaling pathway, etc. Experimental results showed that following-borneolum (0.20 g/kg and 0.10 g/kg) treatment, the cerebral infarct sizes in CIRI rats were significantly attenuated, the expression of phosphorylated-forkhead box O3a (p-FOXO3a) and the ratio of p-Akt/Akt and p-FOXO3a/FOXO3a was increased, and Bcl-2 interacting mediator of cell death (Bim) and cysteinyl aspartate specific proteinase 3 (Caspase-3) protein expression was decreased in ischemic cortex. In addition,-borneolum group (0.20 g/kg) can also improve the nerve function impairments of CIRI rats at various time points.Neuroprotective and anti-apoptotic effect of-borneolum against CIRI is mediated via the Akt/FOXO3a/Bim signaling pathway.
-borneolum; cerebral ischemia-reperfusion; network pharmacology; Akt/FOXO3a/Bim signal pathway; apoptosis
R285
A
0253 - 2670(2021)08 - 2374 - 10
10.7501/j.issn.0253-2670.2021.08.021
2020-12-13
国家自然科学基金面上项目(81873023);国家自然科学基金面上项目(81473371);成都中医药大学中药“性-效-用”理论与实践创新团队(CXTD2018004);成都中医药大学西南特色中药资源重点实验室开放研究基金资助项目(2020XSGG025)
付 尹,硕士研究生,从事中药药性理论及应用研究。E-mail: 438730802@qq.com
王 建,教授,博士生导师,主要从事中药药性理论及应用研究。E-mail: jianwang08@163.com
龚道银,讲师,博士,主要从事法医学研究、鉴定和病理教学、检验。E-mail: daoyingong@163.com
[责任编辑 潘明佳]

