丹参酮IIA抑制肠上皮细胞铁死亡的作用与机制研究
刘翔,孙扬,马丽莉,马颖才
目的 阐释丹参酮 IIA 对肠上皮细胞铁死亡的作用及其调控机制。
方法 利用铁死亡诱导剂 RSL3 处理大鼠 IEC-6 细胞建立肠上皮细胞铁死亡模型;利用 CCK8 方法测定细胞活性;利用姬姆萨染色和透射电镜技术观察细胞形态学和结构;利用超高效液相色谱分离和质谱分析进行非靶向代谢物检测;利用 RT-qPCR 检测相关基因 mRNA 水平。
结果 RSL3 能够显著诱导肠上皮 IEC-6 细胞的死亡,并可被铁死亡的抑制剂 Fer-1 逆转;IEC-6 细胞铁死亡形态学结构特征包括线粒体变小、嵴减少、膜密度增高及外膜断裂、ROS 聚集等;丹参酮 IIA 能够逆转 RSL3 诱导的细胞铁死亡;丹参酮 IIA 表现出抑制 IEC-6 细胞铁死亡的活性;非靶向代谢组学数据表明丹参酮 IIA 能提高细胞内谷胱甘肽的含量,并上调 GPX4 基因表达。
结论 丹参酮 IIA 能够有效抑制肠上皮细胞的铁死亡;丹参酮 IIA 影响谷胱甘肽的代谢和上调 GPX4 表达。靶向上皮细胞铁死亡可能是丹参酮 IIA 治疗炎症性肠病的重要机制。
炎症性肠病(inflammatory bowel disease,IBD)是由复杂病因导致的肠道的慢性炎症。IBD 主要的病理生理改变是肠道异常炎性病变和肠道上皮层的损伤,上皮细胞死亡和肠上皮屏障的损害是炎症性肠病的主要病理过程[1]。肠道炎症和黏膜溃疡都由肠黏膜上皮细胞的死亡所致。IBD 的组织病理损伤涉及多种细胞死亡方式,如细胞凋亡、坏死、自噬、焦亡及铁死亡等[2]。铁死亡是一种新发现的依赖于铁离子及与活性氧诱导脂质过氧化密切相关的调节性死亡方式[3-4]。细胞铁死亡也是一种基因调控的细胞死亡方式,多种与铁代谢及氧化应激相关的基因参与调控细胞的铁死亡。铁死亡参与癌症发生、卒中、脑出血、创伤性脑损伤、缺血再灌注损伤、肾脏退化以及 IBD 等疾病过程[5-7]。细胞铁死亡是 IBD 肠上皮损伤的重要机制,也是导致炎症的重要因素。因此,基于铁死亡独特的形态特征、基因表达、分子通路和严密的调控系统,靶向细胞铁死亡将是治疗 IBD 新的策略[8-9]。
丹参是传统中药,具有活血调经、祛瘀止痛、清心除烦、凉血消痈等功效。中药成分分析表明丹参酮是丹参中含量较高的活性成分,也是发挥功效的主要化合物之一。丹参酮已经用于治疗心血管、肿瘤及炎症性肠病等多种疾病。其中,丹参酮 IIA具有天然抗氧化、抗肿瘤、抗炎除菌和神经保护等生理活性和药理作用。最近的研究表明丹参酮 IIA具有治疗溃疡性结肠炎的作用[10]。在溃疡性结肠炎的模型中,丹参酮 IIA 治疗可显著改善 IBD 小鼠的一般状况,改善组织病理学改变,降低血清中各种炎症因子浓度[11]。丹参酮 IIA 治疗 IBD 及炎症的机制与孕 X 受体(PXR)相关[10]。临床前研究表明丹参酮 IIA 是治疗 IBD 的有效中药成分,但其详细机制并不清楚。本文主要建立了肠上皮细胞铁死亡的模型,评价了丹参酮 IIA 对肠上皮细胞铁死亡的调节作用,并利用代谢组学技术探索了其抑制细胞铁死亡的机制。
1 材料与方法
1.1 材料
1.1.1 细胞系 大鼠小肠隐窝上皮细胞(intestinal epithelioid cell line No.6,IEC-6)购自上海赛百慷生物技术股份有限公司,批号 iCell-r016。
1.1.2 试剂 DMEM 高糖培养基和胎牛血清购自美国 FBS 公司;青霉素-链霉素溶液和 PBS 缓冲液均购自武汉普诺赛生命科技有限公司;RSL3、铁抑素-1(Fer-1)、丹参酮 IIA 和胰岛素均购自美国 MedChemExpress 公司;CCK8 溶液购自翌圣生物科技(上海)股份有限公司;TRIzol 试剂购自美国 Invitrogen 公司;姬姆萨染色液购自北京索莱宝科技有限公司;ROS 检测试剂盒购自武汉伊莱瑞特生物科技股份有限公司;GPX4 抗体购自美国Abcam 公司;β-actin 抗体购自武汉爱博泰克生物科技有限公司;山羊抗兔 IgG H&L(HRP)购自北京中杉金桥生物技术有限公司;RIPA 裂解液购自大连美仑生物技术有限公司;SDS-PAGE 凝胶、ECL 显影液和电镜固定液均购自武汉赛维尔公司。
1.1.3 仪器 恒温细胞培养箱为德国 Wiggens公司产品;流式细胞仪为美国 Beckman CytoFLEX公司产品;酶标仪为美国 Molecular Devices 公司产品;倒置显微镜为德国 Leica 公司产品;电泳仪和电转仪为美国 Bio-Rad 公司产品;显影仪为美国Bio-Techne 公司产品;超高效液相色谱系统(1290 Infinity LC)为美国 Agilent 公司产品;质谱仪(Triple TOF 6600)为美国 SCIEX 公司产品。
1.2 方法
1.2.1 细胞培养 IEC-6 细胞在含 10% FBS、0.01 mg/ml 胰岛素、1% 青霉素-链霉素溶液的高糖DMEM 培养基中培养,待细胞生长至密度为 90%时进行传代处理。接种时以 3 × 104/cm2的密度进行铺板。细胞置于 37 ℃、含 5% CO2的恒温细胞培养箱中培养,取生长状态良好的细胞进行后续实验。
1.2.2 CCK8 法检测细胞活力 将 IEC-6 细胞以 1 × 104/孔的密度接种于 96 孔板中,分别设置DMSO 对照组、不同浓度(0.25、0.5 和 1 μmol/L)的 RSL3 组、RSL3 + 不同浓度(0.25、0.5、1 和2.5 μmol/L)的丹参酮 IIA 组、RSL3 + Fer-1 组,每组设置 4 个复孔,24 h 后根据细胞生长状态每孔加入 10 μl CCK8 溶液,避光放置于 37 ℃ 培养箱中继续孵育 2 h,酶标仪检测在 450 nm 下的吸光度。
1.2.3 姬姆萨染色观察细胞形态 将 IEC-6 细胞以 3 × 104/cm2的密度铺板至 12 孔板中,分别设置 DMSO 对照组、RSL3 组(0.5 μmol/L)、RSL3(0.5 μmol/L)+ 丹参酮 IIA 组(2.5 μmol/L),细胞培养 24 h 后进行姬姆萨染色。吸弃培养基并用PBS 清洗细胞 2 遍,加入甲醇固定 2~3 min,配制 1 × 姬姆萨工作液,加入染色液染色 15~30 min后至于显微镜下观察并拍照。
1.2.4 电镜观察细胞超微形态 将 IEC-6 细胞以 3 × 104/cm2的密度接种到 10 cm 细胞培养皿中,分为 DMSO 对照组、RSL3 组(0.5 μmol/L)、RSL3(0.5 μmol/L) + 丹参酮 IIA 组(2.5 μmol/L),培养 24 h 后吸弃培养基,加入 2.5% 的常温戊二醛电镜固定液固定 5 min,用细胞刮刀轻轻刮下细胞并收集到离心管中,离心后弃掉固定液并加入新的固定液,将细胞团轻轻挑起,室温避光固定30 min 后转移至 4 ℃。细胞固定完成后进行电镜样本的制作。
1.2.5 细胞内活性氧(ROS)水平检测 将 IEC-6细胞以 3 × 104/cm2的密度铺板至 6 孔板中,分别设置 DMSO 对照组、RSL3 组(0.5 μmol/L)、RSL3(0.5 μmol/L)+ 丹参酮 IIA 组(2.5 μmol/L),细胞培养 6 h 后,吸弃培养基并用 PBS 清洗 2 遍。胰酶消化细胞后,用无血清培养基按照 1:1000 比例稀释 DCFH-DA,并调整细胞浓度为 2 × 106/ml。将细胞于 37 ℃ 避光孵育 20 min,每隔 3~5 分钟上下颠倒混匀,然后使用无血清细胞培养基清洗细胞 3 遍,离心弃上清后用 300 μl PBS 重悬细胞,流式细胞仪用 FITC 的参数设置进行检测。
1.2.6 非靶代谢组学分析 每组设置 3 个生物学重复样本,将样本进行代谢物提取,并将代谢物用超高效液相色谱系统分离后,使用质谱仪进行质谱分析,分别采用正离子和负离子模式进行检测;对检测后的数据采用 XCMS 软件进行峰对齐、保留时间校正和提取峰面积,并对 XCMS 提取得到的数据进行代谢物结构鉴定、数据预处理、数据分析,包括单变量统计分析、多维统计分析、差异代谢物筛选、差异代谢物相关性分析、KEGG 通路分析等。筛选出与铁死亡密切相关的差异代谢物,并分析丹参酮 IIA 调控的关键代谢物质。
1.2.7 Western blot 蛋白印迹检测 将 IEC-6 细胞以 3 × 104/cm2的密度铺板至 6 孔板中,分别设置 DMSO 对照组、RSL3 组(0.5 μmol/L)、RSL3(0.5 μmol/L)+ 丹参酮 IIA 组(2.5 μmol/L),细胞培养 24 h 后,使用 RIPA 裂解液(含 1% PMSF)裂解细胞,加入 5 × SDS 缓冲液,于 100 ℃ 加热变性 10 min。将蛋白裂解液加入到 10% 浓度的SDS-PAGE 凝胶中进行电泳,电泳结束后将蛋白转移到 0.45 μm PVDF 膜上,4 ℃ 过夜孵育 GPX4一抗,使用 TBST 溶液清洗膜后孵育二抗,然后加入增强型化学发光试剂进行显影。
2 结果
2.1 丹参酮 IIA 保护 RSL3 诱导 IEC-6 细胞死亡
利用 CCK8 测定细胞的增殖活性,RSL3 能够明显抑制细胞的增殖和存活。RSL3 对 IEC-6 细胞的存活影响具有浓度相关性(图1A)。在培养体系中加入丹参酮 IIA 能够保护 RSL3 诱导的 IEC-6细胞死亡。铁死亡抑制剂 Fer-1 具有同样的生物学作用(图1B)。
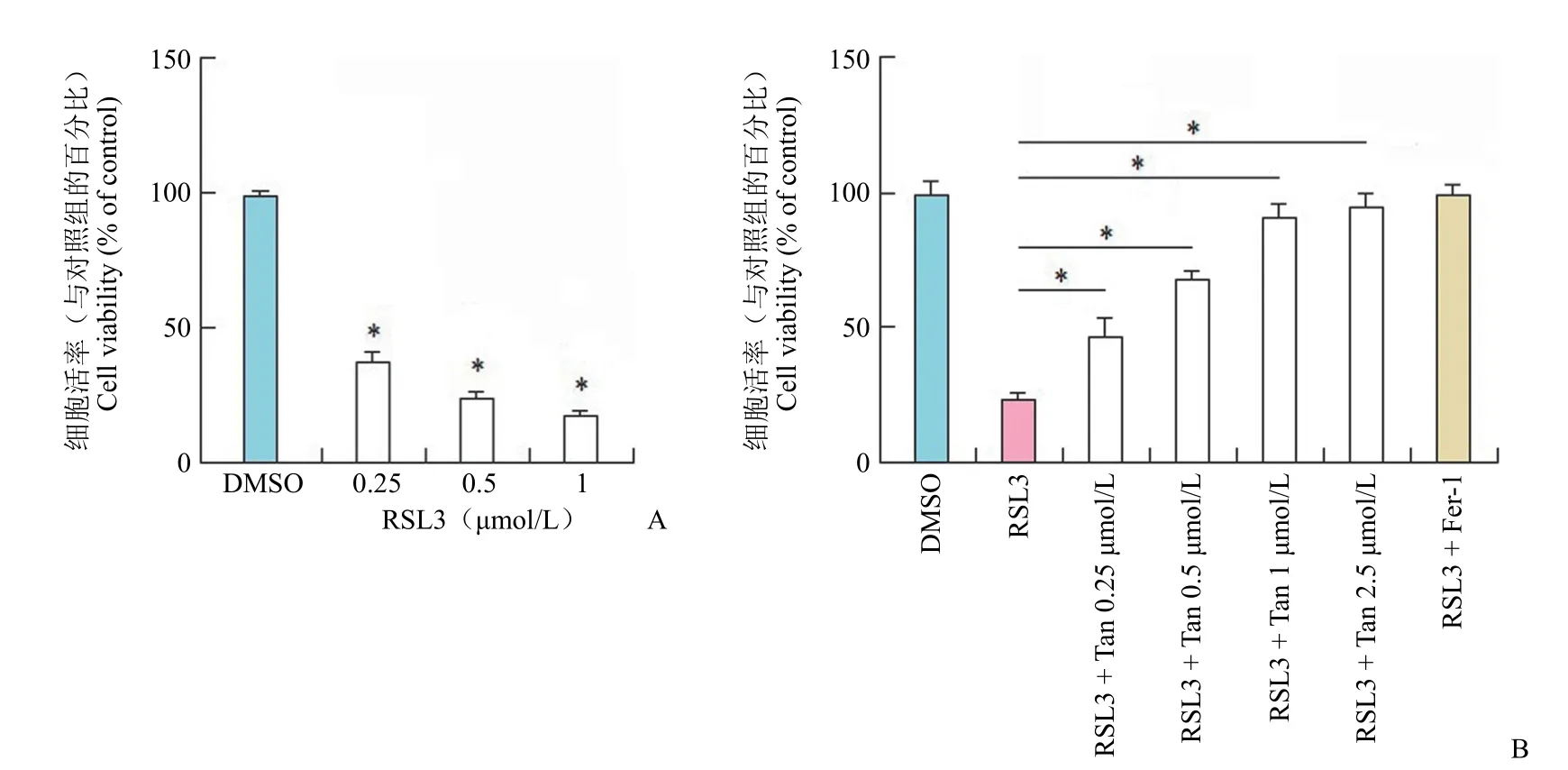
图1 丹参酮 IIA 对 RSL3 诱导细胞死亡的保护作用[A:不同浓度(0.25、0.5、1 μmol/L)的铁死亡诱导剂 RSL3 对 IEC-6细胞活率的影响,*P < 0.001,与 DMSO 组相比;B:不同浓度的丹参酮 IIA(0.25、0.5、1、2.5 μmol/L)与铁死亡抑制剂Fer-1(1 μmol/L)对 RSL3 诱导的铁死亡保护作用,*P < 0.001,与 RSL3 组相比]Figure 1 The protective effects of tanshinone IIA on RSL3 induced cell death [A: Effects of different concentrations of ferroptosis-inducer RSL3 (0.25、0.5、1 μmol/L) on the viability of IEC-6 cells,*P < 0.001 vs DMSO group; B: Effects of different concentrations of tanshinone IIA (0.25、0.5、1、2.5 μmol/L) and ferroptosis inhibitor Fer-1 (1 μmol/L) on RSL3 induced ferroptosis,*P < 0.001 vs RSL3 group]
2.2 丹参酮 IIA 抑制 IEC-6 铁死亡的细胞形态学观察与 ROS 检测
细胞铁死亡具有典型的形态学改变,RSL3 能够促进细胞的铁死亡,在 IEC-6 细胞内培养体系中加入不同的药物浓度 RSL3(0.5 μmol/L),RSL3(0.5 μmol/L)+ Fer-1(1 μmol/L)。24 h 后显微镜下呈现典型的细胞铁死亡的改变,胞浆被染成粉红色,RSL3 诱导的细胞死亡,细胞大小皱缩,核和胞浆固缩,胞浆结构完全消失,细胞缺乏完整性。而不同浓度的丹参酮 IIA 处理 RSL3(0.5 μmol/L)诱导的 IEC-6 细胞,能够挽救 RSL3 诱导的IEC-6 细胞铁死亡(图2A)。透射电子显微镜观察了 RSL3 以及丹参酮 IIA 处理后的细胞器微观表现,DMSO 处理的对照组细胞,细胞器大小形态正常,RSL3 处理后可以观察到线粒体膜碎裂,线粒体嵴减少或消失,线粒体膜和核膜密度增高,丹参酮 IIA 处理后细胞和线粒体形态恢复正常(图2B)。通过 ROS 检测,RSL3 组明显提高了细胞内 ROS 水平,丹参酮 IIA 处理后显著降低了ROS 水平(图2C)。
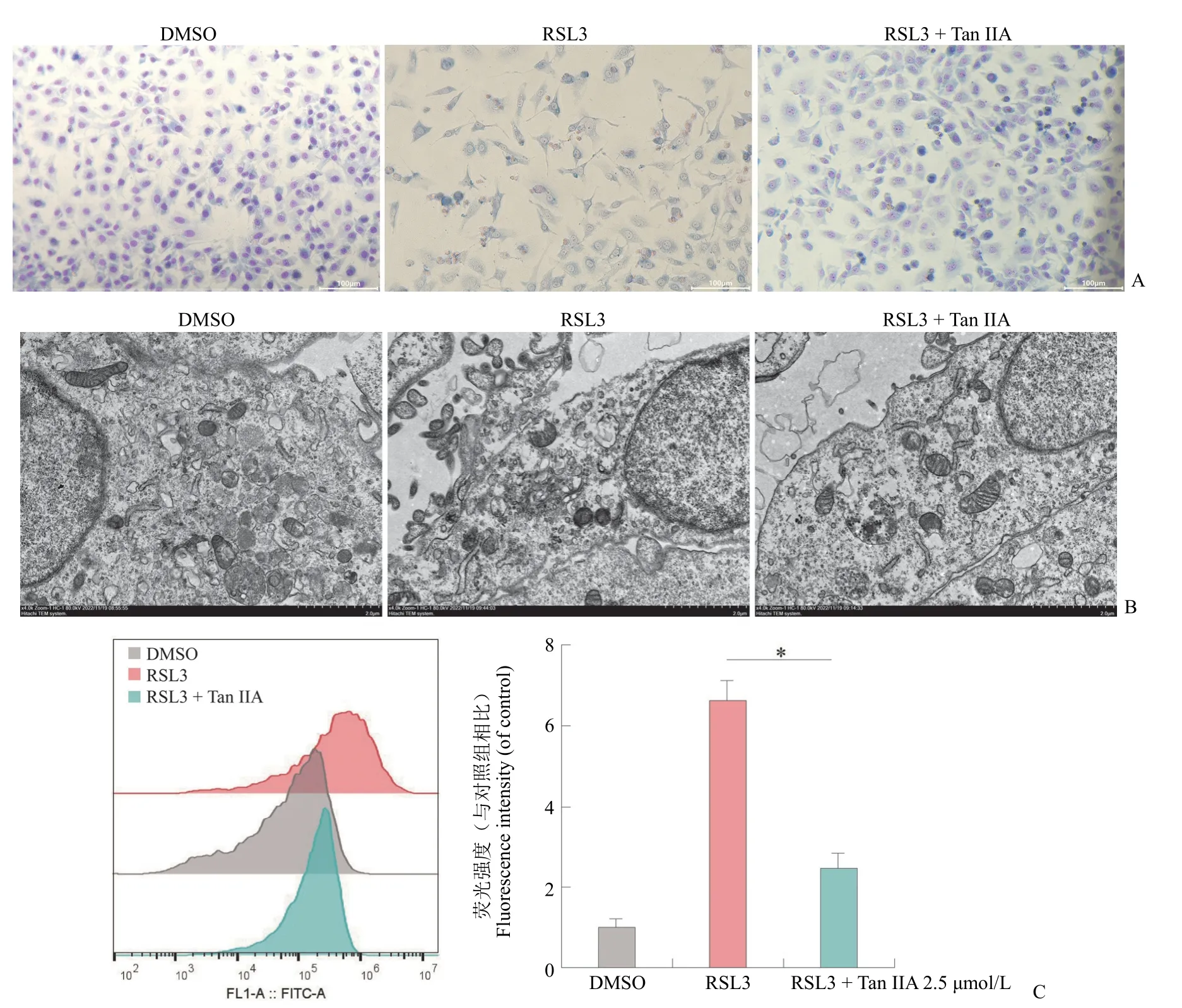
图2 丹参酮 IIA 对 IEC-6 铁死亡的形态学观察与 ROS 水平(A:姬姆萨染色观察 RSL3 及丹参酮 IIA 处理后的细胞形态,比例尺 100 μm;B:透射电子显微镜观察 RSL3 及丹参酮 IIA 处理后的细胞超微形态,比例尺 2 μm;C:流式细胞术检测 RSL3 及丹参酮 IIA 处理后的细胞内 ROS 的含量,*P < 0.001,与 RSL3 组相比)Figure 2 Morphology of IEC-6 cells treated with tanshinone IIA and ROS levels (A: Giemsa staining of IEC-6 cell morphology after treated with RSL3 and tanshinone IIA,scale bars 100 μm; B: Transmission electron microscopy observation of cell ultrastructure after treated with RSL3 and tanshinone IIA,scale bars 2 μm; C: Flow cytometry detection of intracellular ROS after treated with RSL3 and tanshinone IIA,*P < 0.001 vs RSL3 group)
2.3 丹参酮 IIA 影响 IEC-6 铁死亡的细胞代谢组学变化
在 RSL3 组和 RSL3 + 丹参酮处理组比较时,对差异代谢物采用单变量统计分析方法,对代谢组学正、负离子模式下检测到的所有代谢物进行差异比较分析,红色代表RSL3 + 丹参酮 IIA 组上调的代谢物,蓝色代表RSL3 + 丹参酮 IIA 组下调的代谢物,黑色为非差异代谢物。丹参酮 IIA处理明显影响 IEC-6 铁死亡细胞的代谢物变化(图3)。
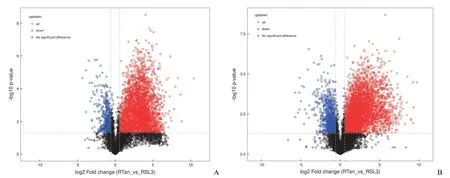
图3 丹参酮 IIA 对 IEC-6 铁死亡细胞的代谢物影响[正(A)、负(B)离子模式差异代谢物火山图]Figure 3 Effects of tanshinone IIA on metabolites of RSL3 induced ferroptosis [Volcano plot of the differential metabolites in the positive (A) and negative (B) ion modes]
在丹参酮 IIA 处理与 RSL3 组比较的差异代谢物中,正离子模式中调节差异代谢产物包括L-丙氨酸、6-氨基青霉烷酸、谷胱甘肽、磷酸胆碱等正离子代谢物,而负离子模式差异代谢物包括Ala-Gln、黄连素、橙皮素、牛磺酸、2'-羟基-4'-甲氧基苯乙酮和柠康酸等(图4)。
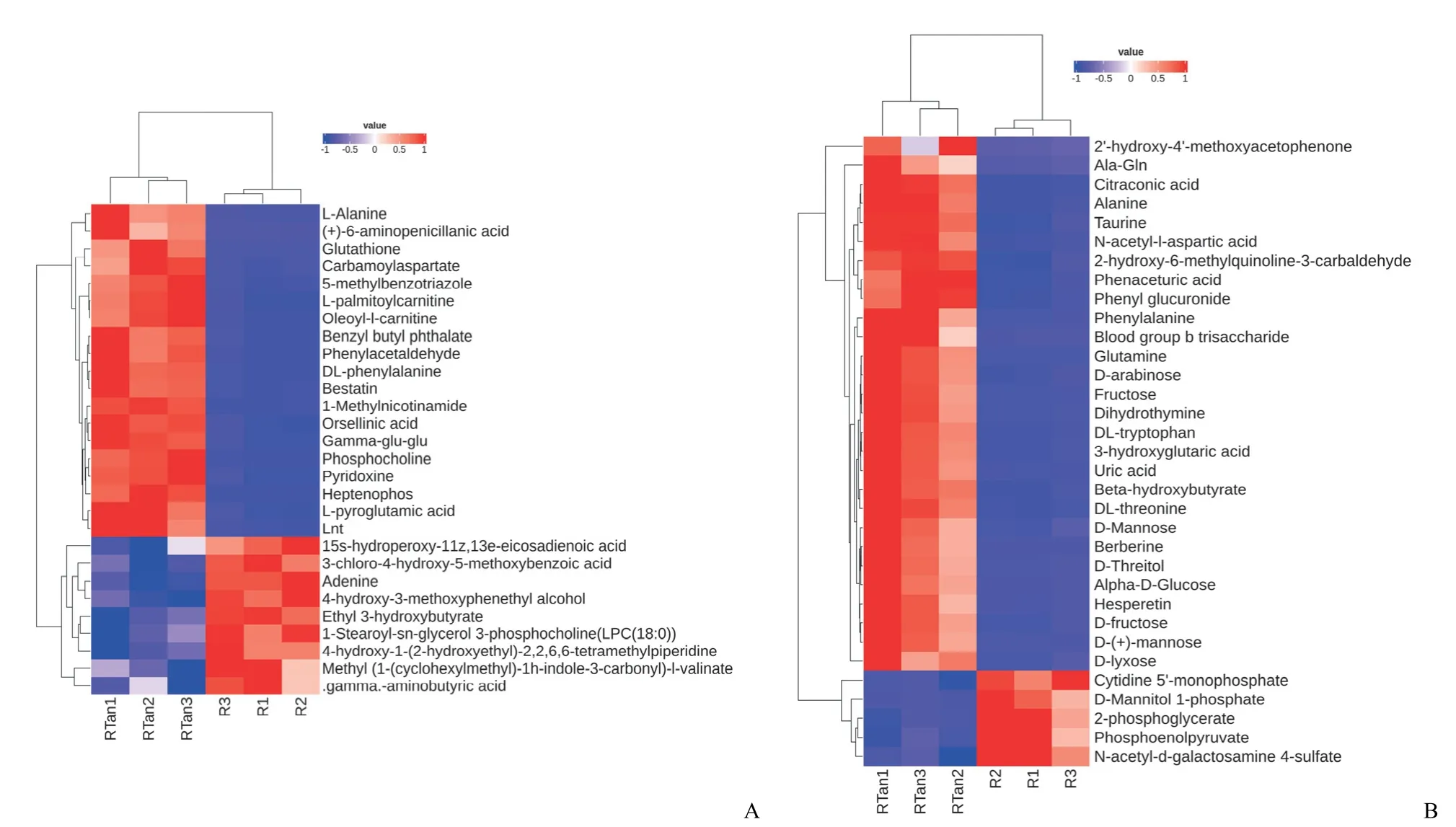
图4 正(A)、负(B)离子模式显著性差异代谢物层次聚类热图(每行表示一个代谢物,每列表示一个样本(RTan 为 RSL3+ 丹参酮 IIA 组,R 为 RSL3 组),红色表示显著性上调代谢物,蓝色表示显著性下调代谢物)Figure 4 Hierarchical clustering heatmap of differential metabolites in the positive (A) and negative (B) ion modes (Each row represents a metabolite,each column represents a sample (RTan is RSL3 + tanshinone IIA group,R is RSL3 group),the red color indicates significantly up-regulated metabolites,and blue color indicates significantly down-regulated metabolites)
图5 是 KEGG 通路富集图,展示的是各个通路代谢物富集程度的显著性水平,以确定受到显著影响的代谢和信号转导途径。代谢通路富集分析结果以气泡图形式展示,可以看到具有显著差异的mTOR 代谢通路、肿瘤相关通路及涉及的谷氨酸代谢等重要的通路。

图5 KEGG 富集通路气泡图(RSL3 + 丹参酮 IIA 组与 RSL3 组相比,富集到的差异代谢通路,纵坐标表示通路名称,横坐标表示通路对应的富集因素大小,颜色代表富集分析的 P 值,颜色越深,P 值越小,富集程度越显著)Figure 5 KEGG enrichment analysis of metabolic pathways (RSL3 + tanshinone IIA vs RSL3 group,the differential enriched metabolic pathways,the vertical coordinate represents the pathway name,the horizontal coordinate represents the size of rich factor corresponding to the pathway,and the dot color represents the P value of enrichment analysis,the darker color represents the smaller P value and the more significant enrichment degree)
2.4 丹参酮IIA 影响 GPX4 的表达
GPX4 是抑制细胞铁死亡的重要基因,也是谷胱甘肽代谢的重要调控基因。通过构建丹参酮 IIA抑制 IEC-6 细胞铁死亡模型,RT-qPCR 及 Western blot 检测了细胞 GPX4 的表达,丹参酮IIA明显上调 GPX4 的表达(图6),证明 GPX4 上调可能是丹参酮 IIA 调控谷胱甘肽代谢的重要机制。
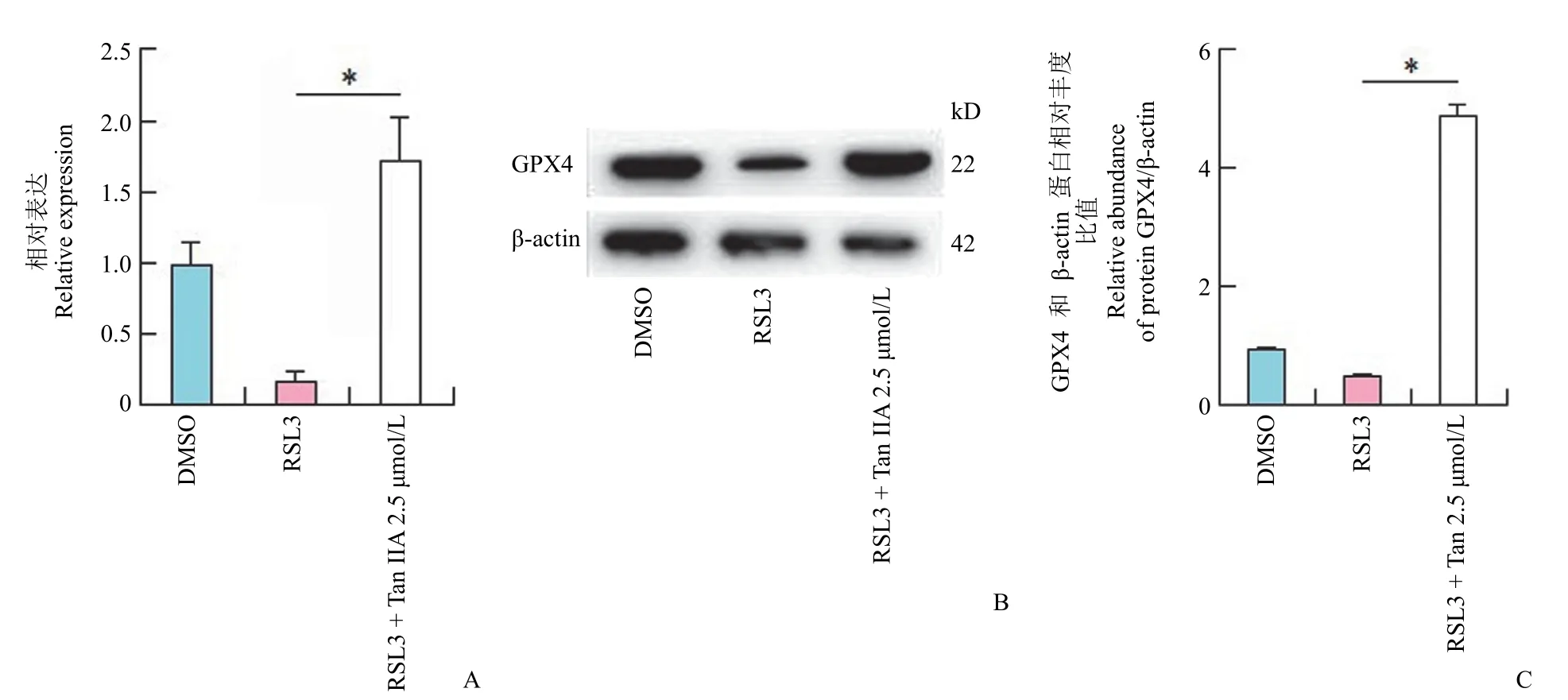
图6 RT-qPCR 与蛋白印迹检测 GPX4 表达(A:RT-qPCR 检测 GPX4 的表达;B:蛋白印迹检测 GPX4 的表达;C:蛋白印迹条带灰度值检测 GPX4 的相对表达量。*P < 0.001,与 RSL3 组相比)Figure 6 RT-qPCR and Western blot detection of GPX4 expression (A: The expression of GPX4 by RT-qPCR; B: The expression of GPX4 by Western blot; C: The relative abundance of GPX4 proteins by gray values.*P < 0.001 vs RSL3 group)
3 讨论
众多的研究证明,铁死亡在消化系统疾病的进展中起着关键的作用,如酒精性肝病、药物性肝损伤及结肠炎等[12-14]。铁死亡是一种公认的以脂质过氧化和活性氧积累为特征的细胞程序性死亡机制[15]。铁死亡参与 IBD 发生和发展,并已经成为IBD 治疗的新靶点[16]。肠道上皮细胞铁死亡与肠上皮的功能障碍有关。目前,肠道细胞铁死亡模型的缺乏限制了 IBD 有效抑制剂的筛选,IEC-6 细胞取自成年大鼠小肠隐窝细胞,可以作为 IBD 机制研究新的模型。我们利用 RSL3 处理 IEC-6 细胞建立了肠上皮细胞的铁死亡模型。RSL3 是 GPX4的抑制剂,与 GPX4 共价结合使 GPX4 失活,导致细胞内过氧化物的堆积,引发铁死亡。RSL3 能够导致 IEC-6 细胞的铁死亡,而铁的螯合剂(Fer-1)能够明显抑制 RSL3 诱导细胞铁死亡。进一步使用不同浓度的丹参酮 IIA 处理 RSL3 诱导的 IEC-6 细胞,通过 CCK8 检测细胞活率和姬姆萨染色显示丹参酮 IIA 可以挽救 RSL3 诱导的IEC-6 细胞死亡,并且在 0.5 μmol/L 时即具有细胞保护作用,且保护作用与丹参酮 IIA 的浓度梯度成正比。进一步我们通过透射电子显微镜观察了RSL3 以及丹参酮 IIA 处理后的细胞器微观形态,DMSO 处理的对照组细胞,细胞器大小形态正常,RSL3 处理后可以观察到线粒体膜碎裂,线粒体嵴减少或消失,线粒体膜和核膜密度增高,符合细胞铁死亡的微观形态学特征。丹参酮 IIA 处理后细胞和线粒体形态恢复正常。通过 ROS 检测,RSL3组明显提高了细胞内 ROS 水平,丹参酮 IIA 处理后显著降低了 ROS 水平。从形态学和 ROS 产生等确定了丹参酮 IIA 对肠上皮细胞铁死亡的抑制作用。
丹参酮 IIA 具有非常强的抗炎和抗氧化的功能。丹参酮 IIA 能够抑制 AOM/DSS 处理后的肿瘤形成,并抑制中性粒细胞浸润和肠道炎症[17]。丹参酮 IIA 通过激活 PI3K/Akt/mTOR 途径抑制缺血再灌注诱导的炎症、铁死亡和细胞凋亡[18]。丹参酮 IIA 能够改善心肌细胞的凋亡诱导内质网应激。丹参酮 IIA 激活多种细胞调节信号,包括MAPKs/NF-κB 通路以及 DAXX/MEK/ERK1/2 等途径[19-20]。细胞代谢组学研究为阐释肠上皮细胞机制提供新的方向。利用代谢组学技术进一步探索了丹参酮 IIA 对细胞铁死亡代谢特性的影响,利用模型组显著性差异代谢物进行层次聚类分析,正离子模式中调节代谢产物包括 L-丙氨酸、6-氨基青霉烷酸、谷胱甘肽、2'-羟基-4'-甲氧基苯乙酮和柠康酸等。KEGG 富集分析确定了丹参酮 IIA 与谷氨酰胺代谢通路密切相关。GPX4 是谷胱甘肽过氧化物酶家族中的一员,能够将细胞毒性脂质过氧化物(L-OOH)还原为无毒脂质醇(L-OH)或者催化过氧化氢成为水,GPX4 活性对于维持细胞中的脂质稳态、防止有毒脂质 ROS 的积累、阻止氧化应激反应的发生与发展,最终保护组织细胞免受过氧化损伤具有重要作用[21]。作为 GPX4 催化过氧化物转化为醇的协同因子,谷胱甘肽缺乏会引发半胱氨酸缺乏,将直接失活 GPX4,引发铁死亡。细胞内半胱氨酸是谷胱甘肽的重要前体,在细胞铁死亡过程中,GPX 通过合成还原型谷胱甘肽减少过氧化物相关产物并保护细胞免于活性氧诱导的损伤[22]。另外,谷氨酸盐-胱氨酸转运体 Xc-系统,主要成员包括 SLC7A11/xCT 和 SLC3A2 等,将细胞外胱氨酸转运到细胞中,参与半胱氨酸和GSH 合成。因此,GPX4 和 SLC7A11 等参与具有调节膜脂质氧化功能的酶成为细胞铁死亡的重要调控分子[23]。谷胱甘肽系统表现为抗氧化体系并降解小分子过氧化物和某些脂质过氧化物,抑制脂质过氧化[9]。通过代谢组学确定丹参酮 IIA 上调了细胞内谷胱甘肽的含量,进一步检测到丹参酮 IIA上调肠上皮细胞 GPX4 的表达。上述结果说明了丹参酮 IIA 阻断了 RSL3 抑制 GPX4 的作用,其机制可能是通过上调谷胱甘肽的含量及调控GPX4 信号通路来实现铁死亡的抑制作用。
靶向铁死亡已经成为新的 IBD 治疗策略。在IBD 患者受损的胃肠道细胞中表现出铁死亡的基本特征,包括铁沉积、谷胱甘肽衰竭、GPX4 失活和脂质过氧化等[24]。通过抑制芳烃受体(AHR)能够抑制肠上皮内淋巴细胞铁死亡,减轻肠道免疫反应[25]。而间充质干细胞等能通过 MUC-1 通路抑制细胞铁死亡而参与影响肠道菌群和相关的治疗[26]。甘草素对结肠炎有明显的缓解效应,其机制是通过Prdx-6 诱导的上皮细胞铁死亡[27]。丹参酮 IIA 作用机制可能与 CLA 激活 PPARγ 基因、阻断下游NF-κB 信号通路、下调炎症因子的表达、上调肠黏膜屏障保护因子的蛋白表达有关[28]。因此,在体外模型中阐释的丹参酮 IIA 对上皮细胞铁死亡的抑制作用可能与上述机制有关,具体仍需探讨。总之,丹参酮 IIA 能够有效抑制肠上皮细胞的铁死亡,调控谷胱甘肽的代谢和 GPX4 表达。靶向上皮细胞铁死亡可能是丹参酮 IIA 治疗炎性肠病的重要机制。

