弹性对比指数辅助甲状腺结节ACR-TIRADS精细化分类的临床研究
葛喜凤,崔立刚,李磊
目的 应用弹性对比指数对甲状腺 ACR-TIRADS 4 类的结节再分层,研究弹性成像对中度可疑结节细化分类的可行性,并与初始 TIRADS 分类系统诊断效能进行比较。
方法 纳入 136 人 194 例获得病理结果的甲状腺结节,应用 ACR-TIRADS 进行分类,并测量弹性对比指数(ECI)。依据 ECI 将 ACR-TIRADS 4 类结节细分为 4a 和 4b。比较两种方法诊断效能。
结果 ROC 曲线下面积最大的是加入 ECI 分层的TIRADS(0.872),其次是 ACR-TIRADS(0.868)。但两者曲线下面积无统计学差异。加入 ECI 对 TIRADS 4 类的结节进行分层后,特异性和阳性预测值较初始 TIRADS 分类提高。
结论 ECI 作为应变弹性成像半定量的方法,能够辅助对TIRADS 4 类的结节进行分层,提高 ACR-TIRADS 特异性和阳性预测值。
数据显示,近年来,我国甲状腺癌发病率迅速上升[1]。甲状腺癌的诊断主要依靠超声引导下细针穿刺抽吸细胞学(FNAC)活检。有研究者报道 60%的 FNAC 并非必须[2]。鉴于甲状腺结节高发病率和临床过度治疗的现状,一些研究者提出了与乳腺结节类似的危险分级系统,即甲状腺影像报告和数据系统(thyroid imaging reporting and data system,TIRADS)[3-5],不同版本的 TIRADS 复杂且不统一,限制其推广应用。2017 年,美国放射学院发布了权威性的 ACR 版 TIRADS 分类系统[6],与之前的分类系统具有较大的差别。ACR 版TIRADS 定义了甲状腺结节相关名词,并赋予结节不同超声征象分值,经综合评估后给出结节总评分并进行分类。此版 TIRADS 系统便于临床应用,结节分类容易实施。然而,ACR 版 TIRADS 分类中良恶性结节的分布概率范围过大,TIRADS 4 类为中度可疑结节,但其恶性的概率仅为 5%~20%,不利于临床实际工作中对甲状腺结节的管理。
第 5 版乳腺影像报告和数据系统(breast imaging reporting and data system,BIRADS) 已经加入乳腺结节的弹性成像,已有研究报道加入弹性成像的 BIRADS 敏感性、特异性、准确性较未加入的 BIRADS 有所提高[7]。在临床实践中,低特异性是二维超声诊断甲状腺结节的主要问题,弹性成像的加入有助于鉴别甲状腺结节良恶性。本研究尝试评估应用弹性对比指数(ECI)对 TIRADS 4 类的结节分层后的诊断效能,并与初始 ACR TIRADS进行比较,旨在利用弹性成像对中度可疑结节进行分层,进一步精细化管理甲状腺结节。
1 资料与方法
1.1 研究对象
选取 2016 年 12 月 – 2017 年 12 月本院门诊或住院治疗的患者。入选标准为:①来我院超声科检查并拟手术切除甲状腺结节的患者;②心功能无异常,颈动脉无严重狭窄或闭塞;③同意参加本研究,签署知情同意书。本研究共评估了 166 人,共 232 个甲状腺结节,其中 1 人无法获得符合质控的 ECI,1 人因未能手术无法获得病理结果,8 人因结节呈囊实性,28 个结节因结节位置过深被排除本研究。最终本研究共入组 136 人,194 个甲状腺结节入选。本研究通过北京大学第三医院医学科学研究伦理委员会审批。
1.2 方法
1.2.1 超声扫检 采用 Samsung RS80A 超声诊断仪,LA4-18B 高频线阵探头,内置甲状腺扫查条件,彩色多普勒量程设置在 3.9 cm/s。
所有患者在手术前一天进行甲状腺结节的常规超声扫查并进行 TIRADS 分类、ECI 评估。检查由具有五年超声工作经验、经过 ACR TIRADS培训的同一医生进行,该医生在检查时并未被告知患者的临床信息及结节的 FNAC 结果。患者取仰卧位,颈后垫枕,使头轻度后仰。首先进行二维超声检查,扫查甲状腺结节的位置、大小、边界、内部回声、有无钙化等超声特征。
1.2.2 ACR-TIRADS 评分 由以下 5 项所得分数的相加确定结节的 TIRADS 评分[6]:①内部结构(单选):囊性或几乎全囊性 0 分,海绵样 0 分,囊实性混合性 1 分,实性或几乎全实性 2 分;②回声(单选):无回声 0 分,高或等回声 1 分,低回声 2 分,极低回声 3 分;③形状(单选):非竖立生长 0 分,竖立生长 3 分;④边缘(单选):光整 0 分,模糊 0 分,分叶或不规则 2 分,甲状腺外侵犯 3 分;⑤强回声灶(多选):无或伴大彗星尾征 0 分,粗大钙化 1 分,边缘钙化2 分,点状钙化 3 分。
确定 ACR-TIRADS 分级[6]:总分 0 分为TIRADS 1 类,总分 2 分为 TIRADS 2 类,总分3 分为 TIRADS 3 类,总分 4~6 分为 TIRADS 4 类,总分 ≥ 7 分为 TIRADS 5 类。
1.2.3 ECI 评估 选定要测量的切面,将靶结节置于图像中央,探头轻置于皮肤表面保持稳定。启动 ECI 功能,在患者未进行吞咽动作时,嘱患者屏住呼吸 3~4 s 直至符合仪器质控条件(即右上角质控条全部变绿),获得结节同侧颈动脉搏动压力下 4~5 s 结节应变动态图,冻结图像。划定结节感兴趣区时,感兴趣区的划定既可以完全位于结节内部,也可以包含少量的周边实质。此时,弹性框内硬的区域显示为红色,软的区域显示为蓝色。屏幕的右上角显示硬度量程。多边形划定感兴趣区(应避免颈动脉出现在 ROI 中),获得 ECI 值。根据结节声像图特征分别在横断面、纵断面及二维最不均质切面分别重复以上操作,获得 ECI 值。分别记录 3 次 ECI 数值,以获得的最大值作为ECI 最终数值。
根据ROC曲线确定 ECI 最佳界值,对 ACR TIRADS 4 类的结节进行细化分组,分为 4a 类和4b 类。
1.3 统计学处理
采用 SPSS version 20.0 统计软件包进行数据统计。计量资料用±s表示。以P< 0.05 为差异具有统计学意义。为评估良恶性结节的最佳界值,应用了受试者工作特征曲线(ROC)。以约登指数最大时为最佳界值。为评估几种方法诊断效能,计算每种方法的敏感度、特异度、阳性预测值、阴性预测值、诊断准确性。使用 MedCalc 13.0 进行ROC曲线下面积的比较,及三条曲线下面积的两两比较[8]。
2 结果
2.1 一般情况
本研究共 136 人入组,年龄 22~80 岁,平均(46.64±12.28)岁,约 84% 的患者为女性。超声共发现 194 个甲状腺结节,肿物最大径范围0.3~5.6 cm,平均(1.37±0.95)cm,其中位于甲状腺右叶 84 个,左叶 102 个,峡部 8 个(表1)。所有病例均经手术病理证实。

表1 病例*一般情况Table 1 General cases* information
2.2 最终病理诊断
本研究所有病例均获得石蜡病理确诊。共194 个结节入组,包含 136 个恶性、58 个良性结节。具体病理情况见表2。
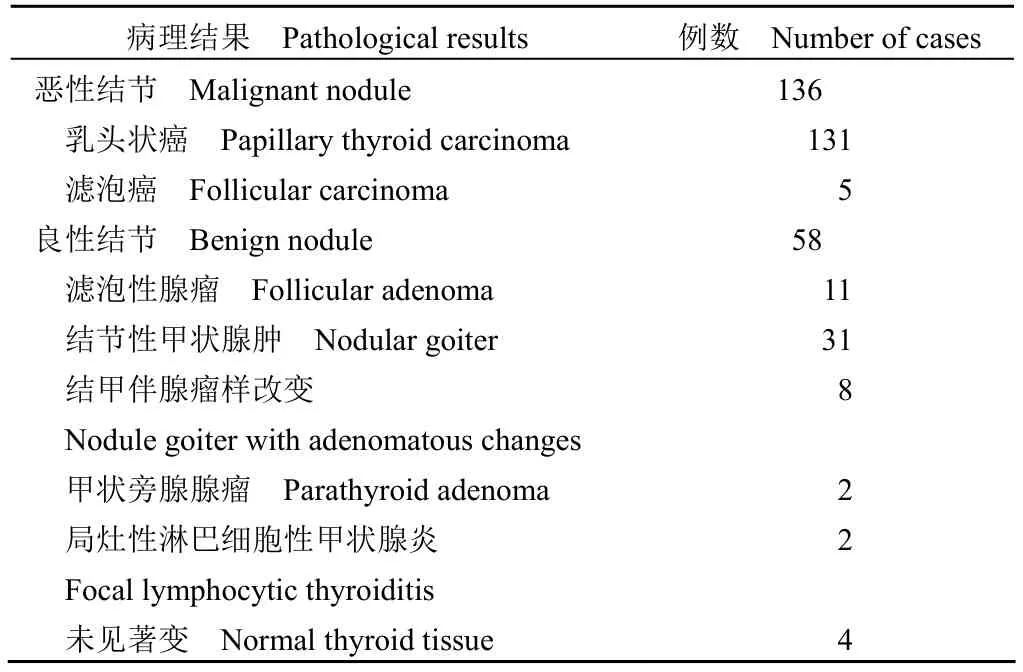
表2 最终病理诊断Table 2 Final pathological diagnosis
2.3 TIRADS 的诊断表现
2.3.1 结节整体的 TIRADS 分类及 ECI 测值分布 甲状腺结节 ACR-TIRADS 分类见表3。ACR-TIRADS 1~3 类的恶性率较低,4 类和 5 类恶性率提高至 60.5% 和 91.6%。ECI 阳性的病例在 ACR-TIRADS 1~5 类中所占的比例分别为0%、30%、19.2%、23.7%、73.9%。

表3 TIRADS 分类和危险分层Table 3 TIRADS classification and hazard stratification
2.3.2 可疑超声特征 对于 136 例恶性结节,实性、低回声(包含极低回声)、竖立生长、边缘不规则、微钙化 5 种超声特征出现的概率分别为99.3%、95.6%、47.8%、83.8%、44.1%。同时含有5 种可疑超声特征的甲状腺结节可被正确分类到TIRADS 5 类,而分到 TIRADS 4 类结节最常有的超声特征为实性、低回声及边缘不规则;而错误分到 2~3 类的结节只有实性甚至没有任何超声可疑特征(图1)。五大超声特征中,边缘不规则在鉴别诊断良恶性结节中的意义最大(AUC0.819),低回声的敏感性最高,纵横比的特异性和阳性预测值最高(表4)。
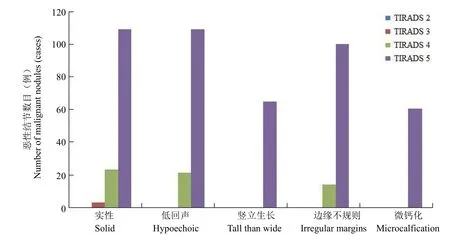
图1 恶性结节超声可疑二维特征在 TIRADS 中的分布柱状图Figure 1 Distribution histogram of suspicious two-dimensional ultrasonic characteristics of malignant nodules in different TIRADS classification

表4 超声特征及 TIRADS 总分的诊断效能Table 4 Diagnostic efficiency of ultrasonic characteristics and total TIRADS score
ACR TIRADS 分类ROC曲线下面积为0.868,以 TIRADS 1~3 类诊断为良性结节,以TIRADS 4~5 类诊断为恶性结节,敏感度为97.1%,特异度为 56.9%,阳性预测值为 84.1%,阴性预测值为 89.1%,诊断准确性 85.1%。
2.3.3 ACR-TIRADS、ECI 及加入 ECI 分层后TIRADS 鉴别甲状腺结节的诊断效能ROC曲线下面积最大的是加入 ECI 分层后的 TIRADS(0.872),其次是ACR-TIRADS(0.868)。使用MedCalc 13.0 进行三条ROC曲线下面积的两两比较,发现加入 ECI 分层后的 TIRADSROC曲线下面积与初始 TIRADS 无统计学差异(P= 0.19);而两者与 ECIROC曲线下面积均有统计学差异(P= 0.005,P= 0.003)。
加入 ECI 对 TIRADS 4 类的结节(38 例)进行分层后,特异性和阳性预测值较原 ACR TIRADS 分类明显提高,但伴随敏感性和阴性预测值的下降(表5、图2)。
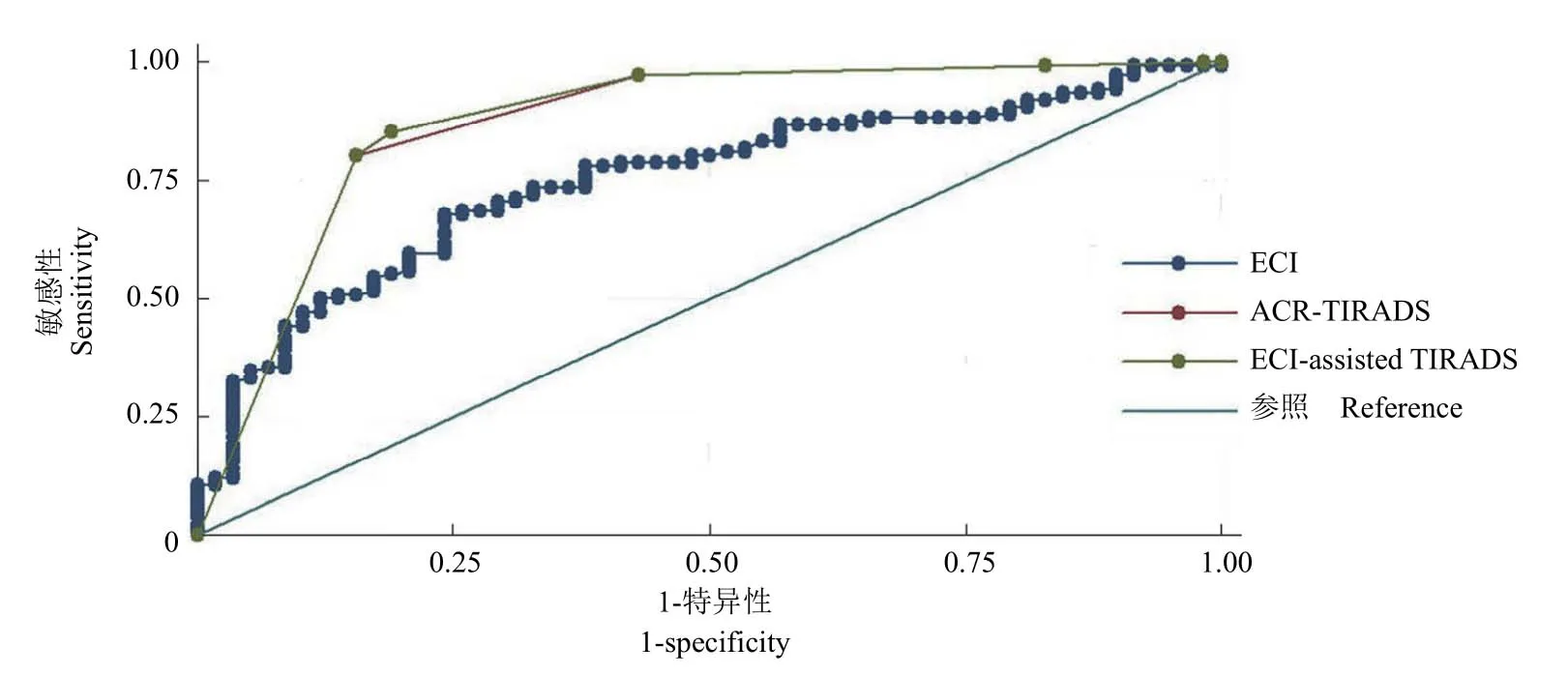
图2 TIRADS、ECI 和加入 ECI 分层后的 TIRADS ROC 曲线图Figure 2 The ROC curve of TIRADS、ECI and ECI-assisted TIRADS
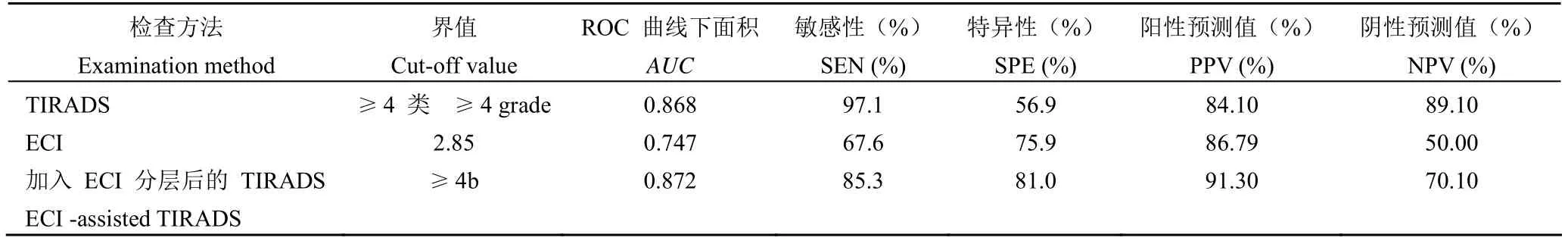
表5 TIRADS、ECI 及加入 ECI 分层后的 TIRADS 的诊断效能Table 5 Diagnostic efficiency of TIRADS、ECI and ECI-assisted TIRADS
3 讨论
弹性对比指数的检查方法是一种利用颈动脉搏动作为应力的应变弹性成像。这种方法是基于恶性结节比良性结节软硬更不均一[9]。前期研究发现,良恶性结节间 ECI 均值具有差异,但并非所有的恶性结节都会有不均一性的改变,如滤泡癌,这就导致了 ECI 的假阴性率增高[10]。但本研究的数据显示,ECI 的特异性明显高于二维超声,这提示ECI 应用于 TIRADS 4 类分层的可能性。
对于低度可疑结节,即 TIRADS ≤ 3 类,其恶性可能小于 5%,可进行临床随访;对于高度可疑结节,即 TIRADS 5 类,其恶性可能大于 20%,结节最大径大于 1 cm 即可进行 FNAC 或手术治疗。TIRADS 4 类是中度可疑的结节,恶性率 5%~20%。ACR-TIRADS 对于 4 类的处理建议是大于1.5 cm 进行 FNAC,大于 1 cm 进行临床随访[6]。然而,在临床实践中,患者对于超声提示可疑,划分为 TIRADS 4 类的结节,往往处于过度焦虑的状态,倾向于立即进行 FNAC 或手术治疗以明确诊断;对于 4 类的细化分组能够对可疑结节更精细分层,尽早筛选出恶性的甲状腺结节,缓解患者的焦虑情绪,减轻患者的心理负担。
Schenke 和 Zimny[11]应用应变弹性成像和Kawk-TIRADS 评估了 244 个甲状腺结节,其方法为当 TIRADS ≥ 4c 或(且)弹性表现阳性判定为恶性。发现 TIRADS 本身的诊断效能高于弹性,这在本研究也得到了证实。并发现当 TIRADS 结合弹性时,其诊断效能下降了,敏感性、特异性由82.6%、87.9% 降低至 80.6%、28%,并得出 TIRADS本身的诊断效能较好,弹性价值微不足道。而本研究认为,弹性结果与 TIRADS 结果不能简单相加来判定良恶性,尤其不能只依赖弹性来判定,二维超声是基础,弹性结果是二维超声的补充。这正是本研究不只根据弹性进行分层的原因。
已有研究者将弹性成像增加到 BIRADS 分类中,并发现较二维超声提高了特异性和诊断的准确性[7,12]。Fleury Ede[7]回顾性地评估了 929 个乳腺结节,先根据 BIRADS 进行分类,结节的弹性结果被分为软、中、硬;当结节处于中间硬度时,保持原 BIRADS 分类不变;当结节较软时,BIRADS 分类降至低一级别;当结节较硬时,BIRADS 分类升至高一级别。发现当 BIRADS 结合弹性成像时,敏感性、特异性和诊断准确性分别从 93.85%、72.07%、76.64% 提高至 95.90%、80.65%、91.39%。但较少有研究者将弹性补充到 TIRADS 分类中,本研究将 ECI 加入到 TIRADS 4 类中进行分层,以 2.85 为界值,将 ECI 值高的分为 4b,ECI 值低的分为 4a;ROC曲线下面积达 0.872,尽管ROC曲线下面积比较两者未发现统计学差异,但较原 TIRADS 可以提高特异性(从 56.9% 到81.0%)和阳性预测值(从 84.1% 到 91.3%)。
二维超声是现行指南中管理甲状腺结节最主要的诊断工具[6,13]。本研究发现,可疑的超声特征中低回声、纵向生长、边缘不规则、微钙化与恶性的病理结果显著相关。在五大超声特征中,以边缘不规则在鉴别诊断良恶性结节中的意义最大,其病理基础为肿瘤的侵袭性生长方式,但边缘不规则也可见于甲状腺炎[14]。五大超声特征中,低回声这一特征的敏感性最高,但是特异性差。有研究报道极低回声的敏感性较低,而特异性较高[15]。对于特异性而言,纵横比这一特征最高,该超声表现的病理基础是肿瘤相对于其他组织降低了可压缩性,有研究报道这仅见于 12% 的甲状腺结节,敏感性介于40%~68%,特异性介于 82%~93%[16-17]。
随着 TIRADS 分级增高,恶性的比例增高。TIRADS 1~3 类的恶性比例较低;这些病变主要是良性的结节性甲状腺肿和滤泡性腺瘤。患者进行手术多因为焦虑或者结节体积大影响美观或压迫气管,以及怀疑滤泡性肿瘤选择手术治疗。
本研究共 5 例滤泡癌,TIRADS 分类均阴性(3 例归为 3 类,2 例归为 4 类),ECI 均阴性,这与之前的研究[10]一致。滤泡癌常常被漏诊。在目前的诊断方法中,滤泡癌的确诊依赖于手术病理,细针穿刺活检与术中冰冻病理均不能确定滤泡性肿瘤的良恶性。在 Sun等[18]进行的 meta 分析中发现,只有 11 例滤泡癌被报道,10 例弹性成像阴性。Götzberger 等[19]研究也发现,3 例滤泡癌中仅有 1 例由于属于高级别肿瘤阶段,因此二维和弹性才表现为阳性。对于滤泡癌这种软结节,弹性似乎没有帮助,二维图像中肿瘤的生长方式是决定TIRADS 分类的主要因素。
本研究的局限性在于是以手术病理作为金标准,虽然避免了以 FNAC 作为金标准所造成的取样误差和假阴性率,但入组的病人多为高度可疑恶性的结节或滤泡性肿瘤,这使得本组病例中恶性结节的比例(136/194)偏高,并不符合临床流行病学的实际情况。但这也证实了 ECI 有助于计划手术患者的术前分层。在我国县级医院尚未完全开展FNAC 的国情下,ECI 评估能够减少非必需的手术。
ACR TIRADS 评分可能受到主观性的影响,需要经过培训的住院医师以上资质的人员实施,高年资医师可能获得更佳的结果。本研究中,甲状腺结节的 ACR TIRADS 评分是由一位经过 TIRADS评分培训、具有 5 年经验的超声住院医生进行。另外,本研究只纳入了单中心的甲状腺结节,需要多中心、进一步的研究来证实结果的有效性。
ACR-TIRADS 分类系统易于临床应用,可以对甲状腺结节进行初步分层管理。ECI 作为应变弹性成像半定量的方法,能够辅助对 TIRADS 4 类的结节进行分层,提高 ACR-TIRADS 的诊断效能,该研究为弹性加入到 ACR TIRADS 中作为补充提供了一种方法。

