生物医用一氧化氮控释光学功能材料及其在皮肤再生中的应用研究
倪钧钧,郭亮,王素音,朱娜,赵婧,靳国瑞
皮肤是身体与外界环境的保护屏障,也是人体最大的器官。在深度损伤和烧伤的情况下,皮肤愈合过程并不充分,从而导致慢性伤口最终可能导致截肢和死亡。从人口统计学角度看,慢性伤口和愈合障碍患者的数量逐渐达到流行病的比例,并将在人类健康和经济方面造成更大的负担[1-2]。传统的伤口治疗策略是通过外科手术进行皮肤移植,任何直径超过 4 cm 的全层皮肤缺损都需要移植治疗,但可供移植的健康皮肤组织供应不足,临床治疗深度皮肤损伤仍存在挑战。组织工程皮肤是将细胞与支架材料结合,制成具有生物活性的人工皮肤替代物以实现皮肤修复、再生或替代的一种治疗方法[3]。组织工程皮肤可作为伤口床的临时保护层,从而保护受损区域免受液体流失和污染,并通过促进伤口处细胞因子和生长因子的释放加速伤口愈合过程[4]。但现有的组织工程皮肤仍存在一定的局限性,如血管生成减少、机械完整性差、结疤和免疫排斥。由于无法再生成血管,组织工程皮肤替代品中的细胞会死亡并从宿主组织中脱落,导致其使用寿命短并且无法与宿主组织更好融合。再生医学将生物材料、干细胞和活性物质结合,在体内通过某种作用机制,改变病损组织、器官局部的微环境,激活自身(局部或全身)的修复机制,达到组织器官结构、形态的再生以及功能恢复的目的。皮肤再生中常用的活性物质包括小分子药物、生物源材料以及气体信号小分子等[5-6],有望更好地治疗皮肤损伤。再生医学领域中的一种有效策略是结合使用生物材料、干细胞,以及控制保护性分子一氧化氮(nitric oxide,NO)的释放,可以克服单一组成部分的局限性,显著改善组织再生效果。
有证据表明可扩散的自由基气体小分子 NO 在人体的许多生理和病理过程中发挥着关键的作用[7-9]。NO 可由皮肤组织中的几种细胞产生,在整个皮肤的不同细胞中充当自分泌和旁分泌媒介[10]。干细胞受局部 NO 释放的刺激,可以分泌出促进再生和免疫调节的因子,从而为组织修复创造一个有利的微环境[11-12]。内源性 NO 的合成被证实可增强血管平滑肌细胞内血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达,促进血管新生,这是受损组织再生不可或缺的过程[13]。另一方面,人成纤维细胞中的NO 合成可减少伤口愈合早期炎症阶段、后期增殖和组织重塑阶段的生理病理后遗症[14]。然而,NO 在体内会被快速清除、降解,甚至产生急性毒性。
多种 NO 供体如偶氮二醇烯鎓类(N-diazeniumdiolates,NONOates)和 S-亚硝基硫醇类(S-nitrosothiols,SNO)被开发出来用于 NO 的递送。目前已报道的相关综述关注了NO 供体在癌症治疗、组织修复、杀菌抗炎等医学领域中的应用[8,15-20]。但是,NONOates 和 SNO 这些供体在体内酸性环境或谷胱甘肽(glutathione,GSH)作用下会自发释放NO,导致 NO 在体释放可控性差,存在 NO 浓度不可控引起副作用的风险。因此,精确调控 NO 释放成为实现 NO有效调节皮肤再生修复的关键。有机光控释放 NO 的分子具有良好的 NO 供体稳定性及生物相容性,可实现时空调控 NO 释放,有望实现基于 NO 的皮肤再生及修复的精准调控。目前,有机光控释放NO 分子及其在皮肤组织再生中的应用尚未见相关综述报道。为此,本综述总结了有机光控释放 NO 分子,介绍了 NO 释放机制以及在皮肤再生中的应用。
1 NO 调节皮肤再生
皮肤伤口愈合过程分为四个阶段:止血期(伤后 0 到几小时)、炎症期(1~3 d)、增殖期(4~21 d)和重塑期(21 d~1 y)[21]。NO 可通过引起血管扩张,促使伤口炎症细胞浸润。其次,NO 抑制了血小板的聚集。NO 还可以通过与超氧自由基反应产生更具毒性的过氧亚硝酸盐(ONOO-)和羟基自由基(·OH)以杀死病原体[22]。图1 显示了 NO 在伤口愈合每个阶段发挥的作用及相应的浓度变化。
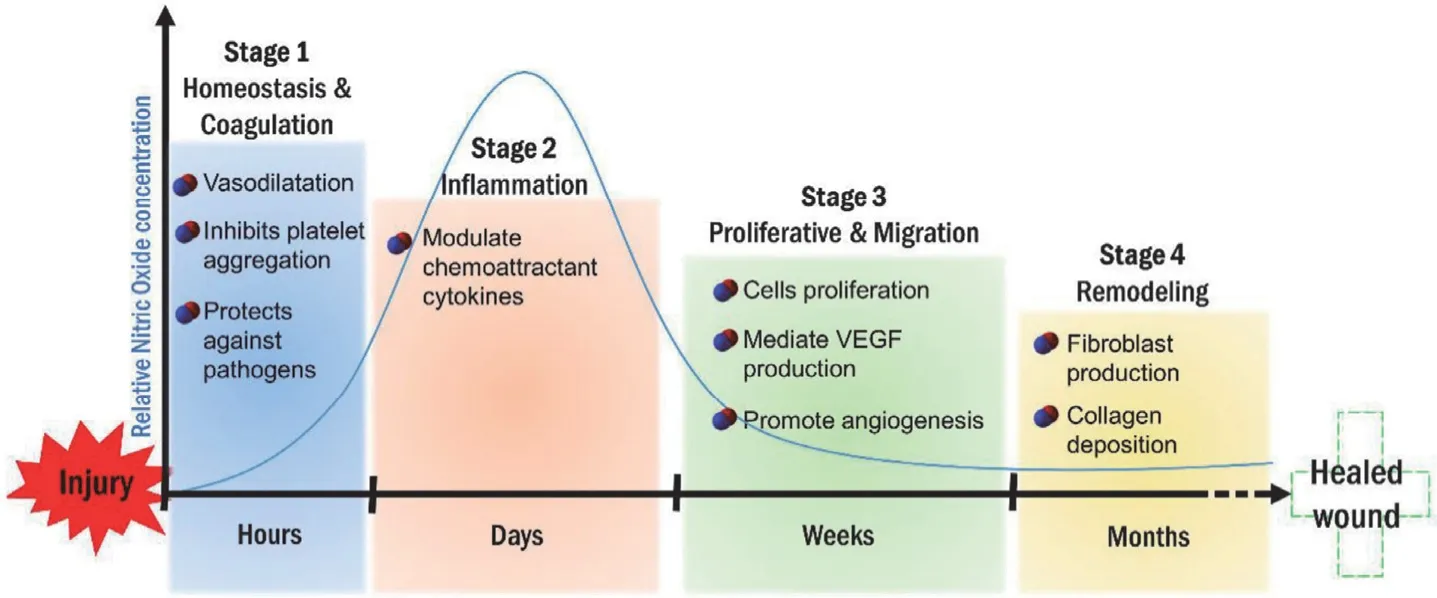
图1 NO 在伤口愈合各个阶段的作用(在最初的损伤后 1~5 d 的炎症阶段 NO 浓度达到高峰,并随着愈合过程向增殖和重塑的方向发展而逐渐下降)[22]
炎症期在伤口形成后立即启动,在急性伤口可持续数小时至数天,在慢性伤口可持续数周甚至数月。研究表明,高水平的 NO 具有促炎作用。在修复的炎症阶段,伤口边缘增生的角质细胞以及少量伤口成纤维细胞可表达诱导型NO 合成酶(inducible nitric oxide synthase,iNOS)[11]。NO 可以诱导创伤部位的细胞产生炎症因子,包括 IL-8 和转化生长因子-β1 以招募单核细胞和中性粒细胞。伤口部位浸润的各种白细胞作为 iNOS 的主要来源,会被激活并开始产生肿瘤坏死因子-α 和 IL-1,这两种物质与伤口的愈合密切相关[23]。如果阻断皮肤中 NO 的产生,炎症反应就会减轻。另一方面,NO 具有抗菌特性,在伤口处的杀菌、限制病原体扩散作用可为随后的增殖期创造良好的条件。NO的抗菌能力取决于其浓度,在低浓度下,NO 可作为一种强效免疫刺激分子介导白细胞和巨噬细胞的活化发挥其抗菌作用。随着 iNOS 激活后 NO 浓度的增加,NO 固有的抗菌特性开始发挥作用。研究表明,iNOS 缺陷小鼠无法抑制李斯特菌的增殖,接种李斯特菌的 iNOS 缺陷小鼠其致死率至少是野生型小鼠的 10 倍[24]。
增殖期开始于皮肤创伤后 48 h 内,持续 2~3 周,由角质细胞、血管内皮细胞和成纤维细胞主导完成再上皮化和形成肉芽组织。再上皮化的形成基于角质细胞的增殖、迁移与分化。NO 可以浓度依赖的方式促进创面边缘角质细胞的增殖。Krischel 等[25]将角质细胞与不同浓度的 NO 供体分子共培养。NO 供体分子二亚乙基三胺/一氧化氮加合物(diethylenetriamine/nitric oxide adduct,DETA/NO)和 S-亚硝基-N-乙酰基-DL-青霉胺(S-nitroso-N-acetyl-DL-penicillamine,SNPA)在细胞内酶降解后可生成 NO,或可在水溶液中自发释放 NO。2 mmol/L 的 DETA/NO 每分钟可产生6.6 μmol/L 的 NO,每摩尔 DETA/NO 可释放 2 mol NO,而 SNPA 释放 NO 的比例为 1:1,尽管 SNPA 的实验浓度更高,但实验结果相同。结果表明,角质细胞对 NO 的反应是双相的。在 0.01~0.25 mmol/L 的低浓度 NO 范围内,角质细胞增殖速度加快;而在 > 0.5 mmol/L 时,出现细胞增殖抑制。相反的,细胞角蛋白 6 的表达在较低 NO供体浓度下减少,而在较高浓度下增加,表明高浓度的 NO会诱导角质细胞分化。
而肉芽组织的形成主要源于内皮细胞与成纤维细胞的增殖以及新血管的形成。体外和体内实验表明,内皮型 NO合成酶(endothelial nitric oxide synthases,eNOS)被激活并形成 NO 可触发内皮细胞的迁移、增殖和分化来促进肉芽组织的形成[26],并介导 VEGF 的产生从而促进血管生成[11]。eNOS 参与了修复过程中毛细血管向伤口部位的生长,而eNOS 缺陷的小鼠血管通透性和血管生成明显降低[26]。Shi等[27]发现 iNOS 敲除会影响成纤维细胞的增殖效率。Krischel 等[25]获得相似结论,当 NO 的浓度 > 0.25 mmol/L时,成纤维细胞增殖受到明显抑制。
重塑期主要通过形成以胶原为主的瘢痕组织以保护伤口。胶原合成和基质重塑是成纤维细胞的关键功能,在伤口愈合中起着关键作用。与正常皮肤成纤维细胞相比,伤口成纤维细胞表现出增殖能力下降,胶原合成增强,基质收缩增强。Shi 等[27]使用 NO 供体 SNPA 将 NO 添加到成纤维细胞中共培养,当外源提供的 NO 浓度增加,胶原合成明显增加。野生型成纤维细胞在 50 μmol/L SNPA 的添加下达到胶原合成峰值,而 iNOS 敲除的成纤维细胞对外源添加的 NO 更为敏感,胶原合成在 25 μmol/L SNPA 的添加下达到最大值。但较高浓度的 SNPA 添加也会抑制两种类型细胞的胶原合成。
应用 NO 供体外源添加 NO 的目的主要是为了模仿iNOS 的作用,即可在较长的时间内合成大量 NO,从而加快伤口愈合过程。但在伤口愈合过程中,NO 不同阶段发挥的功能性作用存在浓度依赖性,这要求损伤部位的 NO 浓度需求受到严格控制。但目前 NO 的供体主要基于NONOate 和 SNO,其广泛应用受到某些限制,其中之一就是 NO 供体释放可控性差,存在浓度不准确,引起副作用的风险。
2 光控释放 NO 的原理与方法
2.1 光控释放 NO 的原理
由于光化学反应容易被光照强度、时间和位置所控制,所以以光作为刺激源的 NO 供体有能力避免 NO 自发释放导致副作用的风险。与各种化学源,如酶、还原剂、氧化性物质和亲核试剂相比,光因其通用性、非侵入性等而广受欢迎[28]。光照控制可以尽量避免生物环境影响,如酸度、碱度、温度、离子强度等。
1997 年,Namiki 等[29]报道 N-亚硝基胺基团可以作为NO 释放单元。N-亚硝基胺的 N-NO 部分显示出极高的NO 释放能力,而且 N-N 键的均裂甚至可以在室温下发生。这些 N-亚硝基胺化合物在生理 pH 值的水溶液中相对稳定,但在紫外/可见光下可以通过 N-NO 键的裂解来释放NO[30](图2)。N-NO 键键能通常非常弱(~39 kcal/mol),其能量与波长为 730 nm 的光子相当[31]。然而,N-NO 基团在光谱的可见/近红外部分表现出非常有限的吸收。所有亚硝基胺化合物通常在 230~240 nm 和 330~350 nm 处显示出紫外吸收[30]。为了实现 N-NO 的有效光裂解,需要在该基团上连接一个具有强吸收力的生色基团。研究证实,N-芳基-N-亚硝胺比 N-烷基-N-亚硝胺具有更高的 NO 释放潜力,因为芳香环和相邻的 N 之间的共振效应增加了NO 的生成能力。此外,芳香环上的吸电子基团可以削弱N-NO 键键能,提高 NO 释放能力。但当共振效应被邻位取代基团削弱或 N-亚硝胺上有笨重的 N 代基团如叔丁基时,它们的 NO 释放能力会减弱[32]。N-亚硝基胺作为一种常见的 NO 释放基团,已被应用于 NO 供体研究领域。这种利用 N-亚硝基胺作为低能量光可控的 NO 释放剂策略已被不同的研究小组所认可和利用。

图2 光控释放 NO 机制
2.2 光控释放 NO 的常用方法和策略
有机光控释放 NO 的分子可由外源光照实现时空调控NO 释放,并根据 NO 释放后分子的荧光信号变化校准 NO释放,而不需要使用额外的 NO 检测方法[33]。杨有军教授团队基于萘酰亚胺分子骨架首次开发了一类新的光控释放NO 分子(NOD545),NO 的释放可以被光触发,并伴随着急剧的荧光开启,这对监测体外研究中 NO 释放的动力学或剂量是有利的。但由于 NOD545 需要 365 nm 的紫外光来触发 NO 释放,应用范围受限[34]。该团队又基于罗丹明分子骨架,开发了系列激发光红移的光控释放 NO 分子,实现了 NO 的可控释放及利用释放后的荧光信号强度变化校准 NO 释放[35-39]。Nakagawa 教授团队以罗丹明骨架取代前期开发的氟硼二吡咯化合物(4,4-difluoro-boradiazaindacene,BODIPY)型 NO 供体分子,将激发光从原有的黄绿光延长至蓝光,减少了短波长激发光造成的组织损伤[40-42]。之后,该团队又以新兴的 Si-罗丹明为骨架开发了红光可控的NO 供体分子 NORD-1,该分子相比团队以往研究成果表现出增强的 NO 释放率,并且可通过红光光源精准控制NO 释放诱导血管扩张[43]。Shen 和 Qian[44]受传统罗丹明型 NO 供体分子启发,以色氨酸-苯胺作为荧光基团,扩展分子 π 电子结构使分子的发射波长达到 631 nm,开发了具有红光发射的 NO 供体分子,避免了生物背景干扰。Xie等[45]通过基于香豆素-萘醌的 FRET 平台设计了一种双光子可激发的 NO 供体分子(CNNO),用于活细胞中 NO 释放的比率成像和跟踪。Sun 等[46]开发了 GSH 和光协同激活的 NO 释放分子 DANO。DANO 在释放 NO 后转化为具有荧光性质的光敏分子 DAPS。DAPS 在产生 I 型活性氧的同时,通过级联反应产生的 ONOO-具有强烈的氧化性,有利于增强乏氧条件下的光动力疗法(photodynamic therapy,PDT)治疗效果。
aza-BODIPY 染料平台在近红外(near-infrared,NIR)波段具有较大的消光系数(> 104 L/mol·cm),可以提供足够的能量来介导 N-亚硝基胺中 N-NO 键的裂解,因此它是一种理想的 NIR 光触发基团[47]。Zhou 等[48]通过连接aza-BODIPY 基团和 N-亚硝基胺 NO 供体基团,合成了第一个有机、NIR 光控的 NO 供体,通过光声断层成像监测小鼠皮下治疗中 NO 的局部和光照依赖性释放。Xu 等[49]基于 aza-BODIPY 基团开发 NIR 型光敏剂和光热剂,通过整合 aza-BODIPY 骨架和 N-亚硝基胺基团,成功开发了具有光热转换“开启”功能的多功能光诱导肿瘤治疗平台,实现 NIR 光激发释放 NO 协同光热治疗。胡进明教授团队报道了系列光控释放 NO 的分子及纳米探针,通过将 NO 供体分子与光敏剂的结合实现了 NO 的 NIR 光可控释放[50-51]。之后,该团队通过将 N-亚硝基胺基团共价连接到 BODIPY 衍生物上,获得第一个可释放 NO 的NIR 光激发 J-聚集体 BDP-NO 分子,BDP-NO 聚集状态的微妙调节使得不同的抗菌方式成为可能,而 NO 释放和光热疗法(photothermal therapy,PTT)的协同抗菌治疗,减弱了 PTT 相关的炎症反应[52]。表1 总结了目前报道的光控释放 NO 分子及其光物理特性。

表1 光控释放 NO 分子及其光物理特性
3 光控释放 NO 分子在皮肤再生中的应用
NO 促进皮肤伤口愈合主要通过抗菌、促血管生成及促进伤口重塑(图3)。但创伤部位高浓度 NO 的聚积会对机体产生损伤作用。因此有效地递送 NO 是实现高效皮肤伤口治疗的关键。NO 必须以有效的浓度及可控方式进行输送,并且输送系统在储存期间必须稳定。为了解决传统的NO 供体都存在 NO 自发释放、半衰期短和药代动力学性能差等问题,研究者们开发了不同的光控释放 NO 递送系统,用以探究 NO 对伤口愈合的作用。

图3 NO 促进皮肤再生的机制主要通过抗菌、促血管生成及促进伤口重塑
3.1 抗菌、促进皮肤再生
Xu 等[61]合成了一系列基于 7-氨基-4-甲基香豆素的N-亚硝基苯胺 NO 供体,并证明通过断裂 N-NO 键可以实现光触发的 NO 释放。这些 NO 供体的稳定性优于传统的NO 供体,并且可以通过调整光照(365 nm)的功率和时间来控制 NO 释放的速率。体外研究表明抗生素与其中一种NO 供体结合不仅可以杀死细菌,还可以根除细菌生物膜。这项研究突显了光控释放 NO 供体在伤口愈合和抗菌治疗中的潜力,然而由于激发波长短,它只能穿透较浅的组织,这限制了它在生物医学领域进一步的应用。
使用光控释放 NO 供体的一大挑战是调整激发波长,使其进入适当的深层组织治疗窗口。Shen 等[50]提出使用光敏剂活化 NO 供体的策略,如四苯基四苯并卟啉钯(II)(PdTPTBP)衍生物,可以在红光(630 nm)照射下激活CouN(NO)-NO2,实现光可控的 NO 释放。为了研究其潜在的生物医学应用,研究者利用可逆加成-断裂链转移聚合,将 CouN(NO)-NO2和 PdTPTBP 共聚形成两亲性嵌段共聚物 PGalNP,该共聚物可以在水中自组装形成纳米颗粒。0.1 g/L 的 PGalNP 纳米颗粒经红光(630 nm)照射20 min 后释放的 NO 含量约为 70 μmol/L。此外,制备的Cip@PGalNP 纳米颗粒可有效治疗铜绿假单胞菌感染形成的皮下脓肿,实现细菌的杀灭和促进伤口修复。
此外,Bao 等[52]通过在 aza-BODIPY 染料上修饰光响应 N-亚硝胺分子,开发了一种释放 NO 的 NIR 光激发J-聚集体 BDP-NO 分子。BDP-NO 可与 PEG-b-PCL 自组装形成 BDP-NO@PEG-b-PCL 胶束纳米粒子(nanoparticles,NPs)。当用白光照射 NPs 时,它们可以作为 NO 的生成载体。由于 BDP-NO 在胶束核心中存在 J-聚集模式,该胶束在 NIR 光照射下表现出良好的 PTT性能。基于 NO 和PTT 抗菌的协同作用,BDP-NO@PEG-b-PCL 在 MRSA 感染小鼠模型中具有良好的抗菌和伤口恢复活性。
Liu 等[62]开发了一种含有二维聚多巴胺(polydopamine,PDA)纳米片的复合水凝胶,用于抗菌和伤口愈合应用。研究人员首先合成负载 BNN6 的 PDA 纳米片,并将其与聚乙二醇-聚丙烯酸甲酯共聚物和 γ-聚谷氨酸-巯基丙醇(γ-PGA-ADH)进行反应,形成了 GFPB 水凝胶。该水凝胶还能够释放 NO,并且 NO 的释放量可以通过对 NIR激光(808 nm)的调控进行精确控制。体外实验表明,该水凝胶对大肠杆菌和金黄色葡萄球菌具有抗菌效果,NIR 光照射后细菌存活率显著降低。使用小鼠伤口模型的体内研究表明,该水凝胶与 NIR 光照射结合时能有效消除细菌、减轻炎症并促进伤口愈合。
金属和金属氧化物纳米粒子由于其独特的物理、化学、光学和电子特性,现也被用于 NO 供体系统的开发。Liang 等[63]报道了金纳米星/空心多巴胺 Janus 纳米颗粒(GNS/HPDA JNPs)的开发。首先,金纳米星(gold nanostar,GNS)被合成并用作种子颗粒。然后,通过在 GNS 表面沉积疏水性多巴胺(hydrophobic polydopamine,HPDA),形成了 Janus 结构的纳米颗粒。HPDA 的沉积可以提供一层保护,并为后续的功能化提供反应位点。在 HPDA 沉积后,纳米颗粒的空心部分形成,形成了空心多巴胺 Janus纳米颗粒(HPDA JNPs)。最后,通过在 GNS 表面修饰NO 供体 BNN6,形成 GNS/HPDA-BNN6 纳米颗粒。GNS/HPDA-BNN6 纳米颗粒可以在 NIR 激光照射下表现出较强的光热效应,通过调节激光功率密度和照射时间,可以精确控制 NO 的释放量。这些纳米颗粒表现出协同的光热和 NO 抗菌效应,有效抑制了 MRSA 的生长和生物膜形成。在 MRSA 感染的大鼠模型中进行的体内评估证明了这些纳米颗粒在消除 MRSA 和促进伤口愈合方面的有效性。
3.2 增强血管生成、促进皮肤再生
血管生成在整个伤口愈合过程中具有关键性的作用。组织工程皮肤替代品的缺陷在于很少能实现有限的血管化,无法与宿主组织融合以延长其使用寿命。促伤口愈合生物活性材料的血管化速度缓慢被认为是其主要缺点之一。因此,迫切需要能够促进血管生成的技术以改善伤口愈合状况。
Zhu 等[64]开发了一种基于 PDT 的可控 NO 生成系统(Ce6@Arg-ADP)。Ce6@Arg-ADP 以富含 L-Arg 的两亲性树突状肽(Arg-ADP)为载体制备,不仅具有优异的细菌结合和生物膜渗透性能,而且还可以作为多功能 NO 供体。研究表明,在有效渗透到生物膜内部后,在 665 nm 激光照射下,Ce6@Arg-ADP 可以利用 PDT 过程中产生的 H2O2将 Arg-ADP 氧化为 NO 和 L-瓜氨酸,而不影响单线态氧(1O2)的产生。快速大量产生的 NO 与1O2结合具有显著的协同抗菌和生物膜根除作用。更重要的是,在有效清除脓肿部位的所有细菌后,Arg-ADP 可以进一步产生 NO,促进伤口组织的微血管密度显著增加,实现损伤组织的血管再生和上皮化。
Yuan 等[65]制备了一种纳米复合聚偏二氟乙烯(polyvinylidene difluoride,PVDF)膜,其在 NIR 激光照射下可以释放 NO,在辅助 PDT 对抗各种致病性感染和血管再生方面表现出巨大的潜力。他们首先合成了由上转换纳米粒子(upconversion nanoparticles,UCNPs)和锆(Zr(IV))基卟啉金属-有机框架(PCN-224)组成的分层结构纳米粒子(UCNP@PCN),并进一步用 L-Arg 修饰得到UCNP@PCN@LA。随后,通过静电纺丝法将UCNP@PCN@LA 与 PVDF 结合,得到UCNP@PCN@LA-PVDF 纳米复合膜。这种纳米复合膜显示了 NIR 光介导的 ROS 生成和 NO 释放,L-Arg 的修饰增强了纳米粒子在光照下的 NO 释放能力,进而导致抗菌活性显著增强。同时,他们的研究还表明,UCNP@PCN@LA-PVDF + NIR 光照治疗组的小鼠伤口处表现出组织良好的分层上皮层和有序的肉芽组织,组织中出现了新的血管、毛囊和加速的胶原沉积。
除了 PDT 联合触发 NO 释放外,光热刺激 NO 释放在血管再生中的应用也受到了广泛的关注。Wu 等[66]将光热敏感的硝普钠(sodium nitroprusside,SNP)封装在有机金属框架(metal-organic frameworks,MOF)内。然后,在 MOF表面原位生长一层金壳,使其在 NIR 区域有良好的吸收。最后,通过巯基乙胺将 HOOC-PEG5000-Mal 附着在最外层,暴露马来酰亚胺,得到 SNP@MOF@Au-Mal 纳米发生器。该纳米发生器具有良好的 NIR 光吸收能力,可以有效地进行光热转换,触发 SNP 释放 NO。它们的体内实验结果表明,伤口上的细菌负载量减少了 97.7%。此外,免疫组织化学(VEGF:血管标记物)分析显示,治疗后伤口中的血管逐渐增加,证实了 NO 纳米发生器可促进生长因子的分泌。而生长因子在诱导血管再生中起关键作用,因此这种纳米发生器在血管再生的治疗方面具有很大的临床应用潜力。
然而,高浓度应用 SNP 可能会因释放氰化物而产生毒性。因此,为了优化气体治疗效果和生物安全性,严格平衡SNP 的用量是很重要的。基于此,Yang 等[67]设计了一种智能给药系统(SNP@MOF-UCNP@ssPDA-Cy7/Ir786,简称SNP@UCM),该系统可以通过外部信号精确调节 NO 释放到伤口部位。其中,NIR 辐射转化的可见光通过 UCNPs 触发 SNP 的分解,导致可控的 NO 释放。有趣的是,他们还发现 SNP@UCM 可以通过抑制泛素-蛋白酶体系统来稳定缺氧诱导因子(hypoxia inducible factor-1α,HIF-1α)蛋白,进一步促进伤口部位的血管生成。这种 HIF-1α 稳定纳米平台为临床血管治疗提供了一种更加简便和可靠的方法。
综上可见,NO 在治疗皮肤损伤和促进伤口愈合中表现出巨大的潜力。在体外和体内的研究中证实了光控释放 NO分子对伤口部位杀菌、促进血管再生的作用,显示出其用于改善不良伤口愈合的巨大潜力。然而,NO 对伤口愈合作用的机制还需进一步研究、阐明,推进 NO 供体材料的临床前开发,为伤口的外科治疗提供指导和临床应用。
4 光控释放 NO 技术的挑战与展望
光控释放 NO 分子能够在光照下实现 NO 的可控释放,为基于 NO 的组织再生提供了良好的技术手段。然而,目前报道的大部分有机光控释放 NO 的分子为可见光(波长 400~700 nm)激发,存在穿透深度不足的缺点。因此,深层损伤造成的慢性伤口仍是治疗难点。而 NIR 光(波长700~1700 nm)在穿透皮肤和脂肪等生物组织作用时发生的散射和吸收现象较少,具有高的组织穿透深度,低的自荧光背景以及对周围正常组织低的光损伤/光毒性等优势[68]。此外,目前已报道的基于萘酰亚胺、罗丹明及 BODIPY 等具有大平面分子结构的有机光控释放 NO 的分子,在体内环境下易产生聚集,导致分子荧光强度降低,因此基于 NO 释放后分子荧光发射强度变化校准 NO 释放具有挑战性,在体校准 NO 释放将更难实现。因此,开发 NIR 光控释放NO 的分子,调整分子结构以实现 NO 的在体释放校准,是实现 NO 调控组织再生的关键。同时,光控释放 NO 的分子可与其他治疗方式(如光动力治疗、光热治疗、化疗等)联合使用,最大限度发挥 NO 敏化的协同治疗效应,达到最佳治疗效果。安全、高效、智能的光控释放 NO 的分子有望促进 NO 疗法在再生医学领域的应用和发展。

