ZIF-8在生物医学影像中的应用
肖忠宇,杨鑫鑫,曾庆斌,郭茜旎,周欣
影像技术的迅速发展使科学家和临床医生能够准确地了解疾病的发病机制和病理过程,并根据患者的情况制订个性化的治疗策略。将各种成像手段与造影剂相结合,可实现对疾病的精准诊断。金属有机骨架(MOFs)具有孔隙率高、孔径可调、易于后修饰等特点,在生物医学影像领域中得到了广泛的研究。本文选取了 MOFs 中较为经典的材料ZIF-8,从其高负载率与易修饰等角度出发,重点介绍了ZIF-8 与多种分子影像造影剂相结合所形成 ZIF-8 复合造影剂在光学成像、光声成像、磁共振成像、计算机断层扫描成像(CT)等不同医学成像平台的巨大应用价值,此外还阐述了 ZIF-8 应用于生物医学影像所面临的重大挑战,并对该领域未来的研究方向进行了展望。
1 ZIF-8 的结构与功能
配位聚合物是以金属离子和有机/无机配体通过配位键所形成的化合物,此类化合物具有结构可调,功能多样,稳定性好等特性,受到广泛的关注[1-4]。在众多配合物中,MOFs是通过金属离子或金属簇与有机配体配位形成的具有多孔结构的配位框架材料。与纯无机的分子筛和多孔碳材料相比,MOFs 具有如下优点:①易于结晶,可通过单晶/多晶 X射线衍射方法确定其空间结构,用于理论模型的研究;②由不同的金属离子和有机配体配位组成,通过对配体与中心金属离子进行灵活变换可以赋予材料不同的功能性;③多孔,比表面积大,在气体存储与分离[5]、催化[6]、传感[7]、医学影像及药物递送[8]等领域表现出了优异的性能和广阔的应用前景。
2006 年,陈小明院士课题组和 Yaghi 课题组[9-10]分别独立开发了一类新型的 MOF 材料,因其配体咪唑键角约为 145°,与由硅-氧或者铝-氧四面体构成的沸石结构类似,故而将其称为沸石咪唑酯骨架(zeolitic imidazolate frameworks,ZIFs)材料。Yaghi 课题组通过溶剂热法成功合成出了 ZIF-1~ZIF-12,并利用单晶 X 射线衍射解析出ZIF-8 与 ZIF-11 的单晶结构[10]。ZIF-8 是 ZIFs 系列中最具代表性的一种,由锌离子与 2-甲基咪唑(mIM)配位形成,具有典型的方钠石 SOD 结构(图1)。ZIF-8 具有丰富的孔道结构,有潜力用于封装药物分子或生物分子。
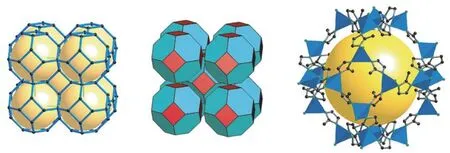
图1 ZIF-8 的 SOD 拓扑结构[10]
2 ZIF-8 的分子影像学研究
分子影像学是指运用影像学手段显示组织水平、细胞和亚细胞水平的特定分子,反映活体状态下分子水平变化,对其生物学行为在影像方面进行定性和定量研究的科学[11-13]。在诊断方面,通过对肿瘤及炎症发生过程中的相关因子进行标记实现成像,可在活体内观测到疾病起因、发生、发展等一系列的病理生理变化和特征;在治疗方面,观察药物作用过程中疾病病理变化,可验证药物的治疗可行性;在药物开发方面,通过设计靶向探针,经高分辨的影像学分析系统在体内监测药物治疗靶点的作用,进一步加快药物的筛选和开发。现有的疾病诊断成像技术主要包括光学成像[14]、光声成像[15]、磁共振成像[16]、计算机断层扫描成像[17]和正电子发射断层扫描成像[18]等,ZIF-8 多孔结构及水稳定性良好的特点,使得其可以负载多种荧光指示剂、磁共振造影剂和光热造影剂等。接下来将围绕以下几种影像技术平台,对ZIF-8 的分子影像学研究进行介绍。
2.1 光学成像平台
生物光学成像是一种常用的疾病诊断成像技术,通过造影剂将光转化为荧光或磷光信号,反映生物体中器官、组织或细胞的信息,具有操作方便、灵敏度好以及分辨率高等优点[19-21]。ZIF-8 材料具备高比表面积/孔体积、良好的生物相容性及可忽略的光吸收特性,可作为荧光染料的载体,应用于多种荧光染料的封装和递送。
体液中无机磷酸盐(phosphate ion,Pi)水平是临床诊断疾病的重要辅助指标,Li 和 Fu[22]通过在 ZIF-8 中负载荧光素钠构建了一种无机磷酸根的荧光探针,该探针在室温下能够一步法快速制备,而且对无机磷酸根的检出限较低(0.2 μmol/L),应用于尿液中 Pi 的检测,回收率为93.5%~96.0%。ZIF-8 材料除了可以直接进行荧光染料负载外,还可以通过包覆/修饰发光纳米粒子形成光学成像平台。Lv 等[23]报道了一种 ZIF-8 材料包覆铬掺杂的镓锗酸锌所形成的近红外持久性发光纳米颗粒 ZGGO@ZIF-8-DOX,该纳米粒子可以通过 DOX 荧光和近红外发光实现 4T1 小鼠乳腺癌细胞的双重成像,在体内肿瘤荧光成像和治疗方面表现出非常好的效果。He 等[24]将荧光碳量子点与 ZIF-8结合制备了绿色荧光 Cdots@ZIF-8 纳米粒子,并负载抗癌药物 5-Fu,在给药的同时实现癌细胞的良好荧光成像与治疗效果监测。
Jing 等[25]发现 ZIF-8 在紫外光照射下具有良好的光催化活性,这意味着 ZIF-8 也可以作为光敏剂引发肿瘤的光动力治疗。Li 等[26]开发了一种 Fe2+/Mn2+双金属掺杂ZIF-8 包覆的发光纳米颗粒 LDNPs@Fe/Mn-ZIF-8(图2),其在近红外激光照射下能够实现双模态红色上转换(UC)和 NIR-II 下转换(DC)发射,具有优异的 NIR-II 光学成像能力。此外,Fe2+/Mn2+的双掺杂显著降低了 ZIF-8 光敏剂的带隙(5.1 eV 减小到 1.7 eV),使得 Fe/Mn-ZIF-8 能够被 UC 光子激发从而实现光催化的 PDT,Fe/Mn-ZIF-8在肿瘤微环境的降解进一步增强了纳米系统的肿瘤 NIR-II成像功能。
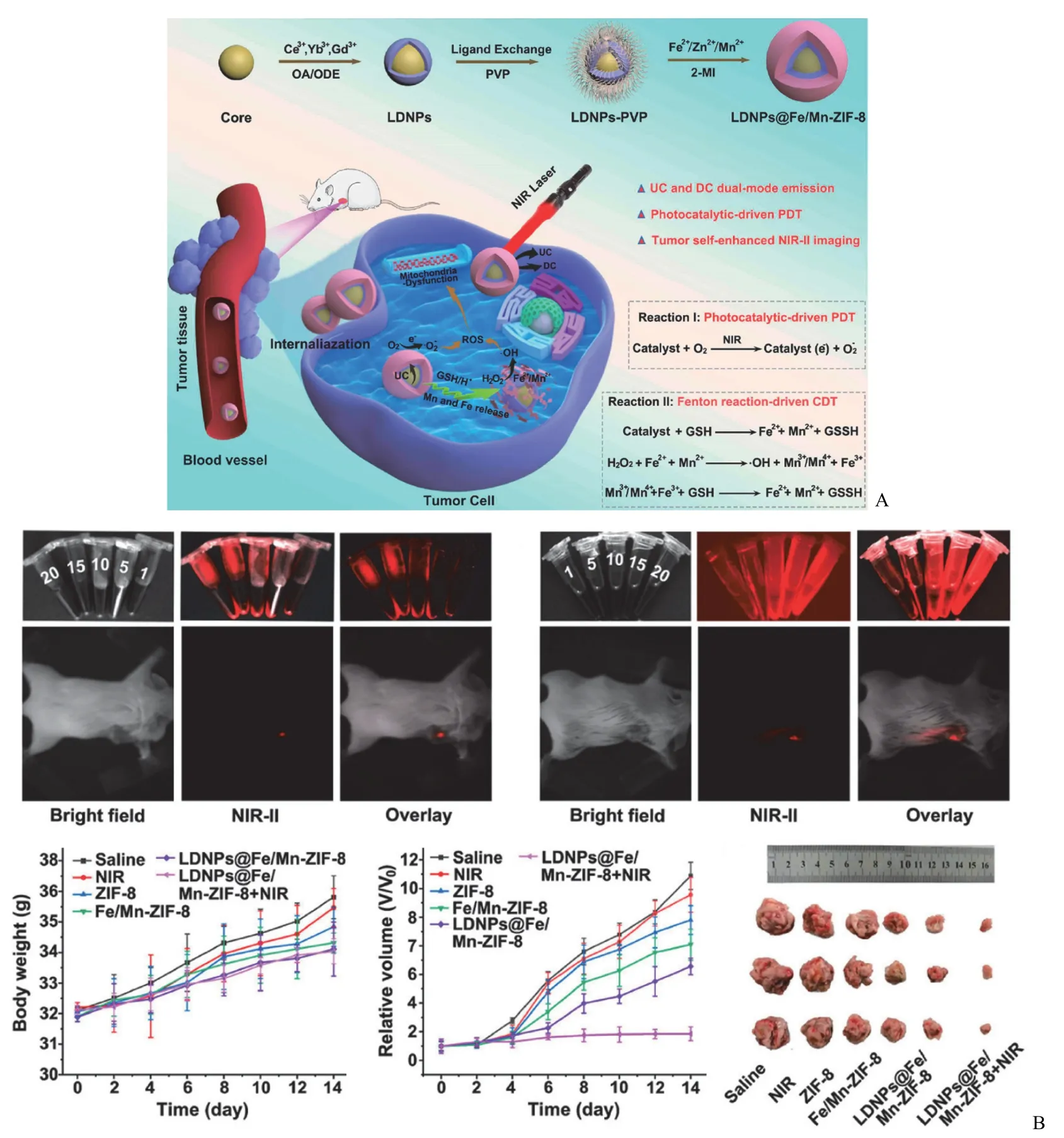
图2 A:LDNPs@Fe/Mn-ZIF-8 的制备及其在 TME 中的治疗和 NIR-II 成像机制示意图;B:不同浓度 LDNPs@Fe/Mn-ZIF-8溶液的体外 NIR-II 荧光成像和荷瘤小鼠瘤内注射 NIR-II 荧光成像,及肿瘤治疗效果评估[26]
ZIF-8 的多孔性质有利于荧光染料的直接负载,但荧光染料的穿透深度有限以及易猝灭等特点限制了荧光成像的进一步应用,通过引入近红外二区的荧光材料对 ZIF-8 进行修饰,将可见区荧光扩展至近红外二区,可以获取发光强度高、穿透深度深、稳定性好的光学成像平台,以实现对癌症疾病模型的精准检测与治疗。
2.2 光声成像平台
光声成像(PA)是近年发展起来的一种非侵入式和非电离式的新型生物医学成像方法,其结合了纯光学组织成像中高选择特性和纯超声组织成像中深穿透特性的优点,可得到高分辨率和高对比度的组织图像。
Han 等[27]通过将 ZnS 和 Cu2O 纳米颗粒封装在ZIF-8 纳米材料中,开发了一种在体内可激活光声成像及肿瘤协同光热/化学动力学治疗(PTT/CDT)的纳米诊疗平台(图3),其在肿瘤微环境下逐渐分解释放 ZnS 纳米粒子和 Cu+离子,进而合成具有 PA 信号的 Cu2S 纳米点,实现特异性肿瘤成像。Feng 等[28]通过一步法得到了PDA-siRNA-ZIF-8(PSZ)纳米载体。在该研究中,ZIF-8 在非酸条件下良好包封 siRNA,于肿瘤微酸性环境下裂解并释放出 siRNA,随后 siRNA 切割靶向 mRNA,聚多巴胺纳米颗粒(PDAs)则可作为光声成像造影剂和多功能光热剂引导光热治疗,经光声/近红外双模成像的无创引导,PSZ有良好的光热治疗和基因治疗能力。Yang 等[29]通过一步法合成了 ZIF-8 衍生碳纳米颗粒(ZCNs),在近红外激光照射下,ZCNs 可以产生热量与活性氧,在光声成像引导下,实现肿瘤的光动力和光热协同治疗。
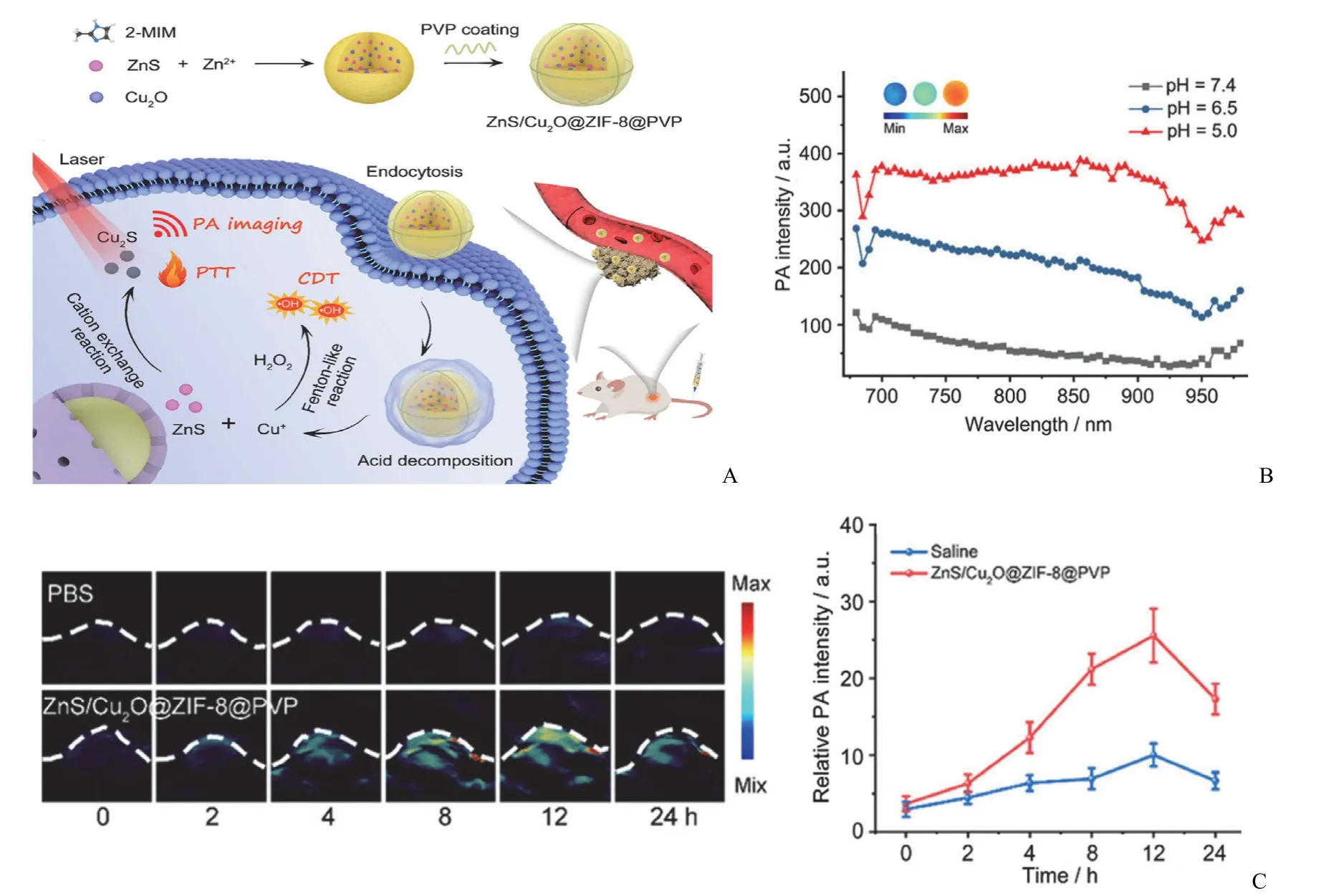
图3 A:ZnS/Cu2O@ZIF-8@PVP 纳米诊疗平台合成工艺及用于肿瘤光声成像和治疗的机制示意图;B:ZnS/Cu2O@ZIF-8@PVP在 pH 值为 7.4、6.5 和 5.0 时的 PA 光谱;插图:700 nm 处相应的 PA 图像;C:4T1 荷瘤小鼠静脉注射 PBS 或ZnS/Cu2O@ZIF-8@PVP 后不同时间点的 PA 图像及相应的 PA 信号强度变化[27]
将具有光吸收特性的材料(常见的是近红外 I 区光吸收材料)负载于具备多孔结构 ZIF-8 纳米颗粒上,可以构建以 ZIF-8 为载体的光声成像平台。该平台对激发光进行吸收后,可产生增强的光声信号,由此实现对病变区域的高特异性和深穿透性造影。
2.3 磁共振成像平台
磁共振成像是利用外部磁场/无线电波与软组织中自旋原子核之间的复杂相互作用产生射频信号,获得生物内部结构信息的医学成像技术,具备无电离辐射、无侵入性、空间分辨率高、组织穿透深及良好的软组织对比度等特点,在临床上广为应用[30-34]。接下来主要对 T1造影剂、T2造影剂与杂核造影剂进行介绍。
2.3.1 质子造影剂 质子磁共振造影剂可以通过改变检测部位质子的纵向弛豫时间(T1)和横向弛豫时间(T2)来构建疾病诊断图像[35]。T1造影剂是一类含有顺磁金属的造影剂,因顺磁金属中含有未配对电子,可缩短周围水质子的 T1,从而产生正对比效果。T2造影剂可缩短周围水质子的 T2,产生负对比效果。将质子造影剂与 ZIF-8 有机结合,可以在癌症诊疗中增加造影剂的肿瘤积聚,提高成像质量[36]。
Pan 等[37]对 ZIF-8 进行刻蚀,再引入 Mn2+形成中空结构的硅酸锰纳米颗粒(DHMS),可以实现磁共振成像引导的增强声动力诊疗(图4)。Liu 等[38]通过在 ZIF-8 纳米颗粒表面附着葡萄糖氧化酶(GOx),随后使用 MnO2和PEG 修饰 ZIF-8/GOx,构建了一种可激活的磁共振造影剂ZIF-8/GOx@MnO2@PEG(ZGMP),葡萄糖与 ZGMP 的级联反应可导致 Mn(II)的产生和 MRI 信号的增强。结果表明,早期AD 模型小鼠由于较高的葡萄糖摄取,有明显增强的 T1加权 MRI 效果,该研究为早期 AD 的 MRI诊断开辟了一条便捷的途径。Zhou 等[39]将 Gd 螯合物(Gd-DTPA)装入 ZIF-8 中,构建了一种高效的 T1加权MRI 造影剂 Gd-DTPA@ZIF-8,在 0.5 T 时,其纵向弛豫值r1值为 29.60 mM-1·s-1,比 Gd-DTPA 的 r1值高约 6 倍,体内 MRI 实验表明 Gd-DTPA@ZIF-8 可显著增强肿瘤部位的 T1加权 MRI 造影。
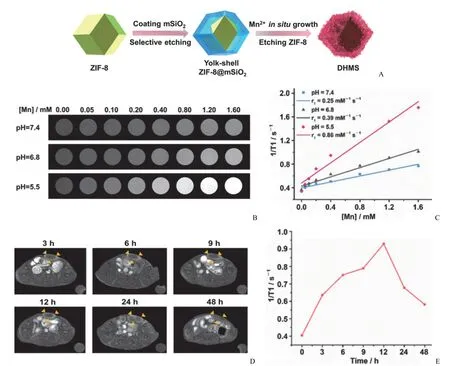
图4 A:DHMS 的合成过程示意图;B:不同 pH 条件下 DHMS 的 T1 加权 MRI 随浓度变化;C:不同缓冲溶液中 DHMS的纵向弛豫率 r1 随 Mn 浓度的变化曲线;D:小鼠静脉注射 20 mg/kg DHMS 后的 T1 加权 MRI(每张图右下角的圆圈表示对照组);E:静脉注射 DHMS 后纵向弛豫率随时间的变化曲线[37]
He 等[40]用溶剂热法制备了多孔碳包覆的超顺磁性Fe3O4纳米球,诱导 ZIF-8 在纳米球表面生长并负载 DOX得到了 DOX@FCZ NPs。在多孔碳壳中嵌入碳量子点实现细胞荧光成像,且 Fe3O4可作为 T2加权磁共振造影剂,实现对癌症的荧光/磁共振双模态成像。
Liang 等[41]通过将顺磁性 Mn2+离子(作为 T1对比剂)和 Fe3O4NPs(作为 T2对比剂)简单组装到 pH 和谷胱甘肽(GSH)敏感的 ZIF-8 基质中,构建了一种具有良好的 pH 和 GSH 响应的 T1-T2双模式对比剂Fe3O4@ZIF-8-Zn-Mn NPs。在酸性环境(pH = 6.5~5.5)及GSH(0~4 mmol/L)存在的条件下,Fe3O4@ZIF-8-Zn-Mn NPs 可以被分解并释放 Fe3O4NPs 和顺磁性 Mn2+离子,从而使 T1和 T2成像性能同时恢复,r1和 r2分别提高 6.9 和 9.9 倍。体内磁共振成像实验表明,静脉注射Fe3O4@ZIF-8-Zn-Mn NPs约 1 h 后,T1加权成像肿瘤部位变亮约 31%,而 T2加权成像肿瘤部位变暗约 30%。
通过将 ZIF-8 与 T1/T2造影剂相结合,可得到复合质子磁共振造影剂,实现不同组织的高对比度,对组织坏死、局部缺血和各种恶性病变(如肿瘤)具有良好的检测能力。2.3.2 杂核造影剂 除1H 外其他核自旋不为 0 的原子核也可进行磁共振成像。目前研究较为广泛的杂核包括3He、13C、19F、83Kr、129Xe 等元素。19F 自然丰度 100%,在体内无生物学背景干扰,且对化学环境敏感,是一类颇有应用潜力的造影剂。3He、83Kr、129Xe 的核自旋极化度可通过自旋交换光泵技术(SEOP)进行提高,产生较强的磁共振信号,可作为气体造影剂用于肺部疾病的检测[42-46]。
Jiang 等[47]开发了一种新型的智能纳米平台KN046@19F-ZIF-8,在 ZIF-8 合成时掺杂氟化咪唑与KN046(人源 PD-L1/CTLA-4 双特异性单结构抗体 Fc 融合蛋白),既能实现肿瘤的19F MR 高特异性成像,又能实时监控抗体体内释放。Wang 等[48]通过 RAFT 聚合将含氟聚合物接枝到 pH 响应的 ZIF-8 纳米颗粒上(图5),纳米颗粒在肿瘤微酸性环境降解并释放出锌离子以及包裹的抗癌药物,锌离子进一步与含氟聚合物配位,以降低纳米颗粒的亲水性并逆转其表面电荷,提高肿瘤细胞对纳米材料的摄取,最终实现肿瘤部位19F MR 高特异性成像并有效抑制肿瘤的生长。
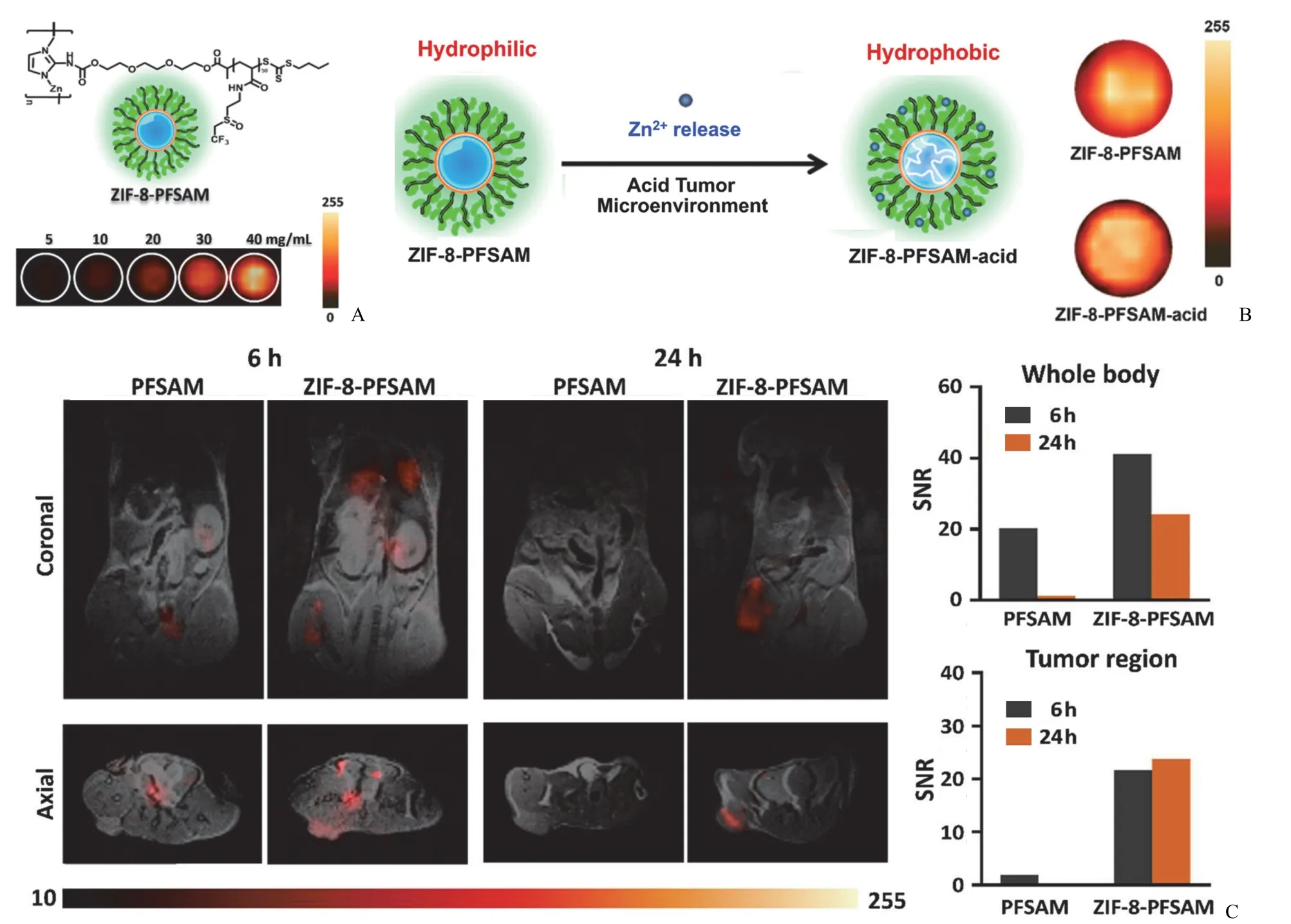
图5 A:不同浓度 ZIF-8-PFSAM 溶液的 19F MRI;B:酸性肿瘤微环境下 ZIF-8-PFSAM 解离的机制及相应的 19F MRI(ZIF-8-PFSAM 浓度为 40 mg/ml);C:静脉注射纳米颗粒 6 h 和 24 h 后 9.4 T 下荷瘤小鼠的 MRI 图像及相应的 SNR,高分辨率 1H MRI 与 19F MRI 叠加[48]
Zeng 等[49]首次提出以 ZIF-8 作为纳米“笼”来装载129Xe(图6),能有效提高水溶液中“笼”内129Xe 的浓度,利用自主研制的超极化气体磁共振科学仪器,显著增强了水溶液中“笼”内129Xe 的磁共振信号,比传统分子“笼”内129Xe 的磁共振信号提高了 200 倍,实现了超极化129Xe 磁共振分子影像领域的重要突破。进一步,由于突破了“笼”内 Xe 信号强度的壁垒,可在生物检测中利用该信号与血液中信号之间的化学交换,放大血液中的微弱信号,从而提升血液中分子探测的灵敏度。
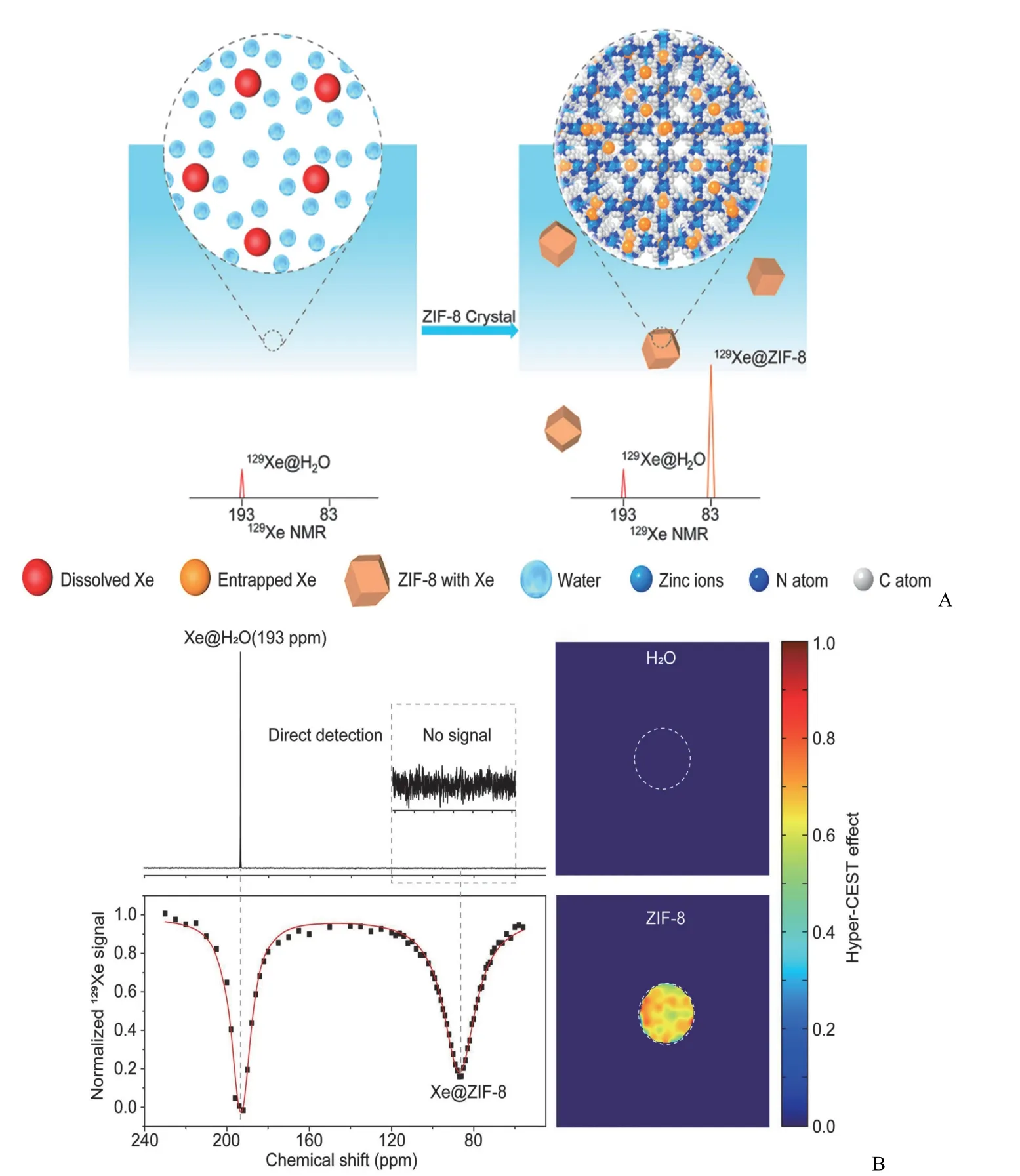
图6 A:水溶液中 ZIF-8 纳米颗粒可显著增强气体磁共振信号;B:低浓度 ZIF-8 在水溶液中的 Hyper-CEST NMR 和MRI[49]
将含19F 的生物制剂引入 ZIF-8 可以实现体内无背景干扰的19F 磁共振成像,对免疫治疗以及肿瘤疾病模型进行有效监测。对具备 Xe 捕获能力的 ZIF-8,则可以进一步对其进行后修饰,在保证其 Xe 捕获功能不损失的情况下,利用129Xe 的气体优势,实现对肺部多种疾病的特异性监测。
2.4 CT 平台
CT 作为临床诊断疾病的重要技术之一,是利用扫描部位间 X 射线吸收程度的不同来创建人体解剖结构的断面灰度图像,具有操作简单、扫描时间快、空间分辨率高等优点。Chen 等[50]通过将抗癌药物阿霉素(DOX)和等离子体双金属异质结构整合到 ZIF-8 中,制备了一种 pH 响应的多功能纳米平台 Dox-Pt-tipped Au@ZIF-8(图7),用于 CT和光热成像引导下的肿瘤化疗、光热、光动力协同治疗。在肿瘤微环境的刺激下,ZIF-8 裂解释放出封装的 Pt-tipped Au 纳米棒,在 NIR-II 激光(1064 nm)照射下表现出优异的光热和光动力学特性。由于 Au/Pt 在 NIR-II 区域的强吸收和高 X 射线衰减能力,纳米平台显示出良好的体外体内CT 成像造影效果,用以增强癌症的医学影像诊断和治疗。Zhang 等[51]在 Au NR/PAA Janus 构型复合材料的 PAA 侧选择性生长 ZIF-8,然后用靶向基团乳酸(LA)修饰 Au NR的侧表面,Au 在 CT 图像下的高对比度使得纳米平台可用于 CT 成像引导下的癌症治疗。
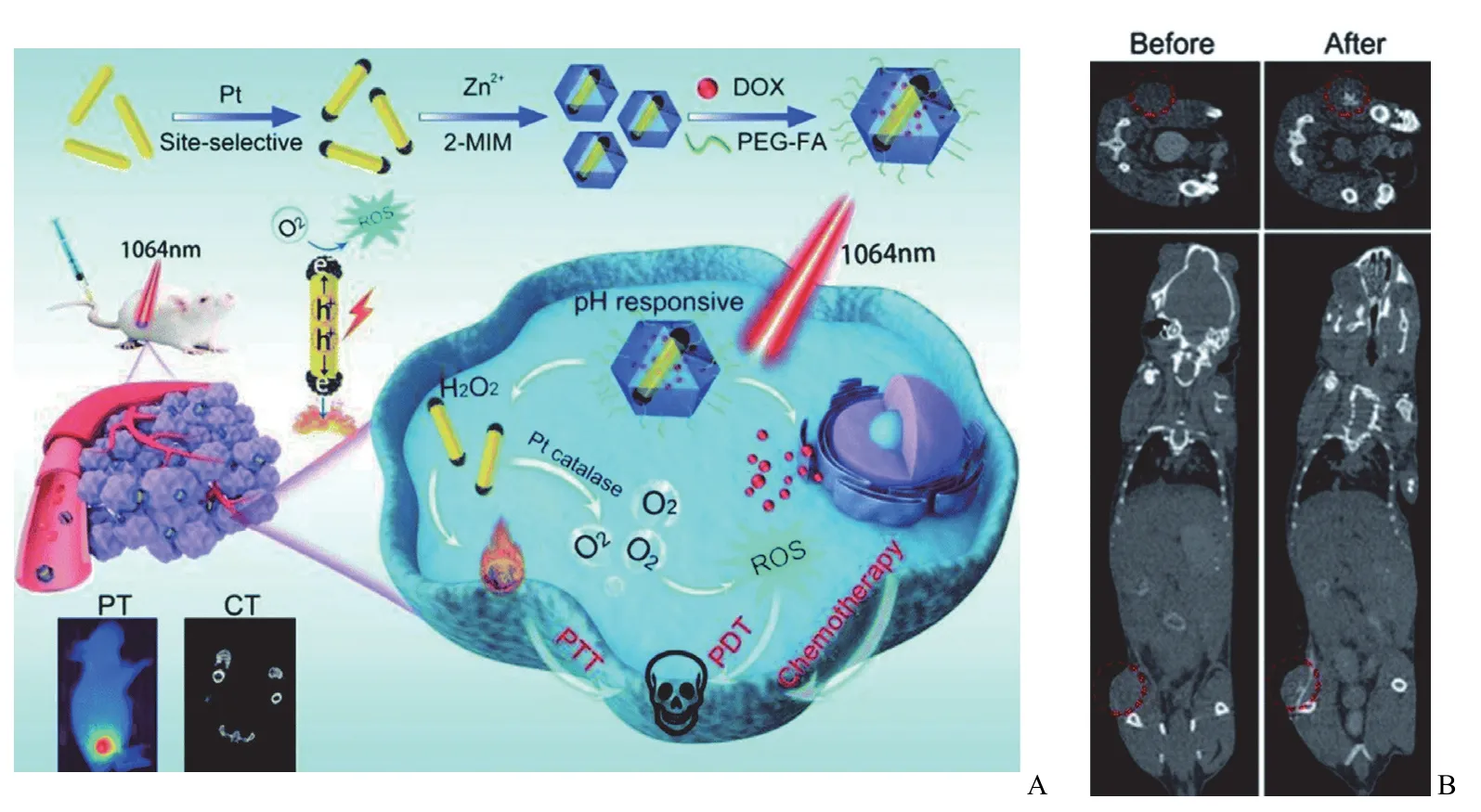
图7 A:Dox-Pt-tipped Au@ZIF-8 纳米平台的制备及多模态成像引导协同抗癌治疗的示意图;B:瘤内注射 10 mg/kg 的Dox-Pt-tipped Au@ZIF-8 前后小鼠肿瘤组织的 CT 图像[50]
对 ZIF-8 骨架材料进行 CT 造影剂的负载,形成复合CT 造影剂,可实现横断解剖平面上病变部位精准监测。
3 展望
ZIF-8 因其孔隙率高、易修饰、生物相容性好等特点,在生物医学影像领域得到了广泛的研究。针对现有疾病的复杂性和多样性,应当将 ZIF-8 的孔径特点与多种造影剂的优势相结合,一方面,利用 ZIF-8 的易修饰特点,提升单模态造影剂的成像性能,另一方面,引入多种模态造影剂,结合各模态在时空分辨率、成像对比度和灵敏度等方面的优势,实现复杂疾病的多层次、多角度精准检测,满足当前临床需求。目前 ZIF-8 纳米平台作为临床造影剂仍面临着长期的挑战,但已经取得了显著的进展,在未来应用中应更加注重材料的可修饰性,与生物医学影像学科相结合,充当“转化医学”的桥梁,成为“精准医疗”中不可或缺的工具,进一步推动现代生物医学研究的发展。

