GB 4789.28食品微生物学检验用培养基和试剂中沙门氏菌检验用培养基质控菌株的筛选
陈怡文,张晓东,任秀,余文,刘娜,崔生辉
(中国食品药品检定研究院,北京 100050)
非伤寒沙门氏菌是人类胃肠炎最常见的病因之一,在美国和欧洲,沙门氏菌感染疾病占食源性疾病死亡人数的30%以上[1-3]。食用被沙门氏菌污染的家禽和家禽产品(肉和蛋类)是人类感染沙门氏菌的最常见原因[4]。一般食品检测沙门氏菌的方法为从非选择性增菌肉汤中进行富集,经过选择性增菌肉汤增菌后,在选择性分离固体平板上进行分离及后续的生化鉴定和血清学分型[5,6]。培养基的质量对沙门氏菌的检出率有最直接的影响。
培养基是指液体、半固体或固体形式的,含天然或合成成分,用于保证微生物繁殖、鉴定或保持其活力的物质[7,8]。一般培养基中含有碳源、氮源、无机盐、生长因子和水,这些成分是细菌生长所必须的营养物质[9,10]。目前市售的培养基由于原材料质量、制作过程的差异,不同品牌、或不同批号培养基的质量均可能存在差异,可能对微生物的生长带来影响,表现为菌落大小、形态、计数等结果的差异[11-18]。
《GB 4789.28-2013 食品安全国家标准 食品微生物学检验培养基和试剂的质量要求》(以下简称GB 4789.28-2013)中对培养基质量的检测方法进行了明确规定[16]。该标准中的每一个培养基都规定了检测用质控菌株。但过半数(21/40)质控菌株来自The Global Bioresource Center(以下简称ATCC),不利于国内基层实验室和企业使用。首先是无法验证国外菌株的真实性,我国于2021年4月15日颁布了《中华人民共和国生物安全法》,购买进口菌株需要提供实验室资质、使用证明、销毁证明等,很多实验室难以直接进口,只能选择在国内中介网站购买菌株,这种方式很难保证菌株的真实性,无法保证结果的可靠性。其次ATCC的菌株不具备本土代表性,培养基的验证主要是观察质控菌株在待测培养基上的生化反应及生长情况能否满足标准要求,不需要使用模式菌株,质控菌株应具有检品和地域特点,即最好使用本国食品或相关环境中分离的常见菌株,如美国Quality Control for Commercially Prepared Microbiological Culture Media(Third Edition)标准中使用ATCC菌株;澳大利亚Guidelines for Assuring Quality of Food and Water Microbiological Culture Media标准中使用NCTC菌株;ISO标准Microbiology of Food, Animal Feed and Water-Preparation, Production, Storage and Performance Testing of Culture Media中使用WDCM菌株[19-21]。综上所述,我国国家强制标准应优先选取本国的菌株作为质控菌株。
本文仅以鼠伤寒沙门氏菌为例,对整个菌株筛选过程进行阐述。本次标准修订通过组织15家实验室对7株鼠伤寒沙门氏菌在不同种类、品牌的培养基上进行验证,筛选出可等效于ATCC的菌株。研究中选取的7株鼠伤寒沙门氏菌均来源于我国菌种库,分离自我国食品或环境样品。综上所述,本研究旨在通过实验验证筛选出国内具有代表性的菌株等效国外的菌株,从而保证国家强制标准使用菌株的科学性、合理性。
1 材料与方法
1.1 材料
1.1.1 主要仪器设备
PL2002电子天平,梅特勒-托利多仪器上海有限公司;SWB25水浴锅,美国Thermo Fisher Scientific公司;R205050GC生化培养箱,美国Thermo公司;Autoflex Ⅱ基质辅助激光解吸电离飞行时间质谱,美国Bruker公司;VITEK2 COMPACT 60自动微生物分析系统,法国梅里埃公司。
1.1.2 实验用标准菌株
本研究用8株鼠伤寒沙门氏菌来自中国医学细菌菌种保藏管理中心(CMCC)、中国工业微生物菌种保藏管理中心(CICC)和美国典型培养物保藏中心(ATCC)。
1.1.3 试剂和培养基
本实验所用的培养基均由国内培养基生产企业提供,经中检院验证符合GB 4789.28的要求后,由生产企业将同一种类和品牌的同批次培养基分发给验证实验室进行后续实验。培养基生产企业包括北京奥博星生物技术有限责任公司、北京陆桥技术股份有限公司、北京三药科技开发公司、广东环凯微生物科技有限公司、青岛海博生物技术有限公司。
1.2 方法
1.2.1 研究用菌株的确认
取表1菌种TSA琼脂培养基平板新鲜二代培养物,进行革兰氏染色、镜检,观察其染色特性及形态;使用革兰氏阴性菌鉴定卡在VITEK Compact II系统上进行生化确认;新鲜培养物经φ=70%甲酸提取后,用MALDI-TOF方法进行确认;将从新鲜培养物用水煮法提取的7株菌基因组DNA进行16S rRNA扩增,将扩增产物委托北京天一辉远生物科技有限公司用Sanger法进行克隆测序,并将测序结果上传至NCBI网站,进一步对种属进行确认。参考《GB 4789.4-2016 食品安全国家标准 食品微生物学检验 沙门氏菌检验》中的附录B,对研究用菌种进行血清型确认。
表1 验证用鼠伤寒沙门氏菌菌株信息Table 1 Information on Salmonella typhimurium strains for validation
1.2.2 菌悬液制备
用无菌棉签取鼠伤寒沙门氏菌TSA平板新鲜2代培养物,加入无菌生理盐水中,制备成系列稀释菌悬液。
1.2.3 固体培养基的测试方法
定量测试方法:取1.2.2制备的菌悬液,分别用待评价培养基和TSA参比培养基进行计数,参照GB 4789.28中选择性分离和技术固体培养基的测试方法计算生长率。每一稀释度接种两个平板。并按表2中规定的培养条件培养。
定性测试方法:用1 μL接种环取1.2.2制备的菌悬液在固体培养基(EMB)表面进行分区划线。并按表2中规定的培养条件培养平板。
1.2.4 液体培养基的测试方法
非选择性增菌培养基的测试方法参考GB 4789.28-2013中非选择性增菌培养基的半定量测试方法进行检测,中检院除了上述方法,还同时参考了选择性增菌培养基的检测方法,进行定量检测。
选择性增菌培养基的测试方法为:在液体培养基中接种10~100 CFU的鼠伤寒沙门氏菌,接种量为1 mL,按标准方法中规定的培养时间和温度进行培养,培养后,取10 μL培养液均匀涂布到XLD平板,按表3种规定的培养条件进行培养。

表3 验证单位名称及编号Table 3 Laboratory name and number
1.2.5 培养基的评价方法
参照GB 4789.28-2013质控评定标准对待测培养基的质量进行评价。
定量检测(生长率)的计算公式为:
式中:
PR——生长率;
NS——待测培养基平板上的菌落总数平均值;
NO——参比培养基平板上的菌落总数平均值。
1.3 验证单位
本研究的验证工作由国内15家单位完成,主要包括国家级、省级、市级食品检验机构和培养基生产厂家(表3)。为保证结果的有效性,验证用菌种由CMCC和CICC统一提供,干粉培养基为各生产厂家提供的同批次产品。
人逐步从空间的奴隶转化成空间的主宰者,并在此之中发展自我,享受公共生活。人通过自我的生命实践,恢复对自由的追求,阐明人在世界之中的位置与意义。人在劳动实践中实现人的价值旨归,人的实践活动成为人之本质力量的外在体现。体育,作为人的生命活动形式,建构起人的真实世界,成为人最真实的生活写照,反映出人最真实的模样。体育将人与自身、人与社会、人与自然充分联结起来,弥补身体的缺陷,规范人的行为,指引人的方向,实现自我的超越。人的生存发展需要在体育实践中得到满足,建构表达人自由思想与行动的公共空间,是人之主体性的彰显,也成为体育繁荣发展的内驱力。
1.4 菌株的筛选原则
依据固体培养基的生长率结果,筛选出与ATCC菌株生长率最接近的菌株,作为替代ATCC菌株的备选质控菌株。
将备选质控菌株的增菌效果和/或选择性等结果与ATCC菌株质控结果进行对比,筛选出与ATCC菌株质控结果一致性最高的菌株。
1.5 数据分析
本文使用JMP数据分析软件对不同菌株的数据进行分析比较。
2 结果与讨论
2.1 菌种的确认
5株鼠伤寒沙门菌由CMCC提供,均分离自食品或相关环境样品,经革兰氏染色后镜检验证均为革兰氏阴性杆菌,生化和质谱鉴定结果均为沙门氏菌,经血清型鉴定为鼠伤寒沙门氏菌,并经16S rRNA测序后将序列上传至Genbank,具体编号见表4。

表4 鼠伤寒沙门氏菌菌株的鉴定结果Table 4 Identification results of Salmonella typhimurium strains
2.2 固体培养基的测试结果
2.2.1 定量测试结果
表5结果所示,经8个机构检验,ATCC14028在5个厂家生产的4种沙门菌选择性分离固体培养基上的生长率均大于0.5,符合GB 4789.28对沙门菌选择性分离固体培养基的要求。但其余各菌株结果显示,均有个别结果不符合生长率要求(<0.5),同一菌株在不同品牌培养基上的生长形态和数量会存在一定差异(图1)[22]。图2显示,通过JMP软件对所有结果的分布进行分析比较,CMCC(B)50115和CMCC(B)50976生长率和ATCC14028最接近,同时该两株菌经不同检验机构验证不同品牌培养基,均只有单个检测结果不符合GB 4789.28的要求,经a机构检测CMCC(B)50115在B品牌HE培养基上的生长率小于0.5,经b机构检测CMCC(B)50976在E品牌BS培养基上的生长率小于0.5。而其他菌均有多个检测结果不符合GB 4789.28的要求,该两株菌可以作为标准菌株替代ATCC14028。

图1 c实验室使用不同编号鼠伤寒沙门氏菌在C品牌BS培养基上的生长情况Fig.1 Results of Salmonella typhimurium growth rate detected by c institutions on BS medium
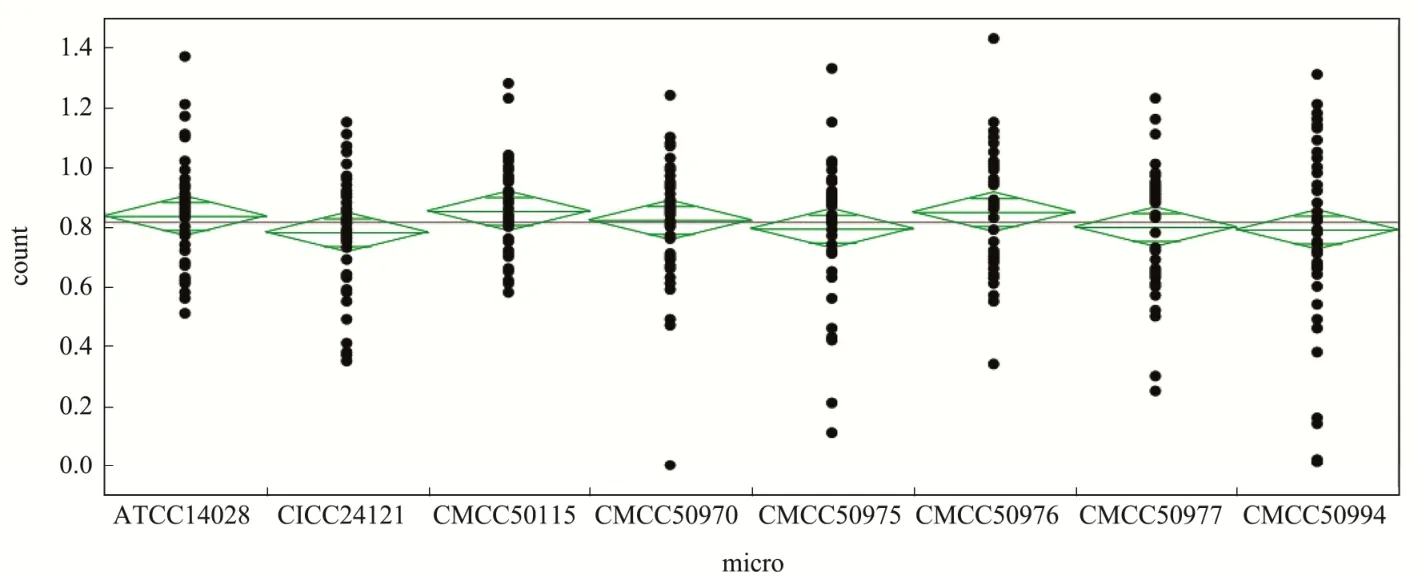
图2 用JMP比较不同编号鼠伤寒沙门氏菌在不同培养基上的生长率Fig.2 JMP was used to compare the growth rate of Salmonella typhimurium on different medium
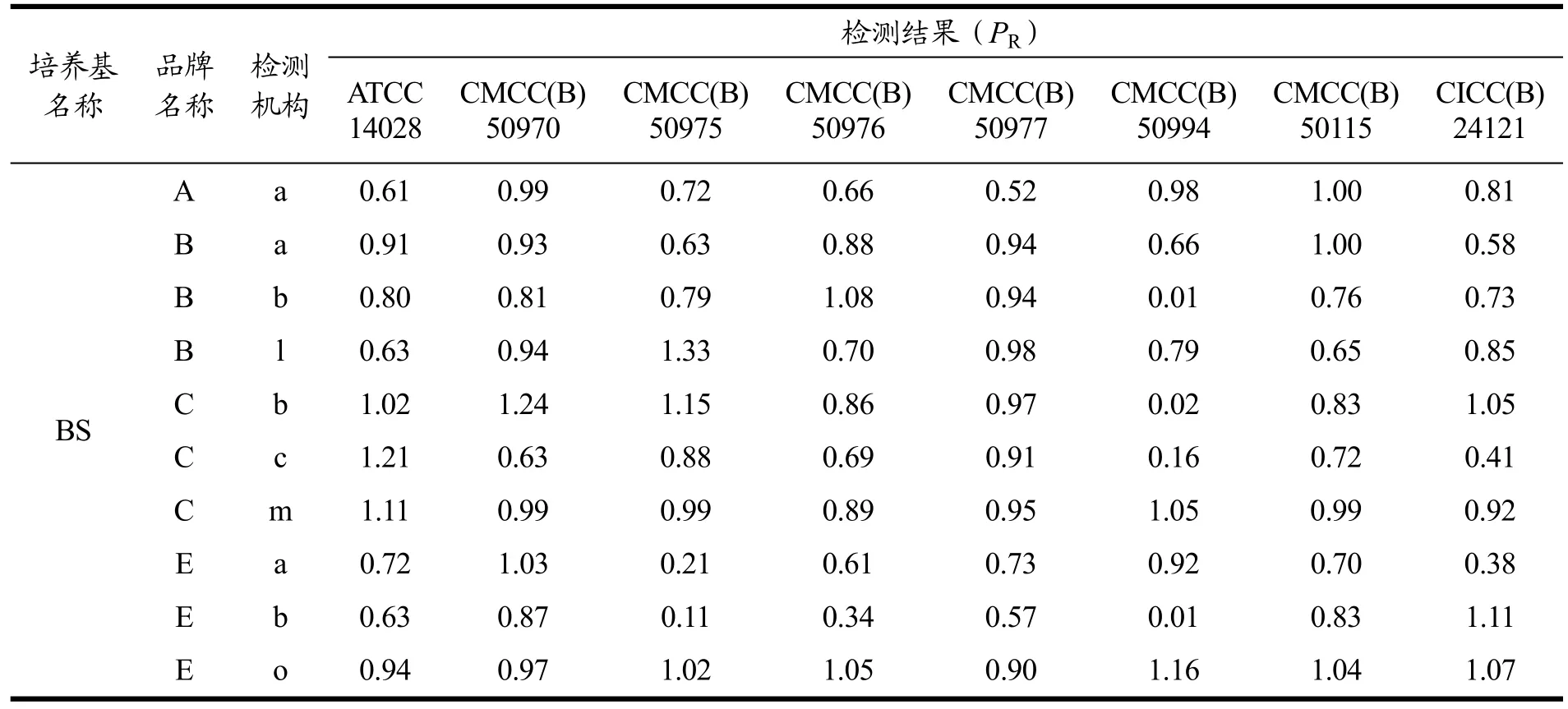
表5 不同检测机构在不同品牌上检测不同编号鼠伤寒沙门氏菌生长率结果Table 5 Results of Salmonella typhimurium growth rate detected by different detection institutions
2.2.2 定性测试结果
7株鼠伤寒沙门氏菌在伊红美蓝琼脂培养基上的特征性反应均符合GB 4789.28-2013要求,菌株生长形态为无色,半透明状。中检院使用4种不同品牌培养基,按照1.2.5方法,检测了7株菌的生长率,沙门氏菌很难被伊红美蓝琼脂培养基抑制,所以在GB 4789.28中,仅要求菌落生长形态能够与大肠埃希氏菌进行区分,但表6结果显示,部分培养基品牌能够抑制鼠伤寒沙门氏菌的生长,CMCC(B)50970、CMCC(B)50976和CMCC(B)50115生长率均不超过0.5。
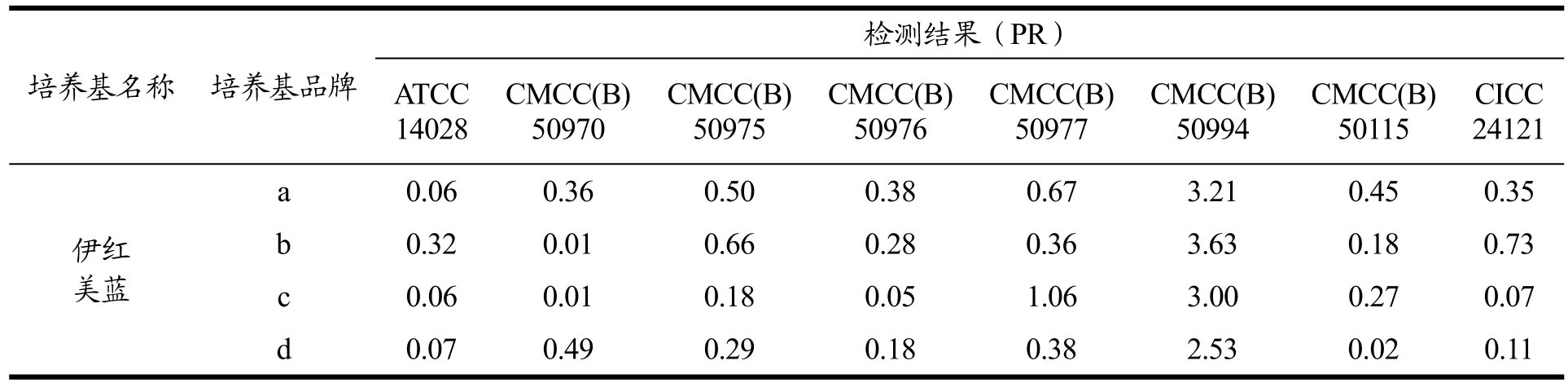
表6 中检院测试不同菌株编号鼠伤寒沙门氏菌在伊红美蓝培养基上的生长率结果Table 6 The results of growth rate of Salmonella typhimurium on EMB medium were tested by NIFDC
2.3 液体培养基的测试结果
2.3.1 非选择性增菌培养基的半定量测试结果
7株鼠伤寒沙门氏菌经缓冲蛋白胨水增菌液增菌后,使用TSA平板进行计数,结果均为多不可计,全部菌株符合GB 4789.28-2013要求。中检院在对增菌后培养基进行计数的同时,观察了接菌后增菌液的浑浊度,表7结果显示,CMCC(B)50977、CMCC(B)50976和CICC24121的浑浊度优于其他菌株。
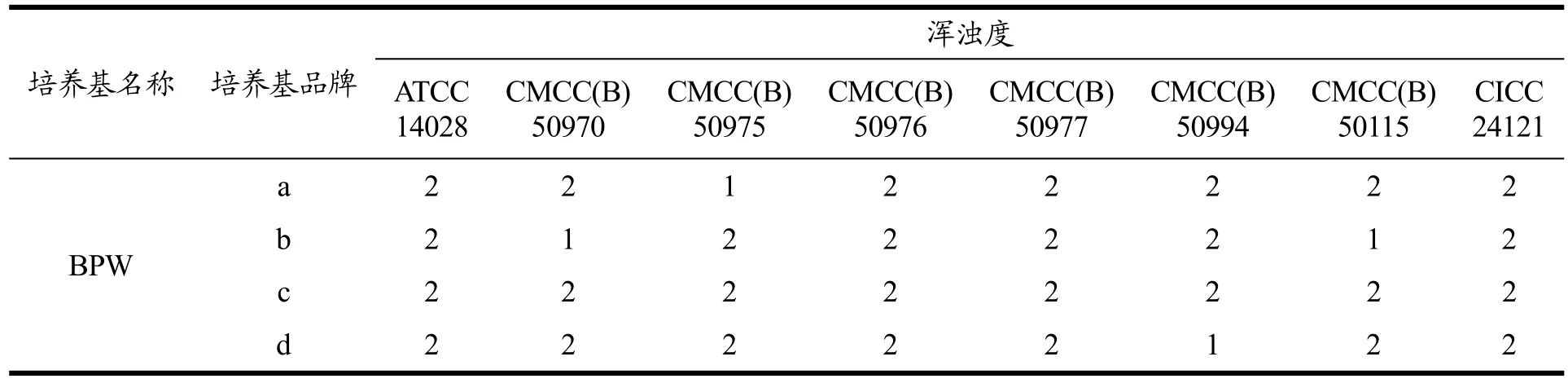
表7 中检院测试不同菌株编号鼠伤寒沙门氏菌在BPW肉汤中的浑浊度Table 7 The turbidity of different strains of Salmonella typhimurium in BPW broth was tested by NIFDC
2.3.2 选择性增菌培养基的半定量测试结果
7株鼠伤寒沙门氏菌经四硫磺酸钠煌绿增菌液(TTB)和亚硒酸盐胱氨酸增菌液(SC)增菌后,经TSA平板进行计数,除CMCC(B)50994外,其余结果均>10 CFU,符合GB4789.28-2013的要求。a和k机构在TTB增菌液中接入CMCC(B)50994后,经验证,增菌结果<10 CFU,k机构在SC增菌液中接入该菌,增菌后结果<10 CFU。
3 结论
本次研究综合生长率、选择性和定性实验结果数据,选择了CMCC(B)50976作为质控菌株替代ATCC14028。该菌于2002年分离自湖北地区的食品中,经生化、质谱、16S RNA鉴定确定为鼠伤寒沙门氏菌,经不同验证部门使用不同品牌培养基进行验证结果与ATCC14028最为接近,且结果稳定,符合本次质控菌株的筛选标准。本研究证明我国菌株可以替代国外菌株作为国家强制标准的质控标准,为未来的标准菌株筛选提供了实验思路。
本研究发现,同种类培养基由于生产厂家不同,质量存在差异(见图1)。培养基质量是影响菌落计数结果的因素之一,如A和B品牌的BS培养基,质量检测结果普遍优于E品牌和C品牌,其中B品牌培养基仅b检测机构检测的CMCC(B)50994生长率低于0.5。这种生长率的差异主要由于培养基中提供氨基氮和生长因子等营养成分的质量差异,这种营养成分(如蛋白胨,牛肉浸出物等)一般为复杂的生物组分构成,由于成分的不稳定性很容易造成培养基质量的不稳定性。同时培养基为防止微生物污染,延长保质期,也会添加抑菌成分或者进行辐照灭菌等,这也是影响培养基生长率的关键因素之一,针对这种情况在培养基的验证过程中可加入如藤黄微球菌等对抑菌物质敏感的菌株进行质控。
同时不同的实验室的操作人员、实验室环境、使用仪器等也会影响最终的实验结果。表5结果显示,a实验室检测的培养基不合格率高于其他实验室,b实验检测的生长率结果普遍低于其他实验室。这种差异除了培养基质量的不稳定性,也可能来自于实验人员的操作,实验人员在实验操作过程中的接菌量对最终结果有很大的影响。GB 4789.28-2013中规定目标菌的接菌量为10~100 CFU/mL,在实际操作中,接菌量为10 CFU/mL与100 CFU/mL对最终结果的判读有很大影响,越低的接菌量越容易出现不合格的结果,如接菌量为20 CFU/mL,则两个品牌培养基间有2个菌落的差异,即会造成10%的差异。同时,本次研究证明接菌量低对选择性强的培养基更难生长,而高的接菌量,实验结果越容易符合GB 4789.28-2013的规定要求。建议实验室在验证过程中可以使用标准物质等质控样品,控制每次实验的接种量偏差,使得实验数据更加准确。生产企业为了保证培养基质量,在验证过程中可以适当的减少接菌量,使用比较极限的接菌量挑战培养基的生长能力,确保培养基能够在不同实验室符合GB 4789.28的要求。
本研究由于涉及验证GB 4789.28所有培养基和菌株,15个实验室验证了几十种培养基上白株菌,工作量大,参与部门多,所以不符合要求的结果未进行多次重复验证。通过固体培养基定量结果筛选出CMCC(B)50115和CMCC(B)50976生长率和ATCC14028最接近,后通过液体培养基进一步验证,确定CMCC(B)50976与ATCC14028结果一致性最高,故选择该菌作为替代菌株。本文通过实验和本次标准的修订系统的总结了培养基质量的控制方法和可能存在的不合格因素,为培养基生产企业的培养基质控和国家食品或其他标准修订菌株的筛选过程提供了思路和实验数据。

