莱茵衣藻IFT20 的原核表达、纯化及多克隆抗体鉴定
贾瑞勤, 贾 航, 郑学超, 薛 斌,3, 樊振川*,3
(1.天津科技大学 食品营养与安全国家重点实验室,天津 300457;2.天津科技大学 生物工程学院,天津 300457;3.天津科技大学 大健康生物技术国家国际科技合作基地,天津 300457)
鞭毛是一种存在于大多数真核细胞表面的具有运动、感知和信号传导功能的细胞器。 鞭毛由鞭毛轴丝、基体和鞭毛膜组成。 根据鞭毛轴丝结构不同,将鞭毛分为9+2 型运动纤毛(motile cilia)和9+0型原发性纤毛(primary cilia)2 种类型[1]。由于鞭毛不具有蛋白质合成所需的细胞器(如核糖体等),因此鞭毛生成和维持所需的前体蛋白质和降解产物均需通过鞭毛内运输(intaflagellar transport,IFT)的方式输入和输出鞭毛[2]。 1993 年发现IFT 存在于莱茵衣藻鞭毛中,其颗粒沿着鞭毛轴丝进行双向运输[3]。IFT 颗粒从鞭毛基部到顶部的运输称之为正向运输,这一过程由驱动蛋白-2(kinesin-2)驱动[4];反之则称之为反向运输,由动力蛋白-1b(dynein-1b)驱动[5]。 目前已知IFT 颗粒由IFT-A 和IFT-B 共2 个蛋白质复合物组成,其中IFT-A 含有6 个蛋白质亚基,通过与动力蛋白-1b 偶联来调控IFT 反向运输[6]。而IFT-B 则由16 个蛋白质亚基组成, 通过与驱动蛋白-2 偶联来调控IFT 正向运输[7]。 此外,IFT-B 在生化功能关系上可进一步划分为IFT-B1 和IFT-B2等2 个亚蛋白质复合物[8-9]。 生化和遗传实验表明IFT 对维持鞭毛生成和信号传导功能是必需的,鞭毛组装缺陷或信号功能缺失可引发一系列统称为纤毛病 (ciliopathy) 的先天性疾病, 其中就包括Bardet-Biedl 综 合 征[10]、Joubert 综 合 征[11]和Meckel综合征[12]等。
IFT20 是IFT-B 的一个组成成分, 在具鞭毛生物中是高度进化保守的[13]。 研究表明,IFT20 蛋白缺失会导致小鼠视锥细胞鞭毛生物生成受阻,视紫红质无法运送到视锥细胞外节,导致其在细胞内节大量堆积而引发神经退行性病变[14-15]。 此外,IFT20 可以和精子鞭毛蛋白2(SPEF2)相互作用,影响正常的生精导致雄性不孕[16]。因此,研究IFT20 的鞭毛生物学功能及其异常表达引发相关疾病的分子机制对于预防、诊断和开发相关药物治疗这些疾病具有十分重要的意义。
莱茵衣藻是一种单细胞真核藻类,作为一种模式生物, 莱茵衣藻已被广泛应用于鞭毛内运输、组装和功能的研究。 因此,作者拟制备高特异性的莱茵衣藻IFT20 蛋白多克隆抗体, 为后续开展IFT20在莱茵衣藻鞭毛内的功能研究奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 实验材料大肠杆菌(Escherichia coli)表达载体pET-28a(+)和pMAL-c2x、大肠杆菌XL1-blue和BL21(DE3)菌株、莱茵衣藻野生型藻种CC-125:均为作者所在实验室保存。
1.1.2 实验试剂限制性内切酶、T4 DNA 连接酶、RNase-M-MLV 酶、核酸和蛋白质标准品以及TriZol等:北京全式金生物有限公司;IPTG、卡那霉素、氨苄青霉素、PCR 产物纯化试剂盒和DNA 凝胶回收试剂盒等:Sangon Biotech 公司; 质粒提取试剂盒:TIANGEN 公司; 硝酸纤维素膜: 美国PALL 公司;Protein A SepharoseTMCL-4B、Ni SepharoseTM6 Fast Flow 和Dextrin SepharoseTMHigh Performance 等:美国GE Healthcare 公司;辣根过氧化物酶(HRP)标记二 抗: 美 国Jackson 公 司;ECL 发 光 液: 德 国Millipore 公司。
1.2 实验方法
1.2.1 莱茵衣藻总RNA 提取野生型莱茵衣藻CC-125 细胞在-80 ℃冻存后置于研钵中,加入液氮将其研磨至粉末状后转移至50 mL 离心管中。 加入1 mL Trizol 和20 μL β-巯基乙醇后剧烈振荡,并于室温静置10 min。 加入600 μL 氯仿-异戊醇(体积比24∶1),颠倒混匀后加入90 μL 无水乙醇,静置2 min。 于10 000 r/min 冷冻离心15 min, 吸取上清液, 加入2 倍体积的无水乙醇和0.2 倍体积的醋酸钠, 混匀后于-20 ℃静置30 min, 接着于10 000 r/min 冷冻离心15 min。 弃上清液,加入2 mL 体积分数75%的乙醇, 充分混匀后于10 000 r/min 冷冻离心8 min。 弃上清液,在超净工作台中于室温干燥5 min。 加入50 μL DEPC 水,吹匀溶解,测定所获总RNA 浓度并验证。 混匀5 μL DNA 酶缓冲液,2 μL DNA 酶,0.5 μL RNA 酶抑制剂和45 μL RNA 样品,将其在37 ℃烘箱中30 min 以去除DNA。 最后用氯仿-异戊醇和水饱和酚抽提3 次, 最终获得莱茵衣藻总RNA。
1.2.2 大肠杆菌表达载体pET-28a (+)-ift20 和pMAL-c2x-ift20 的构建在Phytozome v12.1 数据库中搜索ift20 基因cDNA 序列, 设计含有EcoR I酶切位点的上游引物IFT20-FOR 和含有Hind III酶切位点的下游引物IFT20-REV,见表1。以莱茵衣藻野生型藻种CC-125 总RNA 为模板进行反转录以生成cDNA, 并以此cDNA 为模板进行ift22 cDNA 扩增。 将ift22 cDNA 克隆至大肠杆菌表达载体pET-28a(+)和pMAL-c2x,所得重组表达载体命名为pET-28a(+)-ift20 和pMAL-c2x-ift20。

表1 IFT20 cDNA 扩增引物序列Table 1 Primers for the amplification of IFT20 cDNA
1.2.3 融合蛋白诱导表达将重组表达载体pET-28a(+)-ift20 和pMAL-c2x-ift20 转入大肠杆菌BL21(DE3)细胞并将细菌涂布于LB 培养基平板。待转化子形成后, 挑取单克隆细菌至LB 液体培养基,在37 ℃于220 r/min 培养过夜,而后将其以体积分数5%接种至LB 液体培养基中继续培养。 当OD600达到0.8~1.0 时,加入0.2 mmol/L IPTG 诱导蛋白质进行表达, 该过程在25 ℃、220 r/min 下进行6~8 h。 离心收集菌体后加入结合缓冲液(50 mmol/L Tris-HCl,150 mmol/L NaCl,pH 7.4, 应 用于pET-28a(+)-ift20 体系;20 mmol/L Tris-HCl、200 mmol/L NaCl、1 mmol/L EDTA、pH 7.4, 应用于pMAL-c2xift20 体系),重悬菌体并进行超声破碎,对细菌破碎物进行SDS-PAGE 电泳分析,分析融合蛋白质是否存在于上清液中。 在融合蛋白质诱导表达过程中,所有培养基都需添加相应抗生素。
1.2.4 融合蛋白质纯化重悬含有pET-28a(+)-ift20 和pMAL-c2x-ift20 的菌体于上述结合缓冲液中, 超声破碎菌体后将上清液 (重组蛋白6×His::IFT20 和MBP::IFT20 均溶于上清液中)与1 mL Ni SepharoseTM6 Fast Flow (结 合6×His::IFT20)或Dextrin Sepharose TM High Performance ( 结 合MBP::IFT20)填料混匀,4 ℃过夜。 用结合缓冲液漂洗填料10 次, 后用洗脱缓冲液 (50 mmol/L Tris-HCl,150 mmol/L NaCl,500 mmol/L 咪 唑,pH 7.4 或20 mmol/L Tris-HCl,200 mmol/L NaCl,1 mmol/L EDTA,10 mmol/L 麦 芽 糖,pH 7.4) 分 别 针 对6×His::IFT20 和MBP::IFT20 进行洗脱, 收集重组蛋白质并对其进行SDS-PAGE 电泳分析。
1.2.5 动物免疫将6×His::IFT20 蛋白抗原(纯度大于85%) 送至北京华大蛋白质研发中心有限公司,选择新西兰大白兔为免疫动物进行抗血清生成。
1.2.6 抗血清效价检测抗血清效价检测按文献[17]的间接ELISA 法进行。 具体而言,将IFT20 包被抗原稀释至10 μg/mL, 并以100 μL/孔包被于酶标板。 用体积分数5%的脱脂牛奶封闭液对抗原室温封闭1 h 后弃去。 用PBST 清洗液洗板3 次,加入抗血清室温孵育1 h。 孵育结束后,用PBST 清洗液洗板4 次,加入酶标二抗室温孵育30 min。 最后加入TMB(3’,3’,5’,5’-四甲基联苯胺)溶液显色,利用酶标仪测定其在OD450处的吸光值, 效价定义为最大OD 值一半时所对应的抗血清稀释倍数。
1.2.7 IgG 亚型抗体富集IgG 亚型抗体富集参照文献[18]的方法。 取一定量的抗血清和结合缓冲液(50 mmol/L Tris-HCl、pH 7.0)混匀,将其转入装有Protein A 纯化珠的纯化柱中, 室温结合1~2 h 后,用结合缓冲液漂洗3 次。 最后用酸性洗脱液(0.1 mol/L Glycine,pH 3.0)洗脱,中和后保存备用。
1.2.8 抗原抗体亲和纯化抗原抗体亲和纯化参照文献[19]的方法。 用1 mmol/L HCl 溶胀CNBractivated Sepharose 4B 干粉, 并用结合缓冲液(0.1 mol/L NaHCO3、500 mmol/L NaCl、pH 8.3) 将其pH值调至8.3。 将MBP::IFT20 蛋白抗原溶于结合液中,与溶胀好的CNBr-activated Sepharose 4B 于4 ℃过夜。 离心后在0.1 mol/L Tris-HCl(pH 8.0)溶液中室温静置2~4 h。 最后用100 mmol/L Tris-HCl 和0.5 mol/L NaCl 洗脱液(pH 8.5)与50 mmol/L 甘氨酸和1 mol/L NaCl 洗脱液(pH 3.5)交替洗脱至少8次。 将偶联抗原的CNBr-activated Sepharose 4B 与经Protein A 富集后的抗体孵育,按照以上IgG 亚型抗体富集的方法洗脱抗体,保存备用。
1.2.9 免疫印迹检测免疫印迹检测参照文献[20]的方法进行。 取20 μg 莱茵衣藻野生型藻种CC-125 的全细胞蛋白质提取物进行SDS-PAGE 电泳,电泳结束后将分离好的蛋白质转移至硝酸纤维素膜, 并利用体积分数5%的脱脂牛奶封闭液对其进行封闭, 添加稀释后的纯化抗体室温孵育1 h,用TBST 漂洗液 (10 mmol/L Tris,150 mmol/L NaCl,体积分数0.05% Tween-20,pH 7.5)漂洗3 次。 最后加入二抗室温孵育1 h, 用TBST 对其漂洗3 次后,用ECL 化学发光显色液曝光。
2 结果与分析
2.1 大肠杆菌表达载体pET-28a(+)-ift20 构建
以莱茵衣藻野生型藻种CC-125 总RNA 生成所得cDNA 为模板,利用表1 中所示上下游引物进行PCR 扩增, 获得大小为400 bp 左右的PCR 产物。 该cDNA 扩增产物经EcoR I 和Hind III 双酶切后克隆至大肠杆菌表达载体pET-28a(+),将连接产物转入大肠杆菌XL1-blue 感受态细胞, 随机挑取2 个转化子提取质粒进行酶切验证,见图1。结果表明,EcoR I 和Hind III 双酶切可以切出与载体和目的基因大小相符的2 个片段。 将酶切验证正确的质粒测序分析后命名为pET-28a(+)-ift20。
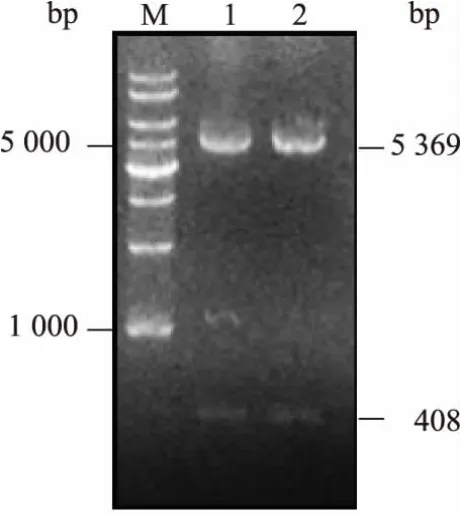
图1 重组质粒pET-28a(+)-ift20 的EcoR I 和Hind III双酶切验证Fig.1 Double restriction digestion verification of the recombinant plasmid pET-28a(+)-ift20 by EcoR I and Hind III
2.2 6×His::IFT20 重组蛋白诱导表达及纯化
将重组表达载体pET-28a(+)-ift20 转化进入大肠杆菌BL21(DE3),诱导表达融合蛋白6×His::IFT20。 将融合蛋白6×His::IFT20 进行镍柱亲和纯化,而后对纯化产物进行SDS-PAGE 电泳分析。 如图2 所示,6×His::IFT20 溶于菌体上清液中, 以可溶性蛋白质的形式存在。 灰度量化分析表明,纯化后的6×His::IFT20 融合蛋白约占菌体上清液总蛋白质的85%,符合免疫蛋白抗原纯度不低于85%的要求。 收集大约2.5 μg 的6×His::IFT20 融合蛋白用于免疫新西兰大白兔。
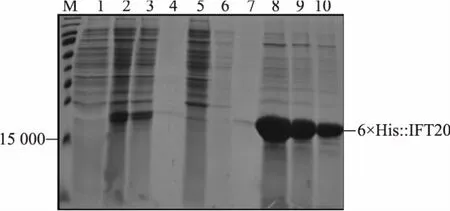
图2 SDS-PAGE 检测6×His::IFT20 融 合蛋白在大 肠杆菌BL21(DE3)中的表达及后续纯化Fig.2 SDS-PAGE analysis of the expression of 6×His::IFT20 fusion protein in E.coli BL21(DE3) and its subsequent purification
2.3 IFT20 抗血清效价检测
将6×His::IFT20 融合蛋白送至北京华大蛋白质研发中心有限公司免疫新西兰大白兔3 次,取耳静脉血进行间接ELISA 法抗血清效价检测。 如图3所示, 最大OD 值的一半数值处所对应的抗血清稀释倍数为102 400。 因此,所得IFT20 抗血清效价为1∶102 400。
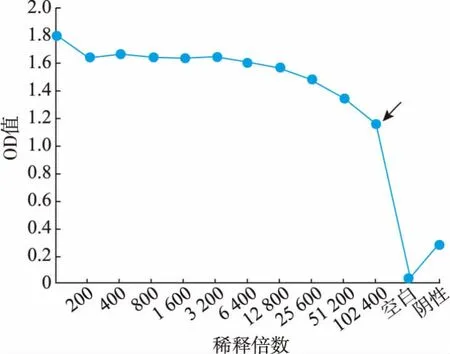
图3 间接ELISA 法测定IFT20 抗血清效价Fig.3 Determination of anti-IFT20 polyclonal antiserum titer by indirect ELISA
2.4 IFT20 抗体纯化及其特异性检测
2.4.1 IFT20 抗血清IgG 富集兔源抗血清中含有诸多抗体亚型, 为获得高亲和性抗IFT20 的IgG 亚型抗体,我们利用Protein A 纯化珠对IFT20 抗血清IgG 进行了富集, 并对富集得到的IgG 进行了免疫印迹检测。如图4 所示,抗血清经Protein A 富集后,可以识别莱茵衣藻野生型藻种CC-125 全细胞蛋白质提取物中的内源IFT20 蛋白质,但多条非特异性蛋白质条带仍然可见,需要对其进一步亲和纯化以提高IFT20 抗体的特异性。
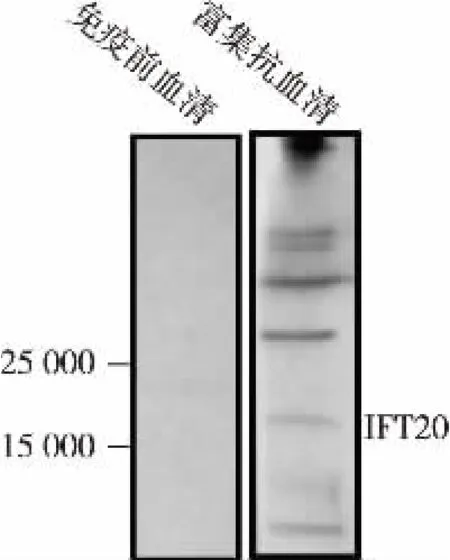
图4 免疫印迹法检测抗血清富集IgG 识别IFT20 的特异性Fig.4 Specificity of the antiserum -enriched IgG for recognizing IFT20 in immunoblotting assay
2.4.2 IFT20 抗体亲和纯化用EcoR I 和Hind III对pET-28a(+)-ift20 进行酶切获得ift20 cDNA,并将其克隆至大肠杆菌表达载体pMAL-c2x。 将连接产物转入大肠杆菌XL1-blue 细胞中, 待平板长出转化子后,随机挑取2 个转化子提取质粒进行酶切验证。 如图5 所示, 重组载体经EcoR I 和Hind III双酶切得到符合载体和目的基因大小的2 个片段,将测序验证后的载体命名为pMAL-c2x-ift20。 将pMAL-c2x-ift20 转入大肠杆菌BL21(DE3)细胞,诱导表达融合蛋白MBP::IFT20 并进行亲和纯化。 如图6 所示,MBP::IFT20 融合蛋白为水溶性蛋白质,亲和纯化所得MBP::IFT20 纯度约为93.5%。 按1.2.8 所述实验方法,将纯化后的MBP::IFT20 融合蛋白与CNBr-activated Sepharose 4B 偶联, 然后按照1.2.8 所述方法对抗IFT20 IgG 进行抗原抗体亲和纯化,收集纯化后的抗体,保存备用。
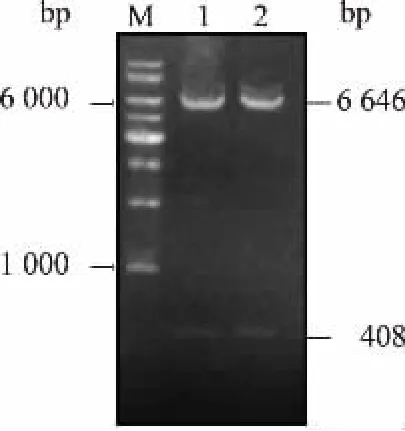
图5 重组质粒pMAL-c2x-ift20 的EcoR I 和Hind III 双酶切验证Fig.5 Double restriction digestion verification of the recombinant plasmid pMAL-c2x-ift20 by EcoR I and Hind III

图6 SDS-PAGE 检测MBP::IFT20 融合蛋白在大肠杆菌BL21(DE3)中的表达及后续纯化Fig.6 SDS-PAGE analysis of the expression of MBP::IFT20 fusion protein in E.coli BL21(DE3) and its subsequent purification
2.4.3 IFT20 抗体免疫印迹特异性检测将纯化后的IFT20 抗体稀释500 倍,对莱茵衣藻野生型藻种CC-125 的全细胞蛋白质提取物进行免疫印迹分析。 如图7 所示,纯化后的IFT20 抗体可以特异性识别莱茵衣藻内源性IFT20 蛋白。
2.5 讨论
研究莱茵衣藻IFT20 在鞭毛组装中的功能需要一支高特异性识别内源IFT20 蛋白的抗体。 在大肠杆菌中表达了N 端6×His 标签标记的莱茵衣藻IFT20 融合蛋白6×His::IFT20, 经镍柱纯化后获得纯度约85%的6×His::IFT20 融合蛋白,以该融合蛋白为抗原免疫新西兰大白兔获得IFT20 抗血清。 然而,用Protein A 富集的IFT20 IgG 对莱茵衣藻野生型藻种CC-125 全细胞蛋白质提取物中的IFT20 内源蛋白识别特异性较差,究其原因可能是该抗体的非特异性交叉识别比较严重,反映在免疫印迹上就是非特异性蛋白质杂带过多。这可能是纯化后的6×His::IFT20 融合蛋白抗原中依然存有非融合蛋白质组分,影响了动物免疫效果,但也可能是兔源抗体的特点,其抗血清本身特异性较差。 为了进一步提高IFT20 抗体的特异性,对Protein A 富集的IgG进行了抗原抗体亲和纯化,免疫印迹检测发现二次纯化的IFT20 抗体能特异性识别莱茵衣藻内源性IFT20 蛋白。因此,二次纯化策略将采用一种标准程序用来开发后续莱茵衣藻兔源多克隆抗体。 在后续抗体测试中,我们将用该IFT20 抗体对莱茵衣藻细胞进行免疫荧光染色及免疫共沉淀分析,探索其在这2 种类型的实验中应用的可能性。
3 结 语
鞭毛是一种特异化细胞“天线”,在细胞分裂、发育以及分化中均起着重要作用[21]。 鞭毛组装依赖IFT 这一双向运输机制来完成。 在这一过程中,IFT-A 蛋白复合物单一组分蛋白质缺失将破坏IFT-A 稳定性,进而影响IFT 反向运输,从而形成膨大的缺陷鞭毛[22]。 大部分IFT-B 蛋白复合物单一组 分 如IFT38[23]、IFT46[24]和IFT54[7]等 缺 失 则 只 影 响IFT 正向运输,最终导致鞭毛组装缺陷。 少数IFT-B蛋白复合物单一组分如IFT22[20]、IFT25[25]和IFT27[26]的缺失并不影响IFT 正向运输,因此不会影响鞭毛组装。目前已知IFT54 缺失破坏了IFT20 的稳定性[27],而IFT20 缺失则可导致鞭毛组装受阻[28]。 这说明IFT20 与其他大部分IFT-B 单一组分蛋白质一样,在鞭毛组装中起着重要作用。到目前为止,IFT20 调控鞭毛组装的分子机制仍不清晰, 其功能有待进一步研究。

