发酵蔬菜源食品用益生乳酸菌的筛选及降胆固醇能力评价
杜 秋, 周 晓, 覃业优, 胡嘉亮, 刘 洋, 蒋立文*
(1.湖南农业大学 食品科学技术学院,湖南 长沙 410128;2.湖南坛坛香食品科技有限公司,湖南 浏阳 410300)
联 合 国 粮 农 组 织 (FAO)、 世 界 卫 生 组 织(WHO)、国际益生菌和益生元科学协会(ISAPP)以及国际乳业联盟(IDF)对益生菌给出了定义:益生菌是活的微生物,当摄入足够数量时,对宿主的健康产生益处[1]。 因此,益生菌应具备足够数量、活菌状态和有益健康功能这三大特征[2]。 2003 年,FAO/WHO 提出了一套评价食品用益生菌的系统方法指南《食品中益生菌评价指南》,制定了益生菌的基本标准[3];2022 年中国食品科学技术学会(CIFST)发布的《食品用益生菌通则》(以下简称通则),明确规定食品用益生菌活菌数应大于(或等于)1×108CFU/mL或1×108CFU/g,并定义了食品用益生菌为可用于食品中的一种或多种益生菌,经发酵、富集、干燥或不干燥、混合或不混合、包装等工序制成的食品原料[4]。 通则对食品用益生菌的评价要求进行了系统的阐述,要求应在菌株水平进行鉴定、安全评价和健康作用评价[5]。
乳酸菌(lactic acid bacterium,简称LAB)来源广泛,随着对大健康的重视,植物源乳酸菌已引起业内的关注[6]。 传统发酵蔬菜是以蔬菜为原料,利用微生物自然发酵的冷加工食品[7]。 在我国不同地区有着丰富的传统发酵蔬菜制品[8]。 已有研究发现,不同地区的发酵蔬菜的微生物组成群落存在显著差异,但其优势细菌菌群主要为乳酸菌[9]。 因此,传统发酵蔬菜为植物源益生乳酸菌筛选提供了强大的资源库[10]。 由于植物源乳酸菌分离难度低、容易获得[11],且植物源乳酸菌与动物源乳酸菌对胃肠液具有类似的抗性[12],所以对发酵蔬菜源益生乳酸菌的研究已成为该产业的一个热点。 目前,国外对发酵蔬菜中益生菌研究较多的是韩国泡菜[13-14],而我国研究较多的是四川泡菜、东北酸菜[15],而其他地区的报道相对较少。 作者从不同地区自制的传统发酵蔬菜中分离乳酸菌,对传统发酵蔬菜源乳酸菌进行了系统益生性评价及鉴定,并分析了益生特性降胆固醇能力,旨在开发符合食品用益生菌要求的发酵蔬菜源益生乳酸菌。
1 材料与方法
1.1 材料与试剂
1.1.1 样品湖南剁辣椒、湖南芥菜、云南剁辣椒、广西发酵酸笋等共计17 个样品。
1.1.2 对照菌株 (RW)融合魏斯氏菌(Weissella confusa) CWY578262:革兰氏阳性,过氧化氢酶阴性,显微镜下呈短杆状或球状,具有益生菌的基本特性,还具有富产胞外多糖的特性[16]。
1.1.3 CaCO3-MRS 琼脂培养基MRS 琼脂培养基1 L、CaCO3(质量浓度25 g/L)、pH 6.5,121 ℃高压蒸汽灭菌20 min。
1.1.4 MRS-CHOL 肉汤培养基蔗糖酯0.1 g,胆固醇0.1 g,牛胆盐0.2 g,吐温80 1 mL,加冰乙酸5 mL,搅拌均匀,超声溶解趁热过0.45 μm 滤膜到1 L MRS 肉汤培养基中,pH 6.0~7.0,121 ℃高压蒸汽灭菌20 min。
1.1.5 氨基酸脱羧酶培养基MRS 琼脂培养基1 L,组氨酸、酪氨酸、赖氨酸、精氨酸、鸟氨酸等1 g/L,溴甲酚紫0.06 g/L,pH 5.5~6.5,121 ℃高压蒸汽灭菌20 min[17]。
1.1.6 试剂胆固醇、蔗糖酯、抗生素:源叶生物科技有限公司;邻苯二甲醛、组氨酸、酪氨酸、鸟氨酸、精氨酸、赖氨酸:国药集团化学试剂有限公司;MRS肉汤培养基、MRS 琼脂培养基、PCA 琼脂培养基:广东环凯微生物科技有限公司; 胃蛋白酶(酶活250 U/mg)、胰酶(酶活250 U/mg):南京都莱生物技术有限公司;牛胆盐:上海麦克林生化科技有限公司。
1.2 仪器与设备
DHP120 恒温培养箱: 上海实验仪器厂有限公司;HY45 恒温摇床: 深圳汇成科技有限公司;LDZX-50KBS 立式高压灭菌锅:上海申安医疗器械有限公司;CX23 光学显微镜: 日本Olympus 公司;ReadMax 1900 光吸收型全波长酶标仪:上海闪谱生物科技有限公司;TG16-WS 台式高速离心机: 湖南湘仪实验室仪器开发有限公司。
1.3 乳酸菌的分离鉴定
1.3.1 乳酸菌的分离及形态学鉴定取10 g 样品加入90 mL 无菌生理盐水中,摇匀后取适宜梯度稀释液100 μL 均匀涂布于CaCO3-MRS 琼脂培养基上,37 ℃倒置培养3 d。选取不同菌落形态且溶钙圈较大的单菌落划线至MRS 固体培养基上, 反复划线纯化,通过革兰氏染色筛选出符合乳酸菌条件的菌株。 初筛得到的乳酸菌保存于含体积分数40%甘油的MRS 肉汤培养基中,于-20 ℃冷冻保存。
1.3.2 乳酸菌耐酸耐胆盐能力参考刘璐等的方法加以修改[18],将传代3 代的实验菌株以体积分数3%分别接种于pH 值为2.0、质量浓度为3 g/L 牛胆盐的MRS 肉汤培养基中,立即取样测600 nm 处的吸光度, 剩余混合液于37 ℃、120 r/min 振荡培养,12 h 时取样,测定600 nm 处的吸光度A1,存活率按式(1)计算。
式中:R1为菌株耐酸/耐胆盐存活率,%;A1为12 h样品的吸光度;A0为0 h 样品的吸光度。
1.4 乳酸菌的生物特性评价
1.4.1 对条件致病菌的拮抗活性用琼脂孔扩散法测定待测菌株的抗菌活性, 以大肠杆菌(E.coli)、金黄色葡萄球菌(S.aureus)、枯草芽孢杆菌(B.subtilis)为指示菌。指示菌(107CFU/mL)与无菌PCA 琼脂培养基以1∶10 充分混匀后倒入放有多个无菌牛津杯的平板中,待加有病原菌的PCA 琼脂培养基冷却凝固后,用无菌镊子取出牛津杯,即形成若干琼脂孔。 分别向琼脂孔里加入100 μL 待检菌(107CFU/mL)的离心上清液于9 000 r/min 离心5 min,37 ℃培养12 h,游标卡尺测量抑菌圈直径[19]。
1.4.2 乳酸菌对胃/肠模拟液耐受性实验参考费永涛等的方法制备人工胃/肠液[20]。 将活化至3 代的菌液,用无菌PBS(pH 7.0)清洗3 次(8 000 r/min 离心10 min),用PBS(pH 7.0)反复吹打菌泥,混匀,制成供试菌悬液(1×108CFU/mL)。 移取1 mL 菌悬液接种于9 mL 人工胃液中,混匀,立即取样通过平板计数法测定其活菌数N0, 剩余混合液置于37 ℃恒温培养箱中培养,3 h 时取样测定其活菌数N1。将在模拟胃液中孵育3 h 后的菌液, 取1 mL 接种于9 mL 人工肠液中,混匀,立即取样平板计数测定其活菌数N0, 剩余混合液于37 ℃培养3 h 后取样测定其活菌数N1,存活率按式(2)计算。
式中:R2为人工胃/肠液存活率,%;N1为人工胃液/肠液处理3 h 后LAB 的活菌数,CFU/mL;N0为人工胃液/肠液处理0 h 后LAB 的活菌数,CFU/mL。
1.5 乳酸菌的安全性评价
1.5.1 抗生素耐药性安全性评价将纯化培养后的乳酸菌菌液浓度调整为1×108CFU/mL,取100 μL菌液涂布于MRS 固体培养基, 待菌液吸收后放置药敏纸片,37 ℃培养24 h。每组重复3 次,记录抑菌圈直径,根据表1 进行药物敏感性判定。

表1 微生物药物敏感实验执行标准Table 1 Criteria for microbial drug susceptibility test
耐存率按式(3)计算:
式中:R3为乳酸菌耐药率,%;N1为耐药和中介菌株总数,CFU;N0为实验菌株总数,CFU。
1.5.2 乳酸菌γ-溶血实验将供试菌株点接于脱纤维绵羊血琼脂平板上, 以金黄色葡萄球菌为对照,37 ℃培养24 h 后观察菌落是否具有溶血现象。
1.5.3 乳酸菌氨基酸脱羧酶活性实验将乳酸菌点接在氨基酸脱羧酶培养基上,37 ℃培养24 h 后观察菌落周围颜色变化,若培养基变成紫色,即氨基酸脱羧酶活性阳性,则具有潜在产胺威胁;若为黄色,即氨基酸脱羧酶活性阴性,该乳酸菌无潜在产胺威胁。
1.6 乳酸菌的降胆固醇能力评价
参考余萍等[21]的方法稍做修改,将活化3 代后的乳酸菌调节菌浓度为1×108CFU/mL,按体积分数3%接种至MRS-CHOL 培养基中,37 ℃培养48 h后,9 000 r/min 离心5 min,取上清液,采用邻苯二甲醛比色法测定550 nm 处的吸光度, 胆固醇去除率见式(4)。
式中:R4为胆固醇去除率,%;A0为未接种菌株培养48 h 后离心上清液的吸光度;A1为接种培养48 h后离心上清液的吸光度。
1.7 乳酸菌对Caco-2 细胞黏附能力评价
参考郭志华等的方法, 将Caco-2 细胞密度调整为1×105CFU/mL, 并分装于24 孔培养板中培养至单层细胞待用[22]。取2 mL 待测菌液(108CFU/mL)于9 000 r/min 离心5 min,用2 mL DMEM 培养基将菌体重悬并进行菌落计数(M0),剩余混合液取200 μL加入24 孔板中,于37 ℃、体积分数5% CO2孵育1 h 后用PBS(pH 7.0)清洗细胞表面未黏附的乳酸菌,加入2 mL 胰酶消化5 min 后用2 mL DMEM 培养基重悬并进行活菌计数(M1)。 黏附率按照式(5)计算。 乳酸菌活菌计数参照申文熹等的方法进行菌落计数[23]。
式中:R5为乳酸菌黏附率,%;M1为黏附的乳酸菌的菌落总数,CFU/mL;M0为待测重悬液菌落总数,CFU/mL。
1.8 乳酸菌的分子生物学鉴定
1.8.1 菌株鉴定将乳酸菌纯化3 代后委托杭州联川生物有限公司进行16S rDNA 测序鉴定。
1.8.2 同源性分析利用BlAST 网站(https://blast.ncbi.nlm.nih.gov/Blast.cgi)找到与鉴定菌株同源性最高的菌株并下载序列, 使用MEGA7 软件构建系统发育树。
1.9 数据分析
分析、计算、图表绘制分别采用DPS 数据处理软件和OriginPro 2021(64-bit)软件。 各实验组重复3 次,以平均值±标准差(±s)表示。
2 结果与分析
2.1 乳酸菌的初步筛选结果
传统发酵蔬菜样品经过菌种分离纯化,筛选出革兰氏阳性的96 株溶钙菌株,初筛判断为乳酸菌。部分菌落形态与镜检结果见图1。
图1 乳酸菌菌落形态及革兰氏染色结果Fig.1 Colonial morphology and gram staining results of LAB
2.2 乳酸菌对酸和胆盐耐受特性
益生菌需要到达肠道才能发挥其益生功能。 益生菌从口腔到人体肠道的过程中需要耐受胃中的低pH 环境[23],以适应小肠中胆盐胁迫[24]等不良环境[25]。因此,具有耐受人体胃肠道环境的抗逆能力已经成为评价益生菌的一项重要指标[26]。 作者将初筛获得的菌株依次在pH 2.0 和质量浓度3 g/L 牛胆盐的MRS 液体培养基中处理12 h 进行筛选。 如图2(a) 所示,96 株乳酸菌经pH 2.0 培养12 h 后得到25株乳酸菌且存活率在65%以上, 其中有10 株菌活菌数较之前有所增加,表明耐酸能力强。 25 株耐酸乳酸菌经质量浓度3 g/L 牛胆盐处理12 h 后,有24株乳酸菌能存活,存活率在35%以上,见图2(b)。 表明这24 株菌对酸和胆盐具有良好的耐受性。
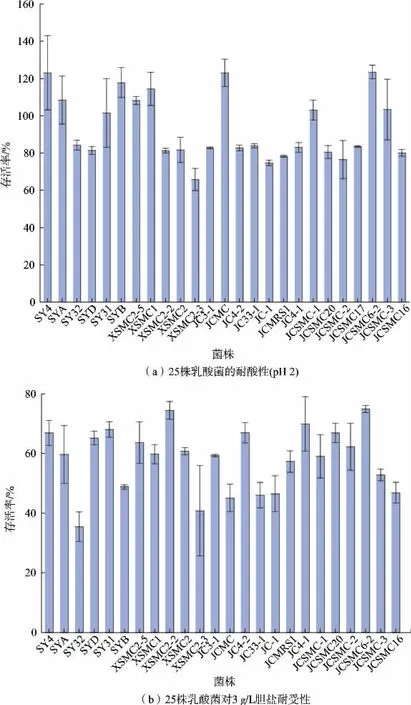
图2 乳酸菌的耐酸性及胆盐耐受性实验结果Fig.2 Acid tolerance and bile salt tolerance tests results of LAB
2.3 生物特性评价
2.3.1 抑菌实验乳酸菌可以抑制病原菌的生长繁殖,有助于胃肠道环境健康[27]。 24 株乳酸菌对病原菌抑菌能力的检测结果见表2。 37 ℃培养12 h后, 有22 株菌株对金黄色葡萄球菌有显著抑菌效果,平均抑菌直径为(30.60±0.46) mm;所有菌株对枯草芽孢杆菌都有抑菌效果, 平均抑菌直径为(19.87±0.30) mm。表明大多数乳酸菌对所选择的革兰氏阳性病原菌具有显著抑菌效果。 多数菌株对大肠杆菌也具有抑菌效果, 平均抑菌直径为(12.20±0.35) mm, 表明实验菌株对大肠杆菌抑菌能力一般。 值得注意的是,菌株SY4、SY32、JC3-1、JCMC、JC4-1 对大肠杆菌没有抑菌效果, 菌株JCSMC-3、JCSMC16 对金黄色葡萄球菌没有抑菌效果;而其余17 株菌株对3 株病原菌均有抑菌效果,表明其抑菌谱较广且抑菌能力更强。

表2 乳酸菌对病原菌的抑菌直径Table 2 Inhibition zone diameter of LAB against pathogenic bacteria 单位:mm
2.3.2 模拟胃肠液耐受特性评价乳酸菌在胃肠消化过程中,除了受低酸和胆盐的影响,各种消化酶也会影响乳酸菌最终到达肠道的活菌数[28-29]。 作者以RW 为参考, 测定24 株乳酸菌在模拟胃/肠液中的存活情况。 由表3 可知,24 株菌株在模拟胃液中处理3 h 均能存活,但其存活能力存在差异。菌株SY4、JC33-1、XSMC1、JC-1 在模拟胃液中存活率较高,均大于100%。 菌株SY32、JC4-1、SY31、JCMC、SYA、JCSMC-2、XSMC2-2、SYD、JCSMC16 在模拟胃液中的存活率(55.83%~87.64%)高于RW 的存活率(48.80%)。 其余11 株的存活率低于融合魏斯菌,其中XSMC2-3 的存活率最低(3.08%),但活菌数仍高于106CFU/mL。
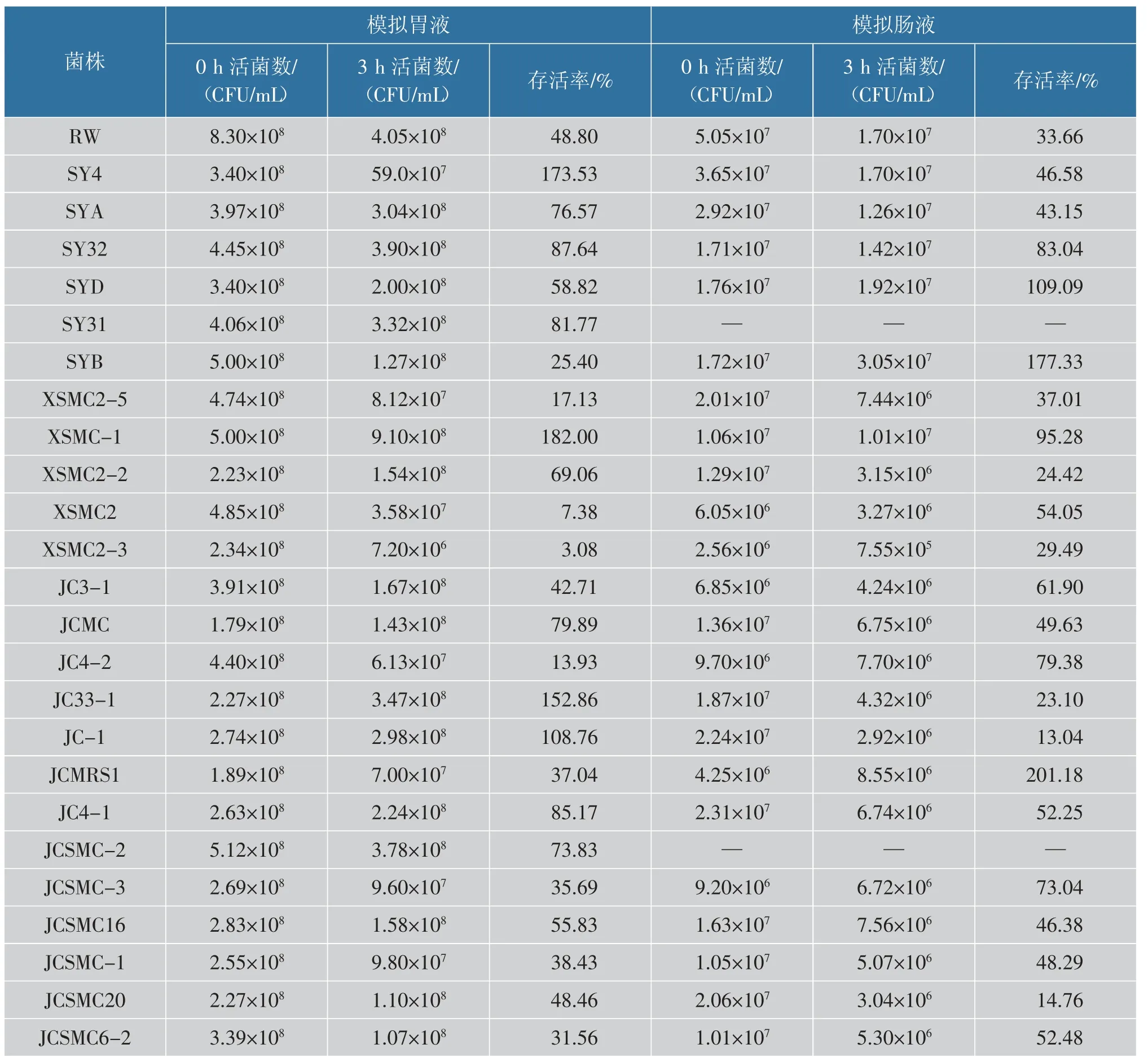
表3 乳酸菌在人工胃肠液中的活菌数及存活率Table 3 Viable count and survival rates of LAB in artificial gastrointestinal fluids
24 株实验菌株经模拟肠液处理3 h 后,除菌株SY31 和JCSMC-2 对模拟肠液无耐受能力, 其余菌株对模拟肠液均表现出不同程度的耐受能力,见表3。 其中菌株XSMC2-3 耐受能力较弱,活菌数仅有7.55×105CFU/mL, 表明菌株XSMC2-3 受到模拟肠液的影响较大。
2.4 安全性评价
通过对实验菌株的生物特性评价,选择抑菌谱较广、抑菌能力较强且对胃肠道环境耐受能力强的18 株乳酸菌进行安全性评价。 18 株菌株对9 种抗生素的耐药性检测结果见表4。 18 株乳酸菌对四环素、氯霉素、氨苄西林、红霉素具有敏感性;对万古霉素、庆大霉素、卡那霉素、链霉素具有耐药性。 据报道,多数乳酸菌对糖肽类(万古霉素)和氨基糖苷类(庆大霉素、卡那霉素和链霉素)的抗生素具有天然耐受能力[30-31]。 克林霉素主要是通过抑制细菌蛋白质合成从而达到抑菌效果[32],因此35%的供试菌株的蛋白质合成不受克林霉素抑制, 表现出耐药性。18 株供试菌株均无溶血现象且在氨基酸脱羧酶培养基上呈阴性,表明这18 株试验菌株均为安全菌株。
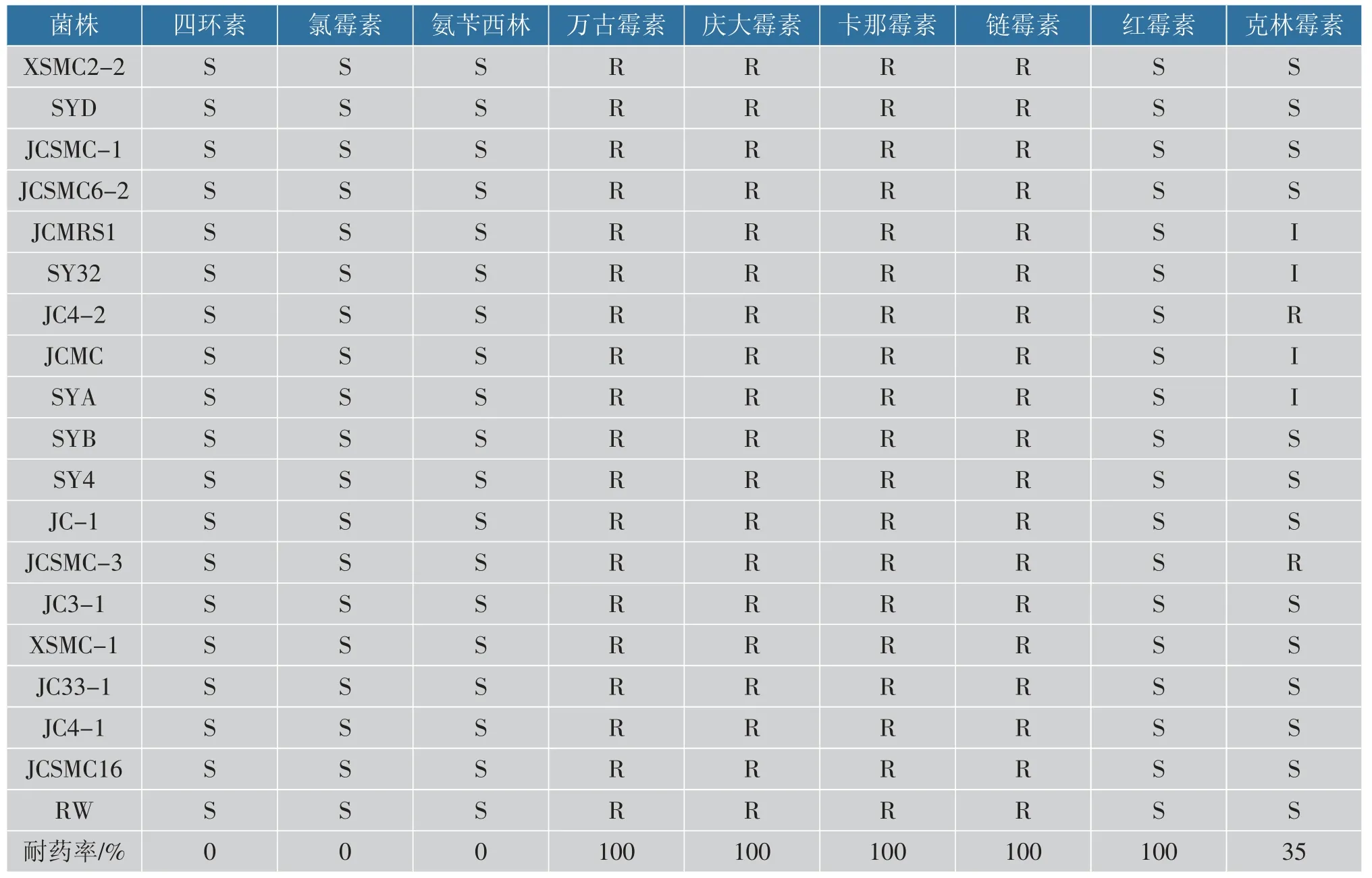
表4 乳酸菌对不同抗生素的耐药性Table 4 Resistance of LAB to different antibiotics
2.5 益生乳酸菌降解胆固醇能力评价
由图3 可知,18 株乳酸菌培养48 h 后胆固醇的去除率均大于40%。 对照菌株RW 培养48 h 后胆固醇去除率达到54.56%。 除JC4-1、JCSMC16、JC33-1、JCSMC-3、XSMC2-2 外其余13 株菌株的胆固醇去除率则高于RW 的胆固醇去除率,其中菌株SYD 的胆固醇去除率高达62.54%。
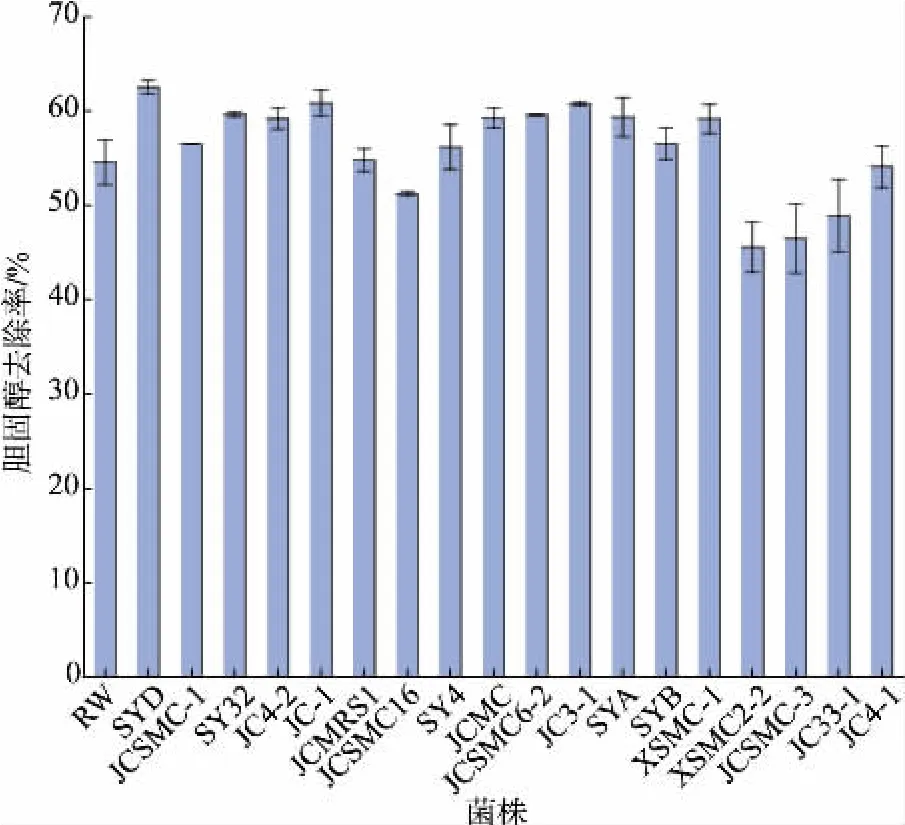
图3 乳酸菌的胆固醇降解率Fig.3 Rate of cholesterol removal by LAB
2.6 益生乳酸菌对Caco-2 黏附能力的评价
13 株降胆固醇益生乳酸菌对Caco-2 细胞的黏附率见图4。有9 株乳酸菌对Caco-2 细胞的黏附率高于对照菌株RW 的黏附率 (62.10%), 其中菌株SYB 的黏附率高达81.74%;余下菌株的黏附率均低于RW 的黏附率(62.10%),但均在45%以上。 黏附性强的乳酸菌更容易在肠道中定植[33-35],从而发挥益生作用。 故选择黏附率前5 名的菌株进行鉴定。

图4 乳酸菌对Caco-2 细胞的黏附作用Fig.4 Adhesion of LAB to Caco-2 cells
2.7 乳酸菌16SrDNA 分子鉴定结果
通过构建的系统发育树获得同源菌株信息见表5。 可知菌株JCSMC-1 与植物乳植杆菌(Lactiplantibacillus plantarum),菌株SYB、JCSMC6-2 与植物乳杆菌 (Lactobacillus plantarum), 菌株SYD、XSMC-1 与 副 干 酪 乳 酸 菌(Lacticaseibacillus paracasei)的亲缘关系分别最近,且序列相似性均高达100%。
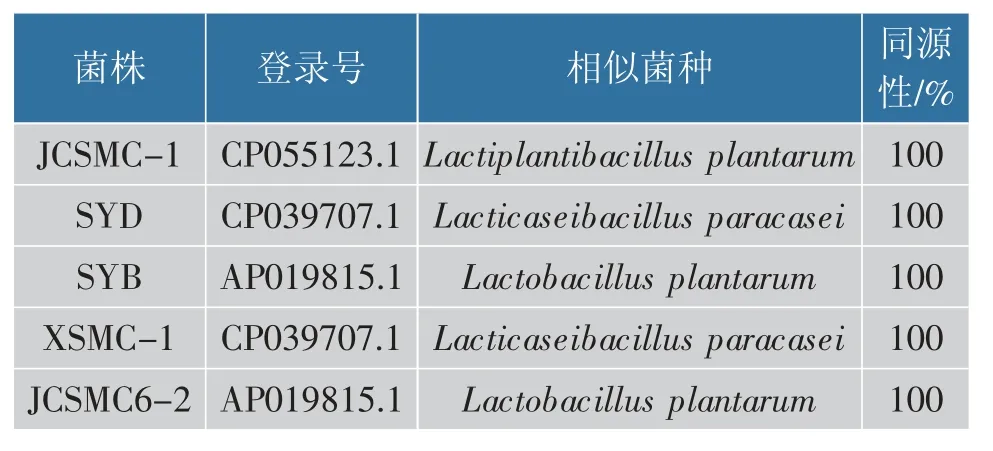
表5 乳酸菌鉴定结果Table 5 Identification of LAB
3 结 语
本研究筛选得到的5 株发酵蔬菜源益生乳酸菌JCSMC-1、SYB、JCSMC6-2、SYD、XSMC-1 具 有较好的胆固醇去除能力(45.55%~62.54%)。同时,对酸、胆盐和模拟胃/肠液耐受性强,对Caco-2 细胞黏附性也强;另外,对大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌具有一定的抑菌效果,且在绵羊血培养基均没有溶血现象,经氨基酸脱羧酶培养基检测表明没有产生物胺的潜在威胁;5 株菌株对所选用的6 种抗生素表现出敏感性,3 种(1 种糖肽类、2 种氨基糖苷类)抗生素表现出耐药性,这可能是乳酸菌对糖肽类和氨基糖苷类抗生素具有天然耐受能力;经16S rDNA 鉴定, 菌株JCSMC-1 为植物乳植杆菌,SYB、JCSMC6-2 为植物乳杆菌,SYD、XSMC-1为副干酪乳酸菌。综上所述,5 株菌株可作为潜在的食品用益生菌,进一步用于功能性乳制品的开发。

