低分子肝素对内毒素诱导肝细胞凋亡及炎症的影响
潘毅,陈军喜,夏至辉,闫智杰(南昌大学第四附属医院,江西 南昌 330002)
脓毒症(Pyohemia)是一种由全身感染引起的危及生命的疾病,其伴随着严重的炎症反应以及免疫反应失调等特征,导致器官功能衰竭[1]。肝脏是调节宿主代谢以及免疫防御的主要器官,而肝衰竭和功能障碍是脓毒症的并发症之一,也是死亡率较高的原因之一[2]。低分子肝素(Low Molecular Weight Heparin,LMWH)是临床抗凝的常用药物,在临床防治脓毒症肝损伤上取得了良好的疗效。唐勇[3]等人采用Meta分析研究探索了低分子肝素对中国人群脓毒症疗效,结果显示LMWH治疗脓毒症可以降低病死率和APACHEⅡ评分。本课题组既往采用经典的大鼠盲肠结扎穿孔脓毒症模型证实LMWH能显著降低脓毒症大鼠肝的损害、抑制炎症因子的释放[4]。本研究拟进一步采用LPS诱导体外培养肝细胞损伤及炎症模型,探索LMWH防治脓毒症肝损伤的机制,为LMWH治疗脓毒症肝损伤提供实验依据。
1 材料与方法
1.1 材料 LMWH购自河北常山生化药业有限公司(批号:F402160906);谷胱甘肽(GSH)购自碧云天生物技术有限公司(货号:S0073);TUNEL染色试剂盒购自美国罗氏生物(货号:11684795910);肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)Elisa试剂盒购自武汉博士德生物工程公司(货号:EK0525、EK0410);LPS购自美国Sigma公司(货号:L2630);MTS检测试剂盒购自美国Promega公司(货号:G3582);乳酸脱氢酶(LDH)细胞毒性检测试剂盒购自碧云天生物(货号:C0016);DMEM培养液、胎牛血清购自美国Gibco公司(货号:10099133、11965092);兔抗NF-κBp65、p-NF-κBp65、GAPDH抗体购自美国CST公司(货号:8242、3033、5147)。
1.2 细胞培养及分组 Lo2人正常肝细胞购自中国科学院典型培养物保藏委员会细胞库,用含10%FBS的DMEM培养基,在37℃、5%CO2的细胞培养箱中培养。将Lo2细胞分为以下几组:对照组:给予等体积的溶剂;LPS组:加入20ng/mlLPS;LMWH低、中、高剂量组:分别给予100U/L、200U/L、400U/L的LMWH;GSH组给予20μMGSH处理24h。
1.3 MTS细胞活力检测 按照4×103/孔,将Lo2细胞接种于96孔板,按实验分组给予不同的处理。24h后,弃去培养液,加入新鲜的DMEM培养基(100μl)和MTS检测液(10μl)孵育2h后,用酶标仪(美国伯腾公司,Epoch)检测波长490nm处吸光度(OD值)。细胞活力=(干预组OD-空白孔OD)/(对照组OD-空白孔OD)×100%。每组设6个复孔,取其平均值。
1.4 TUNEL染色 TUNEL染色按试剂盒说明书进行操作。TUNEL用于标记凋亡细胞,阳性凋亡细胞呈绿色,DAPI用于标记细胞核,呈蓝色。每孔随机观察5个200倍视野,分别计数细胞核总数(标记蓝色荧光)和凋亡细胞数(标记绿色荧光)计算凋亡指数(Apoptosis Index%)。Apoptosis Index(%)=凋亡阳性细胞核数÷总计数的细胞核×100%。
1.5 Elisa检测 将Lo2细胞接种于24孔板,按实验分组给予不同的处理,每组6个副孔。24h后,收集细胞上清,根据Elisa试剂盒说明书检测TNF-α、IL-6含量。
1.6 Western blot检测 不同刺激处理Lo2细胞24小时后,PBS洗1次,加入适量的RIPA裂解液(碧云天生物)裂解,提取总蛋白用BCA蛋白定量试剂盒(碧云天生物)定量,样品加入缓冲液,100℃、5min变性,总蛋白上样量为10μg,用10%的SDS-PAGE电泳在蛋白电泳仪(美国Bio-Rad公司,Mini-PROTEANTetra)分离,半干电转法将蛋白质转移至PVDF膜,5%脱脂奶粉37℃封闭1h后,分别用相应的1抗(1∶1000)在4℃过夜,TBST洗膜3次后用2抗(CST公司,1∶5000稀释)在室温孵1h,TBST洗膜3次后用ECL化学发光法检测蛋白条带,用GAPDH蛋白条带作为内参,计算目的条带和内参条带的灰度值之比。
1.7 统计分析 采用SPSS16.0软件进行统计分析。实验数据以均数±标准差(MeanSD)表示,One-way ANOVA方差分析用于多重比较,方差齐性采用LSD进行两两比较,方差不齐性的采用Dunnetts T3进行两两比较,P<0.05表示差异具有统计学意义。
2 结果
2.1 LMWH对LPS诱导肝细胞损伤的影响MTS结果如图1A所示,LPS处理Lo2细胞24h后,Lo2细胞的细胞活力显著降低,与对照组比较,差异有统计学意义(P<0.05)。LMWH与LPS共同处理Lo2细胞24h后,LMWH能剂量依赖性地抑制LPS诱导的细胞活力降低(P均<0.05)。LDH检测结果如图1B所示,LPS处理Lo2细胞24h后,Lo2细胞LDH释放显著升高,与对照组比较,差异有统计学意义(P<0.05),LMWH与LPS共同处理Lo2细胞24h后,LMWH能剂量依赖性地抑制LPS诱导的LDH释放增加(P均<0.05)。GSH能显著抑制LPS诱导的细胞活力降低和LDH释放显著升高,与LPS组比较,差异有统计学意义(P<0.05)。GSH组的细胞活力、LDH含量与LMWH高剂量组比较,差异没有统计学意义(P>0.05)。
2.2 LMWH对LPS诱导肝细胞凋亡的影响 TUNEL染色结果如图2所示,LPS处理Lo2细胞24h后,Lo2细胞的凋亡指数显著升高,与对照组比较,差异有统计学意义(P均<0.05)。LMWH与LPS共同处理Lo2细胞24h后,LMWH能剂量依赖性地抑制LPS诱导的凋亡指数升高,与LPS组比较,差异有统计学意义(P均<0.05)。GSH能显著抑制LPS诱导的细胞凋亡,与LPS组比较,差异有统计学意义(P<0.05)。GSH组的凋亡率与LMWH高剂量组比较,差异没有统计学意义(P>0.05)。
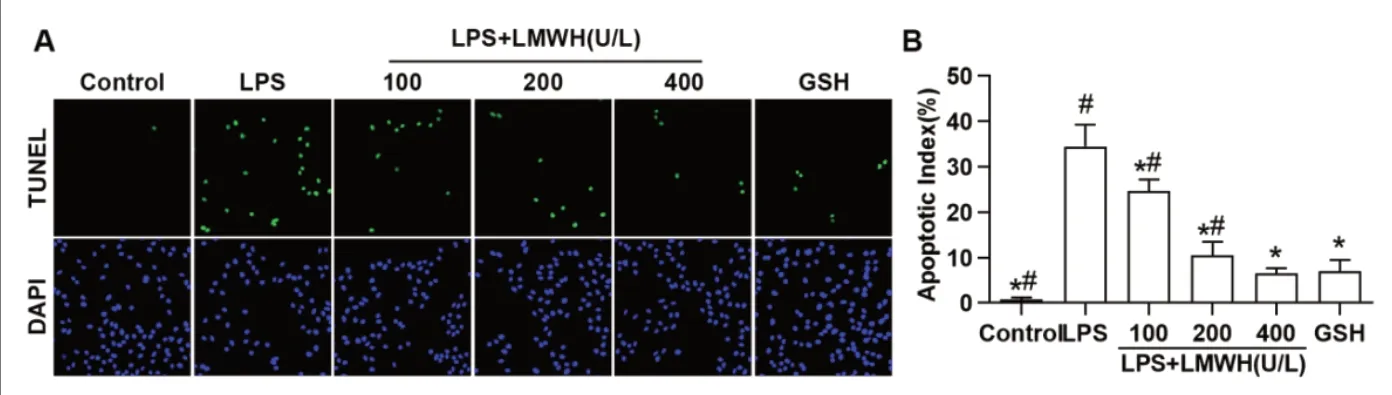
图2 LMWH对LPS诱导肝细胞凋亡的影响。注:A:TUNEL凋亡染色图像;B:凋亡指数(n=3)。与LPS组比较,*P<0.05;与GSH组比较,#P<0.05
2.3 LMWH对LPS诱导肝细胞炎症的影响 TNF-α、IL-6结果如图3所示,LPS处理Lo2细胞24h后,Lo2细胞的TNF-α、IL-6的含量显著升高,与对照组比较,差异有统计学意义(P均<0.05)。LMWH与LPS共同处理Lo2细胞24h后,LMWH能剂量依赖性地抑制LPS诱导的TNF-α、IL-6含量升高,与LPS组比较,差异有统计学意义(P均<0.05)。GSH能显著抑制LPS诱导的TNF-α、IL-6升高,与LPS组比较,差异有统计学意义(P<0.05)。GSH组的TNF-α、IL-6含量与LMWH高剂量组比较,差异没有统计学意义(P>0.05)。
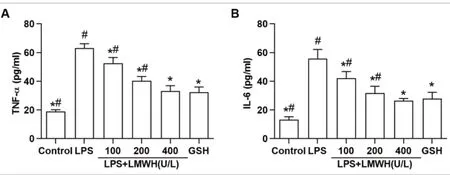
图3 LMWH对LPS诱导肝细胞炎症的影响。注:A:TNF-α含量(n=6);B:lL-6含量(n=6)。与LPS组比较,*P<0.05;与GSH组比较,#P<0.05
2.4 LMWH对LPS诱导NF-κB激活的影响 Western blot结果如图4所示,LPS处理Lo2细胞24h后,Lo2细胞中p-p65的含量显著升高,与对照组比较,差异有统计学意义(P均<0.05)。LMWH与LPS共同处理Lo2细胞24h后,LMWH能剂量依赖性地抑制LPS诱导的p-p65含量升高,与LPS组比较,差异有统计学意义(P均<0.05)。GSH能显著抑制LPS诱导的NF-κB激活,与LPS组比较,差异有统计学意义(P<0.05)。GSH组的p-P65含量与LMWH高、中剂量组比较,差异没有统计学意义(P>0.05)。
3 讨论
脓毒症是由感染引起的全身炎症反应综合征,脓毒症导致肝功能障碍甚至肝功能衰竭[5]。LPS是脓毒症引起肝损伤的重要机制,脓毒症早期,肠黏膜通透性增高,肠道细菌或LPS通过门静脉移位至肝脏,引起肝细胞的凋亡和炎症[6]。目前,恢复肝功能已经成为降低脓毒症死亡率的重要途径[7-8]。LMWH由普通肝素经化学或酶学方法解聚而成,相对分子质量为45000D,是一种临床上常用的抗凝药物。目前已证实,LMWH能够抑制脓毒症患者炎性介质和氧自由基的释放,抑制细胞黏附和激活、补体系统的激活,保护血管内皮细胞的连续性和完整性,从而改善脓毒症患者微循环功能[9]。本研究针对LMWH对LPS诱导肝细胞凋亡的作用及机制进行探索。
本研究采用20ng/ml的LPS刺激肝细胞,制备LPS诱导Lo2肝细胞损伤模型,结果显示LPS显著降低肝细胞的细胞活性、增加LDH释放,这提示LPS诱导了肝细胞的损伤,表明了脓毒症大鼠模型建立成功,与既往的研究[10]结果一致。本研究在该模型上探索LMWH对LPS诱导肝细胞损伤的影响,发现LMWH能剂量依赖性地抑制LPS诱导的肝细胞损伤,提示LMWH具有肝细胞保护作用。凋亡是细胞死亡的重要方式之一,研究证实LPS可以诱导肝细胞的凋亡[11]。本研究进一步探索了LMWH对LPS诱导肝细胞凋亡的影响,结果显示LMWH能剂量依赖性地抑制LPS诱导的肝细胞凋亡。该研究提示LMWH可能通过抑制细胞凋亡发挥肝细胞保护作用。既往研究发现肝素对体外培养的内皮细胞具有保护作用[12]。笔者既往的研究在动物层面上证实了LMWH能防治脓毒症肝脏引起的肝损害,而本研究第一次在细胞层面上证实了LMWH具有肝细胞保护作用。
炎症因子的释放在脓毒症肝损伤中起重要作用。LPS可诱导肝脏细胞释放大量细胞因子,如TNF-α、IL-6等,这些炎症因子进一步通过炎症级联反应生成大量氧自由基和过氧化反应产物,引发膜脂质过氧化级联反应,破坏肝细胞膜及线粒体膜完整性,引起肝细胞凋亡[13-14]。因此,本研究进一步探索了LMWH对LPS诱导肝细胞释放炎症因子的影响。结果显示,LMWH能剂量依赖性地抑制炎症因子TNF-α、IL-6的释放,这提示LMWH可能通过LPS诱导的炎症反应抑制肝细胞的凋亡。
NF-κB是一个重要的转录因子,几乎所有类型细胞都存在NF-κB[15]。NF-κB能被多种细胞刺激所激活,包括LPS、氧化应激、细胞因子、紫外线照射等。既往研究证实LPS能通过激活NF-κB诱导肝细胞的凋亡[16]。NF-κB p65是NF-κB转录因子复合物的重要组成部分之一,NF-κB p65的Ser536位点被磷酸化是NF-κB被激活的标志[17-18]。为了观察LMWH对LPS诱导NF-κB激活的影响,笔者检测了Lo2细胞中NF-κB p65的磷酸化水平。结果显示LMWH能剂量依赖性地抑制p65的磷酸化,这提示LMWH可能通过抑制NF-κB抑制LPS诱导的肝细胞凋亡。
综上所述,本研究显示,LMWH能够改善LPS诱导的肝细胞损伤和细胞凋亡,一定程度上可缓解LPS诱导的细胞炎症水平。同时,LMWH能够抑制LPS诱导NF-κB的激活,提示LMWH可能通过抑制NF-κB发挥其肝细胞保护作用。

