多房棘球蚴RNA结合蛋白EWS的原核表达及其细胞定位与功能的初步鉴定
严玉婷,郭小腊,孙 玥,何学东,丁军涛*,郑亚东
(1.新疆大学生命科学与技术学院,新疆乌鲁木齐 830046;2.中国农业科学院兰州兽医研究所,甘肃兰州 730046;3.浙江农林大学动物科技学院/动物医学院,浙江杭州 311300)
泡型棘球蚴病(Alveolar echinococcosis,AE)是多房棘球绦虫(Echinococcusmultilocularis)的中绦期幼虫所引起的一种人畜共患寄生虫病[1]。在我国,AE多发生在新疆、宁夏、青海、甘肃和西藏等畜牧地区[2-4]。人因误食了被虫卵污染的食物或水源而受到感染[5]。多房棘球蚴可在患者体内呈肿瘤样生长并形成实质性肿块,从而损害肝脏等脏器。该病病程长且不易察觉,难以根治,病灶类似“肝癌”[6]。由于多房棘球蚴病的发病机制至今还尚未明了,并且依然缺乏有效的早期诊断方式,“早期发现,尽早治疗”难以实现,使得多房棘球蚴病发生率仍高居不下。
RNA结合蛋白(RNA binding proteins,RBPs)尤文氏肉瘤(Ewing sarcoma,EWS)蛋白属于TET家族,该家族由liposarcoma/fused in sarcoma 蛋白 (FUS/TLS)、EWS蛋白 和TATA结合蛋白相关因子15(TATA-binding protein-associated factor 15,TAF15)组成[7]。RBPs在转录和转录后基因表达调控中起着重要作用,如RNA转录、剪接、运输、翻译和衰变等[8]。在Hela细胞中,敲除EWS基因会导致其靶标miRNA的表达下调[9];染色体易位导致的EWS与ETS家族FLI1基因的融合会诱发人类的实体瘤[10];除此之外,Li H等[11]证明EWS基因敲除小鼠的死亡率高达90%,这可能与B细胞发育和减数分裂有关。但多房棘球绦虫中的EWS(EmEWS)基因的功能还未见报道。因此,本研究通过对EmEWS进行原核表达、抗体制备、细胞定位及其与RNA的结合能力等研究,初步探究EmEWS蛋白的功能。
1 材料与方法
1.1 材料
1.1.1 寄生虫和实验动物 多房棘球蚴原头蚴取自本实验室(兰州兽医研究所家畜疫病病原生物学国家重点实验室)饲养的保种宿主长爪沙鼠,未成熟成虫由中国新疆农垦科学院王正荣博士提供;新西兰大白兔,购自中国农业科学院兰州兽医研究所实验动物中心。
1.1.2 主要试剂与设备 T4连接酶、荧光二抗Alexa Fluor 594山羊抗家兔IgG,美国Thermo Fisher Scientific公司产品。PrimeSTAR HS DNA Polymerase,日本TaKaRa公司产品;二抗 HRP 标记的山羊抗家兔 IgG,美国Sigma公司产品;ABI 7500荧光定量PCR仪,美国ThermoFisher Scientific公司产品。
1.2 方法
1.2.1 序列比对和系统发育分析 根据EmEWS(EmuJ-001020700)蛋白序列,在Wormbase中检索并下载其同源序列。利用NCBI结构预测网站(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)对EmEWS的保守区域进行预测,利用Clustal W (MEGA7.0)进行多序列比对,采用邻接法(Neighbor-joining)构建系统发育树。
1.2.2 多房棘球蚴原代细胞的分离及培养 根据先前报道过的方法[12],从感染多房棘球蚴的长爪沙鼠腹腔中分离出包囊,用手术剪剪为小块,置于37 ℃条件下2.5 mg/mL的胰蛋白酶中消化30 min,用40 μm的细胞滤器过滤,4 ℃条件下500 r/min离心10 min,获得细胞沉淀,重悬沉淀并用含有100 mL/L胎牛血清的DMEM培养。
1.2.3 实时荧光定量PCR 提取多房棘球蚴原代细胞、包囊、原头蚴以及未成熟成虫的总RNA,测定浓度后,分别取0.5 μg总RNA。按照RevertAid cDNA第一链合成试剂盒说明书合成cDNA,合成的cDNA用无RNA酶水5倍稀释,每个实时荧光定量PCR反应的总体积是20 μL:2×SYBR Green PCR Master Mix 10 μL,cDNA 2 μL,ROX 0.1 μL,引物2 μL(表1), ddH2O 5.9 μL。以β-actin为内源内参基因,荧光定量PCR反应条件:95 ℃ 10 min,95 ℃ 10 s,60 ℃ 1 min,共40个循环。每个试验3个重复。

表1 实时定量PCR引物
1.2.4EmEWS基因的克隆、表达及纯化 根据Wormbase中EmEWS(EmuJ-001020700)基因序列设计引物,上游引物:5′-GAATTCATGGCCGATCAATACCAA-3′(下划线部分为EcoRⅠ酶切位点),下游引物:5′-AAGCTTTTAGTATGGAGTGGTGCG-3′(下划线部分为Hind Ⅲ酶切位点)。以上述原头蚴cDNA为模板,PCR扩增程序:95 ℃ 5 min;95 ℃ 30 s,58 ℃ 30 s,72 ℃ 1 min,共35个循环。扩增产物经10 g/L凝胶电泳验证后回收,并连接至pEASY-T5 Zero载体上构建成pEASY-T5 Zero-EmEWS重组质粒。
用EcoRⅠ和Hind Ⅲ双酶切目的基因与pET-28a载体,回收,再经T4连接酶16 ℃过夜连接。采用42 ℃热激法转化并挑取阳性克隆进行PCR、测序验证,将正确的pET-28a-EmEWS重组质粒转化至表达菌株BL21(DE3)。
挑取阳性克隆于37 ℃ 200 r/min振荡培养4 h,再加入终浓度为0.5 mmol/L的IPTG,37 ℃、200 r/min振荡过夜。离心收集菌体,用PBS洗涤后,取5 mL菌液超声破碎,收集上清与沉淀,用120 g/L SDS-PAGE电泳检测EmEWS表达情况。大量诱导重组菌,用PBS稀释超声破碎物沉淀,再经0.5 μm滤器过滤。将滤液与亲和层析柱室温结合1 h,用30 mmol/L、60 mmol/L咪唑PBS缓冲液各洗涤3次,用200 mmol/L咪唑PBS缓冲液洗脱,收集洗脱液,置于PBS缓冲液中4 ℃过夜旋转透析,用120 g/L SDS-PAGE电泳验证纯化效果。
1.2.5 多克隆抗体的制备及Western blot验证 取纯化后的重组蛋白与等体积弗氏佐剂混合并完全乳化,对2只新西兰大白兔进行免疫接种(背部皮下多点注射)。免疫接种剂量每只200 μg,免疫接种时间间隔为14 d,第1、2次免疫采用弗氏不完全佐剂,第3次免疫采用弗氏完全佐剂,每次免疫接种前均进行耳缘静脉采血。免疫结束后收集抗血清,并利用Protein G亲和层析柱采用饱和硫酸铵法对抗血清进行纯化,纯化后的多克隆抗体置于-20 ℃保存备用。
取10 μg多房棘球蚴全虫蛋白与loading buffer混匀,煮沸10 min后进行SDS-PAGE电泳,随后转印至0.22 μm PVDF膜上,用7.5%脱脂奶粉液室温封闭1 h。用1∶1 000稀释的多克隆抗体4 ℃过夜孵育。PBST清洗3次后,加入HRP标记的山羊抗兔IgG(1∶10 000稀释),37 ℃孵育1 h,500 μL ECL发光液显色5 min后曝光。阴性血清为对照。
1.2.6 免疫荧光试验 多房棘球蚴原代细胞在含有100 mL/L胎牛血清的DMEM中培养2~3 d,直至细胞贴壁,用40 mg/mL多聚甲醛冰上固定细胞15 min,用含30 mL/L Triton X-100的PBS通透15 min,PBS清洗3次。5%脱脂奶粉液37 ℃封闭1 h,按1∶200滴加多克隆抗体,4 ℃过夜孵育后滴加Alexa Fluor 594山羊抗兔IgG抗体置于37 ℃孵育1 h。滴加DAPI染色液封片,最后置于共聚焦荧光显微镜下观察图像。
1.2.7 双荧光试验 根据先前报道过的方法[9]并加以改良,按照Wormbase中EmEWS(EmuJ-001020700)基因序列设计引物,将EmEWS基因序列连接至Myc载体上构成Myc-EmEWS重组质粒。上游引物:5′-GAATTCCCATGGCCGATCAATAC-3′(下划线部分为EcoRⅠ酶切位点),下游引物: 5′-CTCGAGTTAGTATGGAGTGGTG-3′(下划线部分为XhoⅠ酶切位点)。由西安擎科将富含UG序列的5′-ACCCAGUAGCCAGAUGUAGCU-3′ RNA片段合成至pGL3-Promoter载体(含萤火虫荧光素酶报告基因)上,pRL-TK载体(含海参荧光素酶报告基因)为内参。
双荧光试验将HEK293T细胞分为两组:1 μg Myc-Control+1 μg pGL3+0.1 μg pRL-TK为对照组,1 μg Myc-EmEWS+1 μg pGL3+0.1 μg pRL-TK为试验组。用脂质体2000转染,转染24 h后利用双荧光素酶报告基因检测系统检测荧光素酶活性。
1.2.8 数据处理 使用Graphpad Prism 8进行统计分析,采用2-△△Ct计算基因相对表达水平,使用Student’s t检验进行组间差异分析,使用One-way ANOVA进行组内差异分析,P<0.05为组间差异显著。数值为平均值±标准差。
2 结果
2.1 EmEWS的基因特征
通过分析发现,多房棘球绦虫仅有1个EmEWS基因拷贝,位于2号染色体上。EmEWS基因全长1 485 bp,共编码494个氨基酸。EmEWS含有1个RNA结合域(RNA-binding domain,RBD)和一个锌指结构,RBD结构域位于201-285氨基酸处,锌指结构位于羧基端367-396氨基酸处(图1A)。

A.多房棘球绦虫EmEWS基因的定位; B.吸虫和绦虫EWS基因的系统发育树; C.不同物种中RBD比对分析; D.包含一个4面反向平行的β折叠(β1-4)和两个α螺旋(α1-2)的RBD 3D模型
系统进化分析显示,EmEWS的同源基因分为吸虫分支和绦虫分支。在绦虫分支中,细粒棘球蚴EWS与EmEWS基因的CDs相似性高达98.3%(图1B)。8个不同物种EWS蛋白的RBD结构域比对发现,EmEWS的RBD结构域在绦虫中高度保守,与小鼠的RBD结构域略有不同(图1C)。但在3D结构上,绦虫与哺乳动物的RBD结构域有相似的空间结构,均是由1个4面反向平行的β折叠和两个α螺旋构成[13](图1D)。
2.2 EmEWS重组质粒的构建、诱导表达及产物纯化
将RT-PCR特异性扩增出的1 485 bp的EmEWS片段(图2A)与pET-28a及Myc载体连接。双酶切和测序验证酶切片段与目的基因片段大小一致(图2B、2C),表明重组质粒构建成功。SDS-PAGE结果显示,重组蛋白主要以包涵体状态存在于裂解液的沉淀中,大小约54 ku,与预测一致(图3)。

A.EmEWS基因PCR扩增产物; B.pET-28a-EmEWS双酶切产物; C.Myc-EmEWS双酶切产物; M.DNA标准; 1.样品
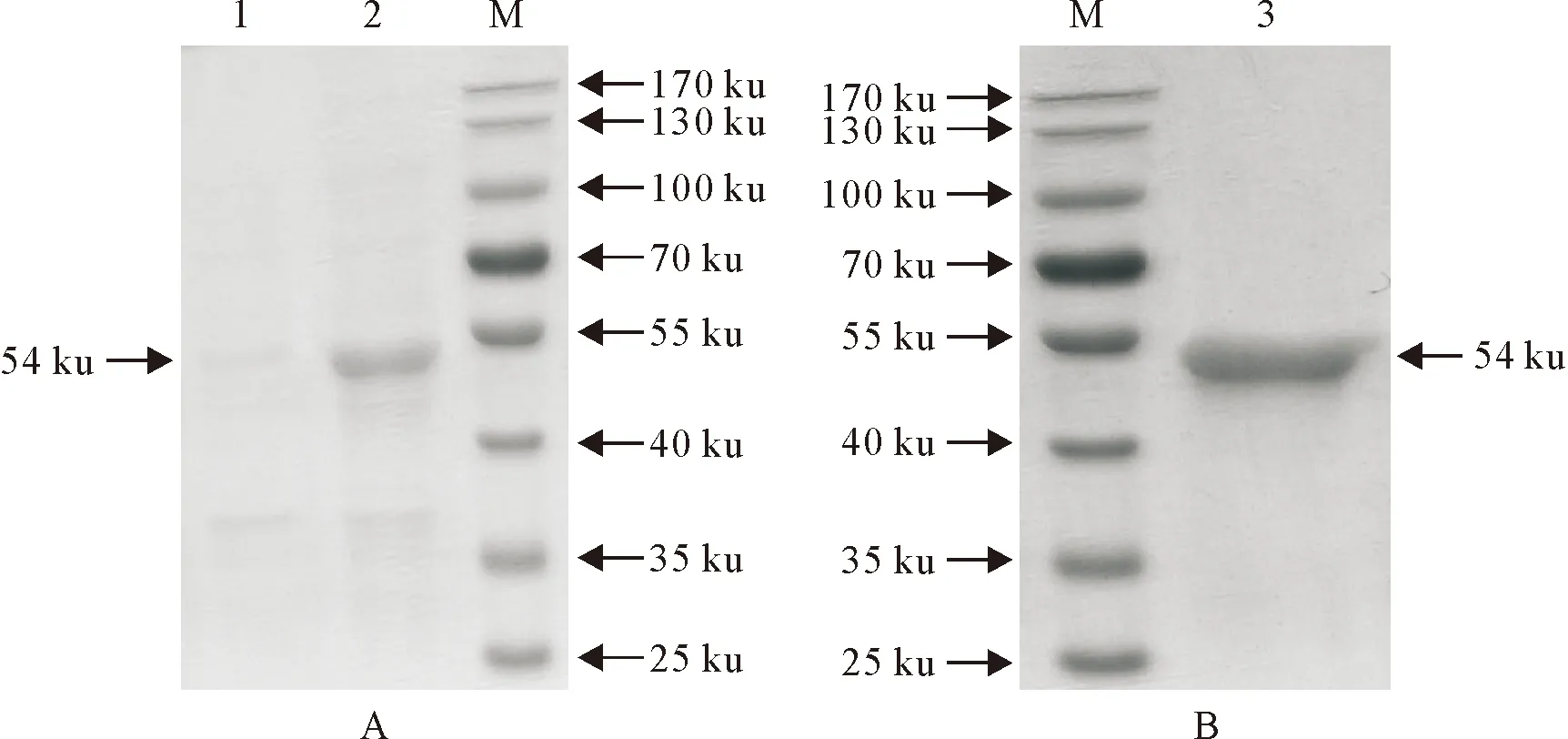
M.蛋白质分子质量标准; 1.经IPTG诱导的上清中的总蛋白; 2.经IPTG诱导的沉淀中总蛋白; 3.纯化后EmEWS重组蛋白
2.3 EmEWS重组蛋白的多克隆抗体制备及特异性检测
Western blot试验表明,制备的EmEWS多克隆抗体可识别多房棘球绦虫天然EmEWS,在54 ku处有特异的条带,与阴性血清不反应(图4)。

1.阳性血清; 2.阴性血清
2.4 EmEWS基因的表达及细胞定位
实时荧光定量PCR检测结果表明,EmEWS基因在多房棘球蚴原代细胞中表达最丰富,在原头蚴中表达量最低(图5)。免疫荧光试验表明,EmEWS主要分布在细胞膜上,少量在细胞核中(箭头所指)(图6)。

图5 实时荧光定量PCR分析EmEWS基因在多房棘球绦虫原代细胞、囊泡、原头蚴和未成熟成虫中的表达

DIC.明场; DAPI.细胞核荧光染色剂; Alexa Floor.荧光标记的二抗; Merge.合并
2.5 EmEWS的结合性
Lerga A等[14]先前证实EWS可与富含UG的RNA序列结合,为证明EmEWS与RNA的结合能力,将富含UG的RNA序列克隆进pGL3-Promoter载体中,并与MYC-EmEWS质粒共转染HEK293T细胞。若富含UG的RNA序列可与EmEWS结合,则可导致pGL3-Promoter载体所表达的荧光值降低。从试验结果中可看出中(图7),EmEWS可与富含UG的RNA序列结合。

图7 EmEWS的RNA结合性分析
3 讨论
RNA结合蛋白(RNA binding proteins,RBPs)在调节转录、翻译以及RNA形成的过程中起着连接作用,生物体内的调控过程往往需要多个RNA或多个蛋白共同协作,此时RBPs与RNA的结合能够使其在空间结构上进行弯曲折叠,最终形成1个“反应中心”,而RBPs的缺失会导致RNA无法形成空间结构,进而失去催化作用,裸露在外的RNA也更容易被生物体内的酶降解。EWS作为RBPs的一员,在基因表达调控中也有着十分重要的作用。目前,哺乳动物中EWS蛋白已得到初步研究,但多房棘球蚴中EWS蛋白有何作用还未见报道。
EWS蛋白属于TET家族,该家族在结构和功能上具有保守性。EWS蛋白包含几个保守区域:1个丝氨酸-络氨酸-甘氨酸-谷氨酰胺(SYGQ)域,1个锌指结构和1个富含精氨酸-甘氨酸-甘氨酸(RGG)序列的RBD,SYGQ域可作为转录激活因子与DNA结合域结合[15-16]。TET家族的RBD由90个氨基酸组成,在此区域内,氨基酸通过氢键和环堆积力与RNA连接[17]。除此之外,TET家族的RBD含有多种疏水性氨基酸,在RBD的第一个α螺旋后有一个长环结构[18],此结构有助于RBD的疏水核心与RNA的特异性结合。在本研究中,我们发现EWS的RBD在绦虫和小鼠中都高度保守,这也说明了EWS具有相似的RNA结合特性。有研究表明EWS可通过其羧基末端的RGG序列与富含UG的RNA序列结合[19],本研究中的RNA结合试验也表明EmEWS可与富含UG的RNA序列结合。因此,可推测EmEWS会作为转录调控因子,参与RNA的形成过程。
据相关研究表明,甲基化的精氨酸可促进核蛋白的输出,尤其是与RNA结合的核蛋白,并有助于核蛋白穿梭于细胞中,最终整合至细胞膜上,而在EWS中发现了大量不对称的甲基化的精氨酸残基[20],这些结果表明,甲基化的EWS可能在核蛋白的运输中发挥作用。实时荧光定量PCR检测结果证明,EmEWS基因在多房棘球蚴原代细胞中表达最丰富;免疫荧光试验发现, EmEWS位于细胞膜上和少数细胞核中,这均为其转运核蛋白提供了基础。众所周知,miRNA起源于pri-miRNA,pri-miRNA在细胞核中被Drosha/DGCR8剪切为pre-miRNA,再转运至细胞质中,经Dicer/TRBP加工成成熟的miRNA。有研究发现EWS存在于Drosha复合物中,该复合物会被招募至染色质中促进pri-miRNA的加工[21]。除此之外,若抑制Drosha的表达,EWS将会提高把Drosha招募至染色质的能力,从而影响miRNA的表达。在本研究中,EmEWS在细胞核中的定位也暗示着其可能参与miRNA的形成过程,但具体是作用于哪一个环节,会影响哪些miRNA的变化还有待进一步研究。

