不同注射剂量9型腺相关病毒载体在小鼠脑和脊髓表达效果分析
李鹏辉,刘昊东,李嘉成,樊 奇,王 星,李彩琴,杨子程,陈玉洁,海日汗,曹晓娟,张小宇,杜晨光,*
(1.内蒙古农业大学兽医学院,内蒙古呼和浩特 010018;2.内蒙古自治区基础兽医学重点实验室,内蒙古呼和浩特 010018;3.内蒙古农业大学职业技术学院,内蒙古包头 014109)
重组病毒是现代神经科学研究的主力军[1],而9型腺相关病毒(Adeno-associated viral vectors,AAV9)是最常用的载体病毒[2]。AAV9是一种小型、无致病性、无囊膜的20面体缺陷型病毒,编码4.7 kb,能感染多种细胞和组织[3]。为了使荧光抗体能准确、直观地描述小鼠神经元之间的突触联系[4],研究人员多采用AAV9靶向特定的细胞或组织,以便用于疾病机制及治疗的研究。但是令刚接触病毒工具的研究人员困扰的是,开展预实验来摸索该病毒的使用浓度与侵染范围需要花费大量时间与精力。
AAV9表现较高趋神经性[5],静脉递送AAV9也可转导病毒至中枢神经系统(central nervous system,CNS)[6],但实现载体扩散和转基因表达需要高剂量,这导致了潜在毒性免疫反应[2],这项研究打破了AAV载体安全的神话,提示了对AAV基因治疗的潜在遗传毒性需要进行长期监测。因此,为规避这一潜在风险,同时保证外源基因的高效和区域性表达,正式实验前注射适宜体积的AAV以及了解病毒表达周期必不可少。
根据AAV9侵染脑内神经元特性,驱动报告基因增强型绿色荧光蛋白(enhanced green fluorescent protein,EGFP)在小鼠大脑不同区域的表达[7],本研究选择囊泡型谷氨酸转运蛋白2(vesicular glutamate transporters,VGlut2)转基因小鼠的蓝斑核(locus coeruleus,LC)[8]作为注射位点。因为这是一个经过深入研究的大脑区域,它具备记忆形成和疼痛调节的作用[9-10],且LC参与睡眠/觉醒周期和进食过程[11-12],是丘脑VGlut2神经元输入的主要来源[13]。
VGlut2是中枢神经系统中丰富表达的兴奋性神经元[14],在谷氨酸受体的介导下调节多种生理功能。越来越多的研究开始关注VGlut2神经元环路与生理功能间的关系。其次,有研究报道,VGlut2神经元及谷氨酸分泌异常诱发多种神经退行性疾病[15]。基于谷氨酸能神经元对于中枢神经系统研究的广泛性和重要性。本研究评估了VGlut2小鼠脑内AAV9转导效率中至关重要的变量,即病毒注射量与侵染范围,结果证明低注射量(0.5 μL)可以使AAV在注射区域附近局限性表达,AAV9标记的LC谷氨酸能神经元向大脑和脊髓进行广泛的传出投射,并且表达3周的AAV9不会改变小鼠体重。研究结果可为AAV9相关的示踪试验提供部分研究基础。
1 材料与方法
1.1 材料
1.1.1 实验动物 VGlut2Cre/+雄性小鼠(stock #:016963,6W),购自杰克逊实验室。共33只小鼠,6只小鼠分为0.5 μL注射组和1 μL注射组,每组3只,用于比较不同注射量在脑内的侵染范围。3只小鼠用于观察3周后病毒表达区域。12只小鼠分为假手术(Sham)和病毒注射(AAV9-DIO-ChR2-EGFP)2组,每组6只,检测病毒注射后24 h内的体重变化。此外,12只分组相同的雄性小鼠(Sham vs AAV9-DIO-ChR2-EGFP,每组6只)用于统计病毒注射后2周内的体重数据。按照《内蒙古大学实验动物使用和护理指南》的道德标准进行实验室动物的护理和使用(批准号SYCK2014-002)。脑立体定位注射前2 h,移除小鼠水和食物。
1.1.2 主要试剂 AAV9-DIO-ChR2-EGFP病毒,武汉枢密脑科学技术有限公司产品;多聚甲醛、蔗糖,玛西格玛奥德里奇公司产品。
1.1.3 主要仪器设备 全自动脑立体定位仪(StereoDrive-DM),Neurostar公司产品;冰冻切片机(Mainz),Slee公司产品;蠕动泵,保定芯之恒流泵有限公司产品;共聚焦显微镜,日本尼康公司产品。
1.2 方法
1.2.1 脑立体定位注射 麻醉开始时用50 mL/L异氟醚,在整个手术过程中维持在10~25 mL/L。将麻醉后剃毛的小鼠固定于全自动脑立体定位仪,相应位置打孔后,利用微量注射器将不同浓度的AAV9-DIO-ChR2-EGFP(PT-1102)注射于LC两侧(from Lambda:AP:-5.4 mm,ML:±1.0,DV:-4 mm)[16]。为保证注射效果,采用压力注射法:以0.5 μL/min(LC左侧)、1 μL/min(LC右侧)注射10 min,停针10 min。Sham组仅注射PBS。无菌条件缝合伤口皮肤,术后注射40万单位青霉素抗菌,单独饲养。
1.2.2 免疫荧光 病毒注射3周后,蠕动泵心肺灌注生理盐水30 mL,然后转换为40 mg/mL多聚甲醛(pH 7.4)继续灌注30 mL后取全脑。40 mg/mL多聚甲醛4 ℃后固定6 h,为了防止脱水不彻底,脑组织先置于200 mg/mL蔗糖溶液中,沉底后换成300 mg/mL蔗糖溶液彻底脱水。冰冻切片机将目标区域切为若干张厚度30 μm脑片,0.01 mol/L PBS(pH 7.4)洗涤3次,自然风干。拍照使用Nikon C2 PLUS Confocal成像系统在其对应的488 nm(EGFP)波段下进行。
1.2.3 统计分析 利用GraphPad Prism 7统计学软件,采用双因素方差分析和Tukey’s多重比较,进行显著性统计分析。数据以平均值±标准误(Mean±SEM)表示。P<0.05时表示有统计学意义。
2 结果
2.1 病毒体积对AAV9在LC核团中转导范围的影响
AAV9-DIO-ChR2-EGFP是特异性激活神经元和示踪的常用病毒[17]。通过将不同体积的AAV9-DIO-ChR2-EGFP注射到LC两侧(左侧LC注射0.5 μL,对侧1 μL),术后21 d检测注射位点的报告基因的表达(图1A)。冠状面切片直观地体现了不同注射体积所造成的侵染面积差异,1 μL AAV9不仅侵染注射位点及临近核团,同时产生对侧侵染的趋势,而0.5 μL AAV9仅特异性表达于注射位点(图1B和图1C),满足靶向目标区域并转导外源基因的要求。矢状面切片结果显示,1 μL的注射量虽然表达了病毒载体所携带的EGFP荧光蛋白基因,但并不局限于LC,在脑桥中央灰质(dcentral gray of the pons,CGPn)区域及其周围,大面积的特异性荧光信号被发现(图1D)。以上荧光成像结果表明,0.5 μL的病毒用量更适宜靶向LC。因此,后续试验中均采取0.5 μL的注射体积。

A.LC注射模式图;B.LC两侧EGFP表达(冠状面);C.左侧LC中EGFP表达(矢状面);D.右侧LC中EGFP表达(矢状面);比例尺:100 μm
2.2 LCVGlut2神经元的传出投射
为确认LC神经元的潜在神经回路,评估其特定传出目标。将AAV9-DIO-ChR2-EGFP单侧立体定向注射到VGlut2Cre/+小鼠LC中,3周后检测LC神经元的投射区域(图2A)。免疫荧光结果显示,AAV9高效转导整个中枢神经系统,尤其在注射位点LC观察到大量EGFP阳性细胞标记的VGlut2神经元(图2B)。在初级运动皮质(primary motor cortex,M1)也发现了少量EGFP染色的神经元胞体(图2C)。EGFP标记的LC神经纤维集中在下丘脑(图2D),中缝苍白核(araphe pallidus nucleus,Rpa)和颈髓(cervical spinal cord,CSC)(图2E和图2F)。这种强大的神经支配,连同下丘脑具有的代谢调节能力和大脑皮层自主神经功能,支持LC为功能性投射部位中枢(图2G)。AAV9在LC中早期和持续性转基因表达的结果进一步展示其广泛而有效的中枢神经系统转导。
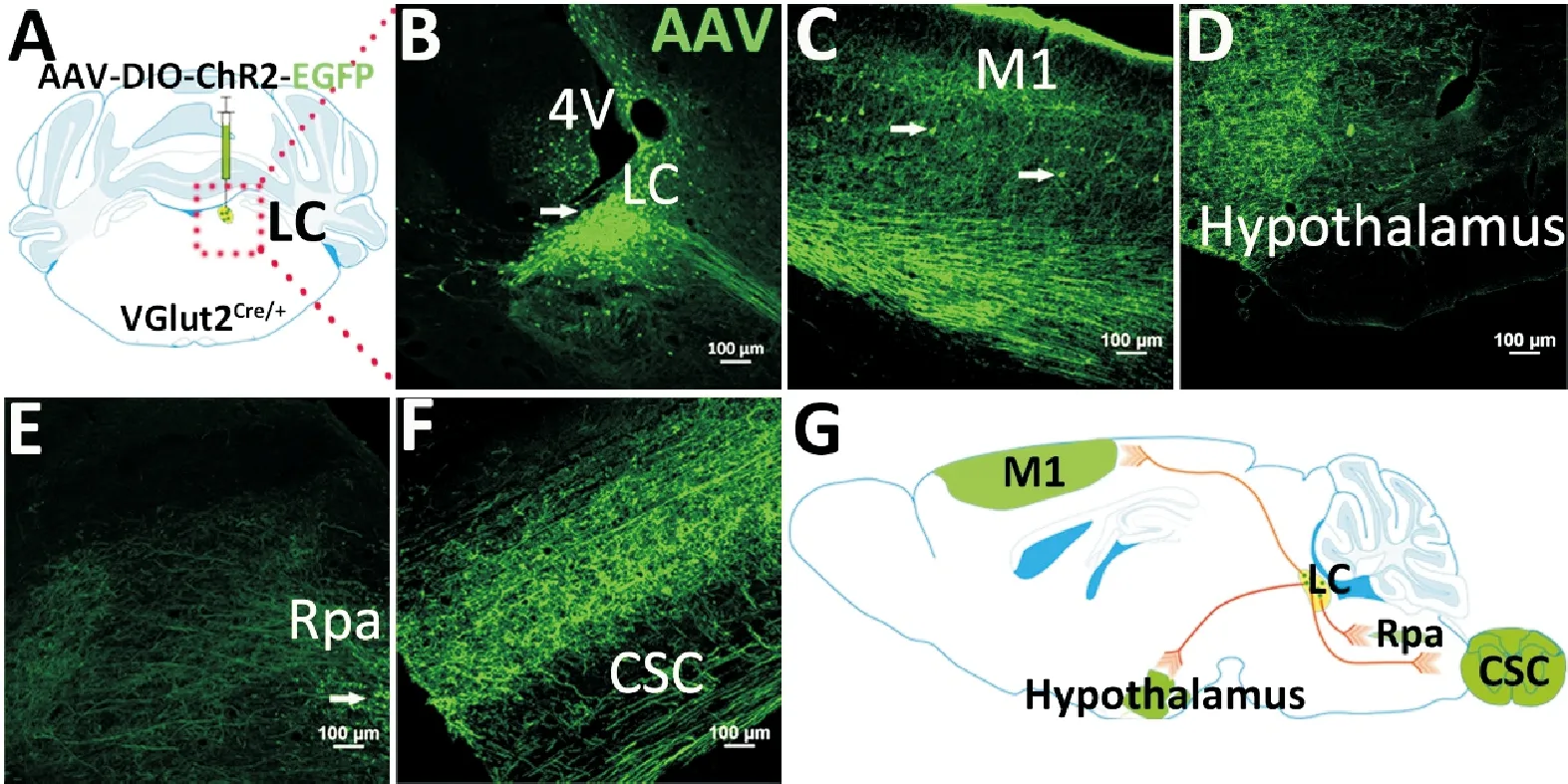
A.AAV顺行追踪的示意图(n=5);B.LC荧光表达状况;C.M1荧光表达状况;D.下丘脑荧光表达状况;E.Rpa荧光表达状况;F.脊髓荧光表达状况;G.LCVGlut2轴突投射示意图;比例尺:100 μm
2.3 脑内递送AAV9对小鼠体重的影响
尽管病毒载体工具的生产者一直在宣传AAV9的安全性与实用性,但是在0.5 μL的注射体积下是否对动物机体或细胞造成微小但不可忽略的损伤仍未可知。体重是机体稳态的综合指标,代表采食与能量代谢平衡。基于此,本研究观察了AAV9表达24 h和2周对小鼠体重的影响。
统计结果表明,在病毒注射后的任一时间点,AAV9都不会影响小鼠体重(12 h,P=0.979 5;17 h,P=0.990 2; 24 h,P=0.998 5,n=6,图3A)。此外,与Sham组相比,表达2周的AAV并不会引起VGlut2Cre/+小鼠的体重差异(n=6,图3B)。此外,在检测体重过程中,并未发现病毒注射组小鼠产生毒性高所导致的共济失调等现象。以上数据表明0.5 μL注射量的AAV9对小鼠模型具有较好的安全性。

A.表达24 h的AAV对sham组和AAV注射组小鼠体重的影响(12 h,P=0.979 5; 17 h,P=0.990 2; 24 h,P=0.998 5,n=6);B.表达2周的AAV对sham组和AAV注射组小鼠体重的影响(2 d,P=0.525;4天,P>0.999; 6,8,10,12,14 P>0.999,n=6)
3 讨论
在某个通路或某种疾病的研究中,通常会人为地将外源基因用病毒载体注入动物组织,检测其对其他基因和通路、组织器官、动物行为等的影响[18]。但这类动物试验的条件摸索和优化,是一个难点。基因治疗在遗传性疾病中最新的成功应用为当前批准的AAV[19]。尽管有关于不同AAV血清型表征的信息和研究,但关于AAV9使用方法的报道较少,阻碍了该科研利器的有效且更广泛的应用。因此本研究对常规型AAV9在小鼠脑神经元的应用效率和靶向性进行了评估。结果表明,在0.5 μL 注射体积下,AAV9表达2周后,可在目标核团中发现荧光基团的高表达,表明这一注射量可以限制病毒的扩散范围和确保病毒载体的高效表达。
AAV广泛转导神经系统的另一个作用是追踪神经元投射[20]。在确定最佳注射量后,为了解LCVGlut2通路的神经解剖结构,我们对LCVGlut2神经元进行了病毒介导的顺行追踪。将依赖Cre的AAV9-DIO-ChR2-EGFP单侧微量注射到VGlut2Cre/+小鼠的LC。3周后对EGFP纤维分布的研究表明,LCVGlut2神经元广泛分布于参与摄食、体温调节、神经内分泌功能和自主调节的不同脑区,包括但不限于M1、下丘脑、Rpa和CSC(图 2)。这表明该病毒可以快速、相对高效地标记神经元轴突投射。值得注意的是,AAV9在不同脑区中转导神经元细胞的表达水平存在差异。例如,AAV9在小鼠初级运动皮层神经元中高效地驱动EGFP表达。这可能是由于皮质中某些细胞类型上存在更高浓度的特异性细胞受体[21]。
通过评估EGFP投射纤维的分布,LCVGlut2神经元广泛支配大脑区域,并且AAV9在长达3周的时间内一直保持较高的表达水平[22]。但所有细胞都有一个内在防御系统,病毒可能导致有害毒性或免疫原性从而破坏该系统[23]。一般来说,AAV9已被证明比其他病毒具有更低的免疫原性,衣壳蛋白质以及所传递的核酸序列可以触发免疫系统的各种组成部分。但是,无论是局部给药还是全身给药,病毒都将被视为外来蛋白质,因此适应性免疫系统将试图消除它[24]。这些研究强调了明智地选择病毒载体及滴度,充分了解其潜在作用和注意事项。因此,本研究中确认小鼠模型中可应用于神经系统的AAV9注射量后,检测了该注射量对小鼠体重的影响,结果显示,脑内注射AAV9并不会影响小鼠体重(图3A和图3B),这与AAV9具有低毒性与高安全性的说法一致[25]。未来需要进一步开展对该新型载体进行更定量和深入的评估,以确认其是否具有相似或更好的性能。在这项研究中,我们分析了AAV9-DIO-ChR2-EGFP在小鼠大脑中的转导特性,以提供一个可供实验人员参考的详细数据,从而用于在小鼠中枢神经系统中进行基因传递的最佳载体。
综上所述,0.5 μL AAV9-DIO-ChR2-EGFP可以准确覆盖LC核团,满足注射位点特异性要求。LCVGlut2神经元投射至M1、下丘脑、Rpa和CSC。脑内注射低剂量AAV9-DIO-ChR2-EGFP(0.5 μL)不影响小鼠体重变化。

