黄花棘豆吲哚里西啶类生物碱成分研究
王亭亭,张雅昆,张洪艳,薛 站,霍晓敏,曾艳荣,严 敏,路 浩,谭承建*
(1.贵州民族大学化学工程学院,贵州贵阳 550025;2.贵州民族大学民族医药学院,贵州贵阳 550025;3.西北农林科技大学动物医学院,陕西杨凌 712100;4.贵州少数民族医药资源开发与利用国家民委重点实验室(贵州民族大学),贵州贵阳 550025)
黄花棘豆(OxytropisochrocephalaBunge)俗称“马绊肠、醉马草、团巴草、疯草”,为豆科棘豆属多年生草本有毒植物,是我国特有植物,广泛分布在西藏、新疆、青海、甘肃、四川及宁夏等省区的天然草原,尤其是在过度利用的退化草地形成种群优势[1]。每年冬季或春季草原可食牧草缺乏时,马、牛、羊等放牧牲畜常因饥饿采食黄花棘豆导致中毒[2],出现精神沉郁、眼神呆滞、头部震颤、步态蹒跚、站立不稳等症状,重者后肢瘫痪,卧地不起,终因衰竭死亡,怀孕母畜出现流产、难产或怪胎,严重威胁草地畜牧业可持续发展和草原生态安全[3]。
1989年,曹光荣等从黄花棘豆中分离得到苦马豆素(swainsonine),并通过动物饲喂试验证实其是引起草原放牧牲畜中毒的主要化学成分[4]。引起动物中毒的致病机理是苦马豆素能竞争性抑制体内α-甘露糖苷酶(α-mannosidase)的活性,一方面导致溶酶体内α-甘露糖苷酶活性下降,使细胞内N-聚糖不能正常降解;另一方面导致高尔基体内α-甘露糖苷酶活性下降,影响糖蛋白的合成、加工和翻译后修饰[5]。最终导致细胞内聚糖蓄积和糖蛋白糖基化修饰障碍,表现为中枢神经系统神经元细胞质,以及肝、肾等实质器官组织细胞广泛空泡化[6-7]。
Mitsue H C等[8]从旋花科番薯属树牵牛(Ipomoeacarnea)中分离得到吲哚里西啶生物碱苦马豆素及其类似物,并证明在树牵牛毒性作用方面发挥协同效应。赵宝玉等[9]通过薄层层析分析表明,甘肃棘豆(Oxytropiskansuensis)含有苦马豆素及其类似物,但由于受当时分离手段的限制,仅从甘肃棘豆中分离出苦马豆素单体,未分离出其他类似物单体。黄花棘豆和甘肃棘豆为同属不同种的有毒植物,虽然种类不同,但放牧动物采食后的临床中毒表现和组织病理学变化却十分相似。那么黄花棘豆是否也含有苦马豆素及其类似物,特别是对α-甘露糖苷酶活性有无抑制作用,目前还缺乏系统的研究。因此,本试验通过对黄花棘豆吲哚里西啶类生物碱成分的系统分离鉴定及其α-甘露糖苷酶活性研究,拟评价单体化合物对α-甘露糖苷酶的抑制活性,以期为深入解析和再认识草原毒草黄花棘豆的毒性成分及其毒性效应提供理论依据,同时对提升天然草原黄花棘豆作为药源植物资源化利用附加值具有重要意义。
1 材料与方法
1.1 材料
1.1.1 植物样品 黄花棘豆地上部分植物样品,2017年8月采自青海省湟中县,植物种属由青海大学莫重辉教授鉴定为黄花棘豆(OxytropisochrocephalaBunge),凭证标本(ZhaoBY-201708),保存于西北农林科技大学动物医学院有毒植物研究所。
1.1.2 仪器与试剂 AvanceNEO400型核磁共振波谱仪,德国BruKer公司产品;Agilent G6230飞行时间质谱仪、Applied Photophysics数字式圆二色谱仪,Agilent公司产品;Jasco P-1020全自动数字旋光仪,Jasco公司产品;Nicolet iS10 Thermo中红外光谱仪,赛默飞世尔科技有限公司产品;UV-2700紫外分光光度计,日本岛津公司产品;旋转蒸发仪(BUCHI Rotavapor R-3),瑞士步琦有限公司产品;循环水式真空泵,巩义市予华仪器有限公司产品;ZF-6 型三用紫外分析仪,上海嘉鹏科技有限公司产品;GF254薄层板、柱色谱硅胶(100~200、200~300、300~400目),青岛海洋化工厂分厂产品;SephadexLH-20,Amersham Biosciences公司产品;30%双氧水,江苏强盛功能化学有限公司产品;甲醇、二氯甲烷(分析纯试剂),成都科隆化学品有限公司产品;浓盐酸、氨水、醋酐,川东化工有限公司产品;无水乙醇,安徽泽升科技有限公司产品;氢氧化钠,成都金山化学试剂有限公司产品;α-甘露糖苷酶ELISA试剂盒,α-甘露糖苷酶,四甲基联苯胺(TMB),HRP,上海抚生生物有限公司产品;对二甲氨基苯甲醛,天津市科密欧化学试剂有限公司产品。
1.2 方法
1.2.1 生物碱提取分离 黄花棘豆全草50 kg,粉碎后用95%乙醇热回流提取,合并滤液,得粗浸膏5 kg。沸水捻溶后,用2 mol/L HCl调pH 1~3,等体积二氯甲烷萃取3次,酸水层用2 mol/L NaOH调pH 10~11,等体积二氯甲烷萃取,合并二氯甲烷层,减压浓缩,得总生物碱310 g。取210 g样品用硅胶柱层析(二氯甲烷∶甲醇=100∶1~纯甲醇,V/V)进行梯度洗脱,得到A1~A88个部分。A7(6.59 g)通过SephadexLH-20(二氯甲烷∶甲醇=1∶1,V/V)对组分进行分离,得到B1~B55个组分。B5(0.637 0 g)部分用甲醇和二氯甲烷反复重结晶,得化合物 3(300 mg)。B4(0.898 8 g)组分用硅胶柱色谱法进行分离(二氯甲烷∶甲醇=20∶1~10∶1,加1 mL/L氨水),得化合物2(24.2 mg)与化合物1(26.4 mg)。将C5组分用硅胶柱层析(二氯甲烷∶甲醇=10∶1~5∶1,加1 mL/L氨水),然后SephadexLH-20(甲醇)分离纯化得化合物4(3.2 mg)。
1.2.2α-甘露糖苷酶抑制活性测定 将α-甘露糖苷酶配制成7.5、15、30、60、120 IU/L的标准液,各取50 μL加入标准孔中反应1 h后加入终止液,15 min内测定OD值,作标准曲线为:y=68.833 7x+0.774 4,R2=0.998 4。将化合物1~4分别配制成0.49、0.80、1.10、1.40、1.70 μg/mL的待测液。先向待测样品孔中加入标准品稀释液40 μL,再加入10 μL的待测液,37 ℃反应30 min,洗板5次,加入酶标试剂(HRP)反应30 min,洗板5次,加入显色剂显色10 min,加入终止液,15 min内测定OD值。根据α-甘露糖苷酶的标准曲线得出反应后α-甘露糖苷酶的浓度,计算得出4种单体化合物IC50值,IC50值越小说明抑制糖苷酶活性越大。
2 结果
2.1 结构鉴定
(1)化合物1:油状物,易溶于甲醇。HR-ESI-MS 显示准分子离子峰为m/z142.1227[M+H]+,确定其分子式为C8H15NO (calcd 142.122 6),不饱和度为2。IR波谱显示羟基(3433.42 cm-1)吸收峰。13C NMR(表1)图和DEPT谱显示化合物1有8个碳信号,包括2个叔碳和6个仲碳。分析化合物1的1H和13C数据(表1),发现化合物1除了C-2 (δ(C)32.6)和C-3 (δ(C)54.0)的化学位移分别向高场移动了37和9.5 ppm以外,化合物1的核磁共振数据与化合物2-epi-lentiginosine非常相似[10],并且化合物1的相对分子质量较2-epi-lentiginosine减少了16,推测化合物1相比于2-epi-lentiginosine,在C-2位上少了一个羟基。
通过HSQC相关,看到H2-2(δ(H)1.56和2.20)与C-2(δ(C)32.6)相关信号,说明C-2上羟基消失。此外,1H-1H COSY谱中,可以看到H2-2与H-1和H2-3的相关信号(图1),进一步验证C-2上羟基消失。因此,表明化合物1是2-epi-lentiginosine的C-2位脱羟基衍生物(图1)。在NOESY图谱中,H-3α(δ(H)2.38)与H-8a (δ(H)1.78)有相关信号,表明这两组基团都处于该分子的同一面,暂定为α构型;H-3β(δ(H)2.96)与H-2 (δ(H)2.20)、H-1 (δ(H)3.84)有相关信号,则H-2 (δ(H)2.20)、H-1 (δ(H)3.84)为β构型,则C-1位的羟基为α构型。综上所述,化合物1((1R,8aS)-l-hydroxy-indolizidines)的结构如图1所示。
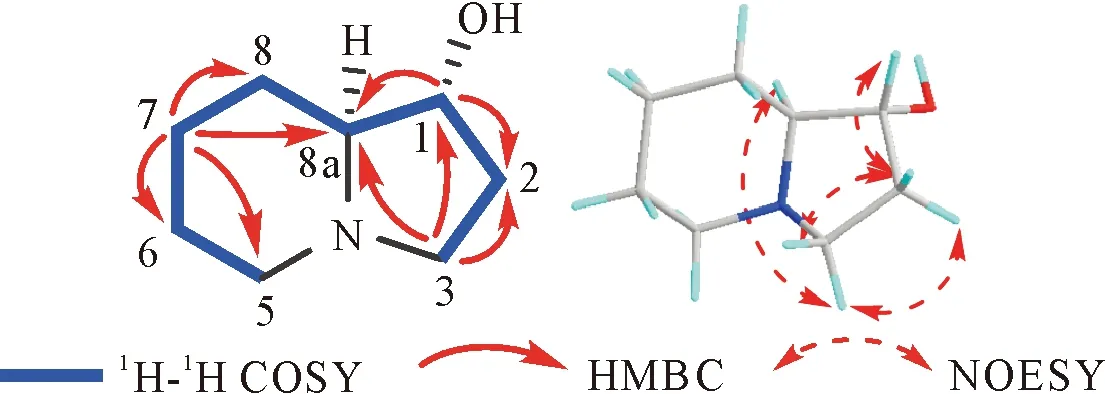
图1 化合物1的化学结构及主要1H-1H COSY、HMBC和NOESY相关信号
(2)化合物2:油状物,易溶于甲醇。HR-ESI-MS 显示准分子离子峰为m/z156.103 2[M-H]+,确定其分子式为 C8H15NO2(calcd 156.103 0),不饱和度为2。IR波谱显示羟基(3 397 cm-1)吸收峰。13C NMR(表1)图谱中显示化合物2有8个碳信号,DEPT图谱揭示了化合物2有3个叔碳和5个仲碳。化合物2的相对分子质量较swainsonine减少了16,核磁图谱上C-8a (δ(C)69.8)和C-8 (δ(C)30.2)的化学位移值比swainsonine分别向高场移动了5.3 ppm和36.7 ppm,剩余的碳谱数据与swainsonine基本一致[14]。综合上述,化合物2应该为吲哚里西啶类生物碱-swainsonine衍生物。
通过HSQC相关,看到H2-8 (δ(H)1.25和2.02)与C-8 (δ(C)30.2)相关信号,说明C-8上羟基消失。此外,1H-1H COSY谱中,可以看到H2-8与H-8a和H2-7的相关信号(图2),进一步验证C-8上羟基消失。因此,表明化合物2是swainsonine的C-8位脱羟基衍生物(图2)。HMBC图谱中,可以观察到H-3 (δ(H)2.22)与C-8a、C-1和C-2有相关信号,H-1 (δ(H)3.57)与C-8a、C-2有相关信号,H-2 (δ(H)2.13)与C-3有相关信号,δ(C)76.3和δ(C)69.6分别为C-1和C-2位的羟基取代碳信号。NOESY图谱中,H-3α(δ(H)3.45)与H-8a (δ(H)4.14)有相关信号,暂定H-8a (δ(H)4.14)为α构型;H-3β(δ(H)2.22)与H-2 (δ(H)2.13)和H-1 (δ(H)3.57)有相关信号,则H-2 (δ(H)2.13)和H-1 (δ(H)3.57) 为β构型,意味着C-1、C-2位上的羟基取代为α构型。综上所述,化合物2(2-epi-lentiginosine)的结构如图2所示。

图2 化合物 2 的化学结构及主要 1H-1H COSY、HMBC和NOESY相关信号
(3)化合物3:为白色针状晶体,易溶于甲醇,微溶于二氯甲烷。双氧水,100 mL/L醋酐无水乙醇,Ehrlich′s试剂显色后为紫色,ESI-MS显示准分子离子峰为m/z174[M+H]+。1H-NMR (400 MHz,CD3OD)δ(H):4.26 (1H,dd,J=4.5,1.9 Hz,H-1),4.22 (1H,t,J=8.4 Hz,H-2),3.82 (1H,d,J=9.5 Hz,H-3a),2.96 (1H,d,J=1.6 Hz,H-3b),2.92 (1H,d,J=1.8 Hz,H-5a),2.44 (1H,dd,J=10.5,6.9 Hz,H-5b),2.05 (1H,dd,J=12.6,4.1 Hz,H-6a),1.89 (1H,td,J=12.1,8.1,3.2 Hz,H-6b),1.74 (1H,dd,J=9.2,3.4 Hz,H-7a),1.68 (1H,m,H-7b),1.62 (1H,dt,J=12.6,8.0,4.1 Hz,H-8),1.22 (1H,dd,J=8.0,4.5 Hz,H-8a);13C-NMR (100 MHz,CD3OD)δ(C):75.1 (C-8a),70.7 (C-1),69.8 (C-2),66.9 (C-8),63.1 (C-3),53.1 (C-5),34.1 (C-7),24.5 (C-6)。上述数据与文献报道基本一致[11],故鉴定为swainsonine。
(4)化合物4:油状物,易溶于甲醇,不溶于二氯甲烷,ESI-MS 显示准分子离子峰为m/z190 [M+H]+。1H-NMR (400 MHz,CD3OD)δ(H):4.49 (ddd,J=8.7,6.6,2.3 Hz,H-2),4.42 (dd,J=6.7,3.2 Hz,H-1),3.98 (m,H-8),3.82 (dd,J=12.0,8.3 Hz,H-3α),3.52 (dd,J=9.8,2.4 Hz,H-3β),3.38 (m,H-5α),3.13 (td,J=12.7,3.3 Hz,H-5β),2.91 (dd,J=10.0,3.6 Hz,H-8a),2.1 (m,H-7α),2.02 (m,H-6β),1.77 (m,H-6α),1.34 (m,H-7β);13C-NMR (100 MHz,CD3OD,)δ(C):78.1 (C-8a),77.7 (C-3),71.9 (C-1),70.4 (C-2),63.9 (C-5),63.5 (C-8),32.5 (C-7),20.4 (C-6)。上述数据与文献数据一致[12],故鉴定为swainsonine N-oxide。4种化合物的结构图见图3。
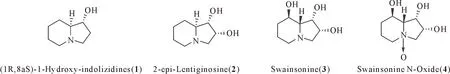
图3 化合物1~4的结构图
2.2 抑制α-甘露糖苷酶活性结果
测定结果显示,化合物1~4抑制α-甘露糖苷酶活性的IC50值分别为0.35、0.20、0.94、2.08 μmol/L,说明4个化合物均表现出较强的抑制α-甘露糖苷酶生物活性。在4个化合物中,苦马豆素去羟基衍生物表现出较强的抑制α-甘露糖苷酶的活性,其中二羟基衍生物2-epi-lentiginosine的抑制活性最强,然而氮氧化物的形成会降低其抑制活性。
3 讨论
本次试验从黄花棘豆中分离得到4个吲哚里西啶生物碱,分别为(1R,8aS)-l-hydroxy-indolizidines (1)、2-epi-lentiginosine (2)、swainsonine (3)、swainsonine N-oxide (4)。其中,(1R,8aS)-l-hydroxy-indolizidines (1)、2-epi-lentiginosine (2)和swainsonine N-oxide (4)是首次从黄花棘豆中分离得到。Thomas M H等[13-14]利用豆状丝核菌(Rhizoctonialeguminicola)对swainsonine的生物合成途径进行了研究,推测化合物1和2为swainsonine微生物合成过程中的中间体,尽管它们C-8a位的氢与swainsonine构型不同。本试验对黄花棘豆的化学成分进行研究,同样发现了这3个化合物的存在,进一步解释了化合物1和2可能是swainsonine植物生源合成途径中的前体化合物。
Kyoko I等[15]研究发现2-epi-lentiginosine (2)、swainsonine (3)具有较强抑制小鼠α-甘露糖苷酶的生物活性,其IC50值分别为4.6 μmol/L和0.02 μ mol/L。Dale R G等[16]发现swainsonine N-oxide (4)表现出与swainsonine相同的对溶酶体α-甘露糖苷酶的抑制活性。本次研究中,化合物2~4抑制α-甘露糖苷酶的IC50值分别为0.20、0.94 μmol/L和2.08 μmol/L。
苦马豆素(swainsonine)因具有对α-甘露糖苷酶的强抑制活性,一直以来,被认为是黄花棘豆的毒性成分[17]。以苦马豆素为代表的吲哚里西啶类生物碱,极性较大,显色特殊,分离难度较大。由于分离手段的限制,之前对于其衍生物的研究一直未曾深入。本次从黄花棘豆中得到3个苦马豆素类似物,均表现出较强的α-甘露糖苷酶的抑制活性。那么,上述类似物是否也表现出对采食动物的毒性作用?是否为其毒性成分的组成部分?是否有协同叠加后毒性增强的作用?这些问题还需进一步研究。本研究结果可为黄花棘豆毒性成分的认识提供一定依据。

