鸡肉加工及零售环节中分离的沙门氏菌血清型、毒力基因及耐药性检测
邱青璐,王 铄,张召兴,*,刘 冬,崔海明,张艳英
(1.河北旅游职业学院,河北承德 06700;2.沧州职业技术学院农牧工程系,河北沧州 061001;3.河北科技师范学院河北省预防兽医学重点实验室,河北秦皇岛 066604)
沙门氏菌(Salmonella)是常见的人兽共患病病原菌之一,该菌感染家禽、家畜等多种动物及人,具有广泛的宿主,临床中引起败血症、胃肠炎、腹泻、流产等的症状为多,其感染率和病死率均较高,对养殖业危害较大[1-2]。人通过食入被沙门氏菌污染的肉、蛋、蔬菜等食物引起食物中毒及食源性疾病,临床上以恶心、呕吐以及腹泻等症状为常见,严重者可以导致死亡,对人的危害较大,因此,对动物及食源性沙门氏菌防控具有重要的意义[3-5]。沙门氏菌具有2 500多个血清型,该菌抗原结构复杂,不同血清型的菌株之间无交叉保护性,在不同的地区、宿主及养殖场中流行不同的血清型[6]。相关研究表明,不同宿主源沙门氏菌携带多种毒力基因,如毒力岛、鞭毛、菌毛及肠毒素等,该菌的毒力基因的携带与表达参与该菌的致病性,其携带的毒力基因与致病性之间具有一定相关性[7]。随着临床中抗菌药物的滥用,致使沙门氏菌的耐药性严重且呈现多重耐药性,不仅给该病的治疗带来一定困难,该菌耐药性可以通过多种途径传播给人类,严重威胁着人类健康[8]。关于沙门氏菌通过环境在猪肉、鸡肉食品生产链中传播的报道越来越多,且对人的危害较严重[9]。因此,针对鸡肉食品加工、销售环节中沙门氏菌污染情况调查具有重要意义。本试验对2021-2022年采集自河北省承德地区鸡屠宰场、加工厂及零售样品257份样品进行沙门氏菌分离鉴定并研究其生物学特征,以便了解承德地区鸡肉加工及零售环节中沙门氏菌的流行规律,并为其防控提供参考依据。
1 材料与方法
1.1 材料
1.1.1 样品来源 本试验于2021-2022年采集河北省承德地区鸡屠宰场加工厂及零售样品257份,其中屠宰加工厂(胴体、刀具、容器、冲洗水等)95份,零售店铺及超市(案板、刀具、冰箱容器等)162份。
1.1.2 主要试剂 蛋白胨缓冲液、沙门氏菌显色鉴定培养基、SS培养基、增菌液(TTB),北京剑桥生物科技有限公司产品;API20E试剂盒,北京华福恒远生物科技有限公司产品;抗菌药物药敏纸片,北京天坛药物生物技术开发公司产品;沙门氏菌属血清诊断试剂盒,宁波天润生物药业有限公司产品;DNA标准DL 2 000,北京中科瑞泰生物科技有限公司产品;细菌基因组DNA试剂盒,上海联迈生物工程有限公司产品;2×TaqMaster Mix,北京康为世纪生物科技有限公司产品。
1.1.3 主要仪器 MA-1630Q型PCR仪,济南泰医生物技术有限公司产品;ZF-208凝胶成像分析系统,广州沪瑞明仪器有限公司产品; SW-CJ型超净工作台,苏州唯天环境科技有限公司产品;303-00A型恒温培养箱,杭州菲跃仪器有限公司产品。
1.1.4 实验动物 4~6周龄昆明系小鼠(雄性)22~25 g,购自北京维通利华实验动物技术有限公司,饲养于本单位畜牧兽医学院实训牧场。
1.2 方法
1.2.1 细菌分离与鉴定 对采集的鸡肉加工及零售环节中样品进行用蛋白胨缓冲液冲洗后,无菌条件下接种于增菌液(1∶100)中,放置37 ℃振荡培养箱中(100 r/min)培养12~18 h,取增菌液中菌液无菌接种于SS培养基(边缘整齐、透明无色且中间带黑心的单个菌落)37 ℃恒温培养12~18 h后,挑取典型的单个菌落接种于沙门氏菌显色培养基(大小一致、圆形的、蓝紫色菌落)在37 ℃培养12~18 h条件进行鉴别培养,再挑取沙门氏菌显色培养基上典型的单个菌落接种于营养肉汤纯化培养后进行镜检和形态学观察。参照API20E试剂盒说明书,将分离菌株在无菌的条件接种于API20E试剂中,无菌的条件下37 ℃培养12~18 h进行生化鉴定和结果判读。
1.2.2 细菌PCR鉴定 参考文献[10]报道的沙门氏菌鉴定引物基因invA,引物invA基因序列(5′-ACAGTGCTCGTTTACGACCTGAAT-3′;5′-AGACGACTGGTACTGATCGATAAT-3′)基因片段大小为241 bp,引物由生工生物工程(上海)股份有限公司合成。参照说明书以提取临床分离菌株的基因组DNA为模板,以鼠伤寒沙门氏菌(CMCC 50333)作为阳性对照,用沙门氏菌鉴定引物invA进行PCR鉴定。将PCR检测阳性菌株的产物经过回收后,送生工生物工程(上海)股份有限公司测序,测序结果与GenBank中登录的沙门氏菌参考株进行同源性比,参照同源性≥97%进行细菌种属鉴定。
1.2.3 致病性试验 参考文献[11]报道的方法,将分离菌株培养至对数生长期并用细菌平板计数法进行菌落计数,调整分离菌株浓度为108CFU/mL,每株分离菌株灌服5只昆明系小鼠为攻毒组,剂量为0.20 mL/只,对照组5只昆明系小鼠给予等量的无菌生理盐水。致病性试验期为6 d并观察小鼠发病情况。
1.2.4 血清型鉴定 参照沙门氏菌属血清鉴定试剂盒说明书,采用Kauffmann-White法对分离的沙门氏菌进行血清型鉴定。
1.2.5 毒力基因的检测 参考文献[12]报道沙门氏菌的毒力基因,其中质粒毒力基因(spvR、spvA、spvB、spvC、spvD)5种和毒力岛基因mogA(SPI-1)、sseL(SPI-2)、mgtC(SPI-3)、bcfA(SPI-4)、araB(SPI-5)5种的引物,引物由生工生物工程(上海)股份有限公司合成。以1.2.2提取的分离菌株DNA为模板,用PCR对毒力基因进行测定。
1.2.6 药敏试验 药敏试验参照美国临床实验室标准化协会(Clinical and laboratory standards iInstitute,CLSI)2013年推荐的标准K-B纸片法进行药敏试验和药敏结果判断,调整分离菌株的菌液浓度为0.5个麦氏浊度,大肠埃希氏菌(ATCC25922)标准菌株作为药敏质控菌株,用K-B药敏纸片法进行药敏试验[13]。根据药敏试验结果统计分离菌株对≥3种抗菌药物同时耐药,分析药物种类多重耐药性。
1.2.7 耐药基因的检测 参考文献[14-15]报道的沙门氏菌的耐药引物,其中β-内酰胺类耐药基因3种(tem、cmy、shv),磺胺类耐药基因3种(Sul1、Sul2、Sul3),氨基糖苷类耐药基因2种(aac(3)-Ⅰv、aac(6′)-Ⅰb),喹诺酮类耐药基因3种(gyrA、gyrB、qurS),四环素类3种(TetA、TetM、TetR),酰胺醇类耐药基因1种(floR),多肽类1种(mcr-1),共计7类抗菌药物16种耐药基因,引物由生工生物工程(上海)股份有限公司合成。以1.2.2提取的基因组DNA为模板,用 PCR进行耐药基因检测,并分析耐药表型与耐药基因之间的相关性。
2 结果
2.1 细菌分离鉴定
疑似沙门氏菌的菌株经SS培养基、沙门氏菌显色鉴别培养基分离培养、镜检观察其形态学及API20E试剂盒生化试验鉴定。结果显示, 92株分离菌株的培养特性、形态学及生化特性与《伯杰细菌鉴定手册》报道的基本一致。
2.2 细菌PCR鉴定结果
对分离培养、形态学观察及生化试验鉴定的92株疑似沙门氏菌的分离菌株,用沙门氏菌鉴定引物invA进行PCR鉴定,结果显示,92株疑似沙门氏菌的分离菌株均扩增出大约为241 bp目的基因条带(部分分离菌株PCR鉴定结果见图1),92株疑似沙门氏菌菌株经过测序并与GenBank中登录的沙门氏菌参考株同源性均在≥98.0%,分离菌株从分子生物学水平上92株分离菌株鉴定为沙门氏菌,分离菌株分布情况见表1。

表1 分离菌株分布情况
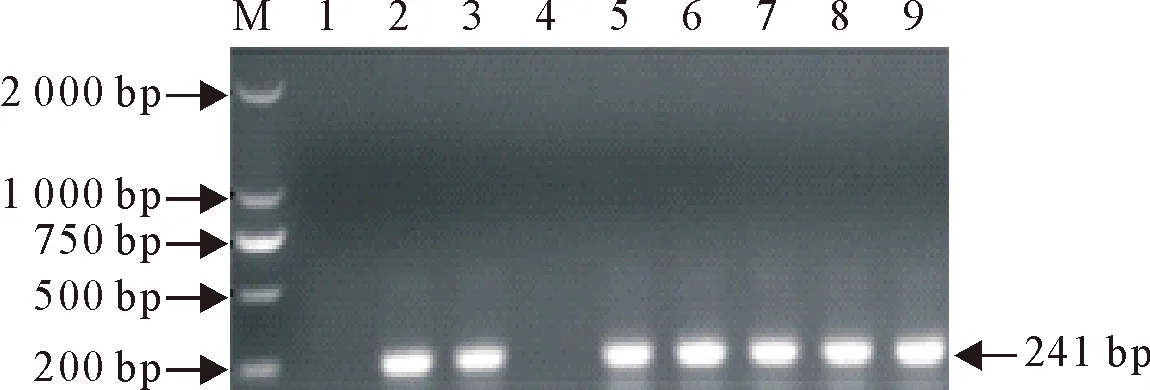
M. DNA标准DL 2 000;1.空白对照;2.标准菌株(阳性对照);3~9.分离菌株
2.3 致病性试验
攻毒组小鼠在攻毒后2~4 d出现了精神沉郁、采食量减少等临床症状,个别小鼠出现急性死亡。剖检可见,死亡的小鼠的肺、心、肝、脾、肾等实质性器官出现不同程度出血,尤其肠道出现出血、黏膜脱落等严重病变。从死亡的小鼠的肺、心、肝、脾、肾等组织分离得到沙门氏菌,试验结束(6 d)对照组小鼠健康存活。经统计70株沙门氏菌能引起小鼠发病和不同程度的死亡,其病死率在40%~100%之间(表2),为致病性沙门氏菌分离菌株。

表2 分离菌对小鼠致病性的试验结果
2.4 细菌血清型鉴定
采用Kauffmann-White法对从鸡肉加工及零售环节中分离的70株沙门氏菌进行血清型鉴定。结果见表3。由表3可知,从鸡肉加工及零售环节中分离的70株沙门氏菌中有12种血清型,其中以肠炎沙门氏菌、鼠伤寒沙门氏菌、都柏林沙门氏菌为承德地区鸡肉加工及零售环节中沙门氏菌流行优势血清型,分别占分离菌株的24.3%、21.4%和17.1%。

表3 70株沙门氏菌分离菌株的血清检测结果
2.5 毒力基因鉴定结果
采用PCR对从鸡肉加工及零售环节中分离的70株沙门氏菌进行质粒基因和毒力岛基因检测,结果见表4。由表4可知,分离的70株沙门氏菌携带4种毒力质粒基因(spvA、spvB、spvC、spvR),其检出率在12.9%~88.6%之间,携带4种毒力岛基因(SPI-1SPI-2、SPI-3、SPI-5),其检出率在27.0%~90.0%之间,其他的质粒上基因(spvD)和bcfA(SPI-4)毒力岛上基因均未在分离菌株中检测出。

表4 毒力基因检测结果
2.6 耐药性分析
对临床中分离的70株致病性沙门氏菌进行常用药物的耐药性分析,药敏试验结果显示(表5),分离的70株致病性沙门氏菌对阿莫西林、新霉素、氨苄西林、青霉素、庆大霉素、红霉素、链霉素、磺胺间甲氧嘧啶等8种药物的耐药率为51.4%~98.6%,对头孢噻呋、头孢噻肟、氟苯尼考、多西环素、土霉素、替米考星、恩诺沙星、环丙沙星、大观霉素、林可霉素、多黏菌素等10种药物耐药率为5.7%~40%;由表6可知分离的菌株至少耐4种药物,以耐10、9、8种药物的分离菌株最多,分别占分离菌株的15.%、20.0%和17.1%。说明临床中分离的70株致病性沙门氏菌对临床中常用的药物产生不同的耐药性,且呈现多重耐药性。
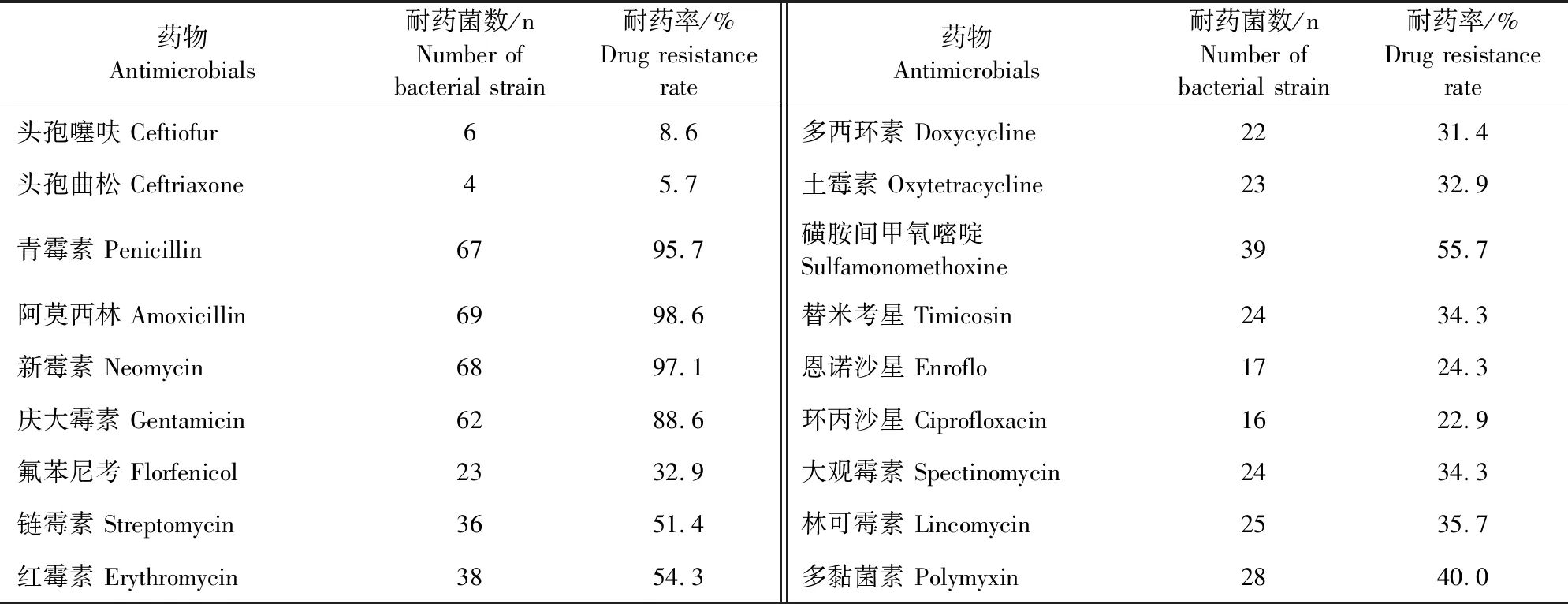
表5 耐药性检测结果

表6 药物种类多重耐药性检测结果
2.7 耐药基因检测结果
采用PCR对从鸡肉加工及零售环节中分离的70株致病性沙门氏菌进行耐药基因检测,结果见表7。由表7可知,70株致病性沙门氏菌的耐药基因Sul1、Sul2、Sul3、TetA、TetM、TetR、aac(3) -Ⅰv、aac(6′) -Ⅰb检出率在45.7%~97.1%之间;耐药基因tem、cmy、shv、gyrA、gyrB、qurS、floR、mcr-1检出率在8.6%~17.1%之间,从鸡肉加工及零售环节中分离的70株致病性沙门氏菌携带多种耐药基因。

表7 耐药基因检测结果
通过分析分离的70株致病性沙门氏菌的耐药表型与其耐药基因型之间相关性,结果见表8。由表8可知,β-内酰胺类、氨基糖苷类、喹诺酮类、四环素类、磺胺类5类药物的耐药表型与耐药基因型的符合率为95.2%~100%,酰胺醇类、多黏菌素类2类药物的耐药表型与耐药基因型符合率为21.4%~47.8%。表明分离的70株致病性沙门氏菌耐药表型与耐药基因(除酰胺醇类、多黏菌素类)之间基本呈正相关。

表8 分离菌耐药表型与耐药基因相关性的分析结果
3 讨论
沙门氏菌是临床中重要的食源性致病菌之一,据统计,人的食物中毒,30%~90%是由沙门氏菌引起的,人们通过食用被受沙门氏菌污染的肉、蛋、蔬菜等食物感染,感染后出现消化道症状,严重者可导致死亡,该菌严重威胁人们的健康[16]。鸡肉是我国居民肉类食品的重要来源之一,由于沙门氏菌广泛存在于环境中,通过环境(屠宰加工厂、零售等)在肉品生产链中进行传播,造成鸡肉的污染[9]。本试验从采集的257份病料样品中分离到92株沙门氏菌,其中70株对小鼠具有致病性,说明该地区鸡肉食品加工、销售环节中沙门氏菌污染严重,可能与鸡肉食品屠宰加工场和零售环节中卫生管理、操作及消毒方面等相关。因此,对鸡肉食品加工、销售环节中沙门氏菌进行检测具有重要意义。
沙门氏菌是具有多种致病性的血清型,且具有地区性差异,不同地区的沙门氏菌流行的血清型不同[6-7]。本试验研究表明,分离得到的70株沙门氏菌中有12种血清型,其中以肠炎沙门氏菌、鼠伤寒沙门氏菌、都柏林沙门氏菌为流行优势血清型,说明该地区鸡肉食品加工、销售环节中沙门氏菌呈现多样化流行。相关研究表明,鼠伤寒沙门氏菌和肠炎沙门氏菌是感染人沙门氏菌主要的血清类型[17]。本研究检测出鼠伤寒沙门氏菌,说明鸡肉食品源鼠伤寒沙门氏菌对公共卫生安全具有一定威胁,应该引起重视。
沙门氏菌基因组所编码的毒力基因存在于质粒和染色体中,其中毒力质粒作用于宿主的主要表现为肠道的黏附,引起肠道的损伤,毒力岛(SPI)基因主要参与入侵宿主细胞,对宿主细胞产生毒性,毒力基因在该菌致病过程中起着重要的作用[14-17]。许多研究表明,沙门氏菌的毒力与携带毒力基因呈正相关,其携带的毒力基因越高,潜在致病性越强。本试验研究表明,分离的70株沙门氏菌携带多种毒力基因(质粒毒力基因和毒力岛基因)。说明说明该地区鸡肉食品加工、销售环节中的沙门氏菌,可能存在潜在的致病性,其毒力基因的致病机理尚未明确,有待进一步研究。
临床中使用不同种类的抗菌药物是防治沙门氏菌病主要措施之一,随着养殖数量增多,抗菌药物在临床中不合理的使用,可导致其沙门氏菌耐药性增强,其耐药性菌株不断出现,耐药菌株可以通过多种途径使耐药性在不同菌株之间传播,给治疗带来一定的困难,同时耐药性沙门氏菌菌株在环境中存在给人们的食品安全带来巨大的威胁[18]。细菌的耐药性与携带的耐药基因相关,耐药基因是一种对抗菌药物有抵抗作用的蛋白质物质,耐药基因可以导致其耐药性的产生,同时,耐药基因可以在人类、动物及食品之间进行传播,严重危害人类健康[19-20]。本试验研究表明,分离的70株沙门氏菌对临床中常用的抗菌药物耐药性严重并呈现多重耐药性,同时携带多种耐药基因。经分析,分离的70株致病性沙门菌耐药表型与耐药基因(除酰胺醇类、多黏菌素类)之间基本呈正相关,其中β-内酰胺类、氨基糖苷类、喹诺酮类、四环素类、磺胺类5类药物的耐药表型与耐药基因型的符合率为95.2%~100%,可能与抗菌药物的不合理使用有关,促使沙门氏菌基因发生突变引起相关的耐药性,β-内酰胺类、氨基糖苷类、喹诺酮类、四环素类、磺胺类5类药物的耐药性与携带的耐药基因有关,酰胺醇类、多黏菌素类2类药物的耐药表型与耐药基因型符合率为21.4%~47.8%,可能还存在别的耐药机制。沙门氏菌携带耐药基因型是否是引起耐药药性主要因素,有待进一步研究。应该加强鸡肉食品加工、销售环节中的监督与管理,以减少沙门氏菌污染,保障鸡肉食品的公共卫生安全。

