miR-26a-3p靶向调控Survivin表达对H9c2心肌细胞缺氧/复氧损伤的影响
黄建成,李红英,刘 佳,李青泉,张会军,李小兵
近年,各种心脏病的发病率和病死率持续上升,已成为人类健康的头号杀手,如先天性心脏病和缺血性心脏病。及时恢复心脏供血是预防心脏病最有效的手段,但恢复供血后,心脏反而加重损伤的现象称为缺血再灌注(ischemia reperfusion,I/R)损伤[1]。炎症、自噬、细胞凋亡、钙超负荷、神经体液激活和氧化应激等被认为是I/R损伤的主要原因[2]。因此,深入探讨心肌I/R损伤,寻找新的战略或药物具有重要意义。微小RNA(microRNA,miRNA)参与心肌I/R损伤的病理生理学,其中,miR-26a与心肌细胞密切相关[3]。敲低miR-26a可显著降低I/R诱导的心肌细胞凋亡,改善大鼠心脏功能[4]。miR-26a-3p对急性胰腺炎胰腺细胞增殖和凋亡有调控作用[5],但关于心脏I/R损伤的作用未见报道。结合生物信息学软件的预测发现存活素(Survivin)可能是miR-26a-3p的靶基因。Survivin作为凋亡抑制蛋白,参与I/R诱导的心肌细胞凋亡[6]。该实验以大鼠心肌细胞(H9c2)为对象, 用缺氧/复氧(hypoxia/reoxygenation,H/R)模拟I/R损伤,探讨miR-26a-3p对心肌I/R损伤的影响和作用机制。
1 材料与方法
1.1 材料H9c2购自中国科学院典型培养物保藏委员会细胞库;Lipofectamine®2000转染试剂购自美国Invitrogen公司;TaqMan miRNA反转录试剂盒、TaqMan miRNA定量PCR试剂盒购自北京百奥莱博科技有限公司;PrimeScriptTMRT reagent Kit (Perfect Real Time)、TB Green® Fast qPCR Mix购自日本TAKARA公司;miR-26a-3p inhibitor及其阴性对照inhibitor NC、miR-26a-3p mimics及其阴性对照mimics NC、Survivin基因siRNA干扰质粒(si-Survivin)及其阴性对照si-NC均购自广州锐博生物科技有限公司;乳酸脱氢酶(lactate dehydrogenase,LDH)、超氧化物歧化酶(superoxide dismutase,SOD)活性、丙二醛(malondialdehyde,MDA)检测试剂盒购自上海酶联生物科技有限公司;细胞计数试剂盒(cell counting kit-8,CCK-8)购自美国MCE公司;Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)抗体、B细胞淋巴瘤-2(B-cell lymphoma-2,Bcl-2)抗体、活化型半胱天冬酶-3(cleaved caspase-3)抗体、Survivin抗体和GAPDH抗体购自英国Abcam公司;Annexin V-FITC/ PI荧光双染细胞凋亡检测试剂盒购自武汉普诺赛生命科技有限公司;Dual-Lumi双荧光素酶报告基因检测试剂盒购自武汉塞维尔生物科技有限公司。
1.2 方法
1.2.1细胞培养及心肌细胞H/R损伤模型建立 将复苏的H9c2细胞培养于高糖细胞培养基(含100 U/L青霉素、100 U/L链霉素、10%胎牛血清)中,置于37 ℃、5%CO2培养箱内培养,进行细胞传代。取对数生长期H9c2细胞常规培养至70%融合度后,放入37 ℃含94%N2、5%CO2和1%O2的培养箱内缺氧培养6 h,再放置在37 ℃含95%O2和5%CO2的培养箱进行复氧培养。
1.2.2细胞转染 将对数生长期H9c2细胞使用胰酶消化后接种于6孔板中(4×105个/孔),细胞密度达到80%时,根据Lipofectamin®2000转染试剂说明书将miR-26a-3p inhibitor及其阴性对照inhibitor NC、Survivin基因siRNA干扰质粒(si-Survivin)及其阴性对照si-NC共转染至H9c2细胞中,分为inhibitor NC组、inhibitor组、inhibitor+si-NC组和inhibitor+si-Survivin组,另设置空白对照组(blank组)。转染48 h后,qRT-PCR和Western blot检测验证细胞转染效率。
1.2.3分组处理 (1)取对数生长期H9c2细胞进行H/R干预,分组如下:常氧组:95%O2、5%CO2条件下培养;H6R2组:缺氧6 h复氧2 h;H6R4组:缺氧6 h复氧4 h;H6R8组:缺氧6 h复氧8 h;H6R12组:缺氧6 h复氧12 h。(2)经试验(1)确定最佳复氧时间后,将转染后的H9c2细胞进行H/R干预,分组如下:对照组(Control):未经转染的H9c2细胞在95%O2、5%CO2条件下培养;缺氧/复氧组(H/R):未经转染的H9c2细胞进行缺氧6 h复氧4 h;H/R+inhibitor NC组:转染miR-26a-3p inhibitors NC的H9c2细胞进行缺氧6 h复氧4 h;H/R+inhibitor组:转染miR-26a-3p inhibitor的H9c2细胞进行缺氧6 h复氧4 h;H/R+inhibitor+si-NC组:转染miR-26a-3p inhibitor和si-Survivin-NC的H9c2细胞进行缺氧6 h复氧4 h;H/R+inhibitor+si-Survivin组:转染miR-26a-3p inhibitor和si-Survivin的H9c2细胞进行缺氧6 h复氧4 h。
1.2.4CCK-8检测 在96孔板中接种100 μl/孔的细胞悬液(2×107个/L),另设空白组接种培养基溶液,每组3重复。分组处理后,每孔加入10 μl CCK-8溶液,置于37 ℃、5%CO2培养箱内孵育4 h;用酶标仪测定在450 nm处的吸光度值(OD)。细胞增殖活性以细胞存活率表示,细胞存活率(%)=(OD实验组-OD空白组)/(OD对照组-OD空白组)×100%。
1.2.5比色法检测 分组处理后,分别收集细胞上清液和细胞悬液(1×108个/L),按照试剂盒说明书检测各组细胞中SOD活性、MDA含量及上清液中LDH释放量。
1.2.6实时荧光定量PCR(real-time fluorescence quantitative PCR,qRT-PCR)检测 分组处理后收集细胞沉淀,分别加入TRIzol试剂提取总RNA,经分光光度计鉴定,总RNA浓度和纯度合格。qRT-PCR检测细胞中miR-26a-3p的表达:按照TaqMan miRNA反转录试剂盒说明书进行操作将总RNA逆转录成cDNA。取2 μg cDNA进行PCR扩增,扩增条件按照TaqMan miRNA定量PCR试剂盒说明书进行,反应条件:95 ℃ 10 min,95 ℃ 10 s,60 ℃ 30 s,72 ℃ 30 s,35个循环;qRT-PCR检测细胞中Survivin的表达:根据PrimeScriptTMRT reagent Kit (Perfect Real Time)说明书进行操作合成cDNA,按照TB Green®Fast qPCR Mix说明书以cDNA为模板进行PCR反应,反应条件:94 ℃ 30 s,94 ℃ 5 s,60 ℃ 30 s,40个循环。引物序列:miR-26a-3p引物F:5′-CTAGCG-CGATGCCGAACGTG-3′,R:5′-GCGTGAACGGCCGTGACG-3′;Survivin引物F:5′-GCATGGGTGCCCCG-ACG TTG-3′,R:5′-GCTCCGGCCAGAGGCTCAA-3′;U6引物F:5′-GAACGTGCCGGGCGTGCAG-3′,R:5′-GGTGAACGCCGTGGACGCC-3′;β-actin引物F:5′-AGCGAGCATCCCCCAAAGTT-3′,R:5′-GGGCAC-GAAGGCTCATCATT-3′。miR-26a-3p以U6为内参,Survivin以β-actin为内参,采用2-△△Ct法计算miR-26a-3p和Survivin mRNA 的相对表达量。
1.2.7Western blot检测 分组处理后收集细胞沉淀,进行蛋白提取并定量。聚丙烯酰胺凝胶电泳分离蛋白,转聚偏二氟乙烯膜,进行5%脱脂奶粉封闭1 h,加入一抗Survivin抗体(1 ∶1 000)、Bax抗体(1 ∶1 000)、Bcl-2抗体(1 ∶1 000)、cleaved caspase-3抗体(1 ∶1 000)和GAPDH抗体(1 ∶1 000),于4 ℃孵育过夜。加入以辣根酶标记的二抗(1 ∶10 000)室温振荡孵育1 h,使用混合发光液曝光显色,放入凝胶成像仪成像,采用Image J软件计算蛋白条带灰度值,以GAPDH为内参蛋白,计算目的蛋白的相对表达量=目的蛋白的灰度值/内参蛋白的灰度值。
1.2.8流式细胞术检测细胞凋亡率 使用不含乙二胺四乙酸的胰酶消化收集分组处理后的细胞,取5×105个重悬细胞,加入500 μl稀释的1×Annexin V Binding Buffer工作液重悬细胞,再依次加入 5 μl Annexin V-FITC和10 μl碘化丙啶染色液涡旋混匀,室温避光孵育20 min,上流式细胞仪检测。在散点图上,细胞凋亡率(%)=晚期凋亡及坏死的细胞百分率(Q2-2)+早期凋亡细胞百分率(Q2-4)。
1.2.9双荧光素酶报告基因实验 Survivin蛋白由BIRC5基因编码,查找BIRC5基因序列,利用Target Scan Human 7.1在线网站预测miR-26a-3p和Survivin的靶向结合位点。根据结合位点序列,设计合成野生型Survivin-3′-UTR(Survivin- WT)及突变型Survivin-3′-UTR(Survivin-MUT)片段序列,构建Survivin-WT和Survivin-MUT荧光素酶报告质粒。采用Lipofectamine 2000转染试剂将miR-26a-3p mimics、mimics NC、Survivin-WT质粒和Survivin-MUT质粒分别转染至对数生长期H9c2细胞中,共分为4组,每组设置3个复孔。转染48 h后,加入Cell Lysis Buffer重悬细胞,收集细胞裂解物,按照双荧光素酶报告检测试剂盒说明书进行操作,并使用酶标仪分别检测萤火虫和海肾荧光素酶报告基因活性,相对荧光素酶活性=萤火虫荧光素酶活性/海肾荧光素酶活性。
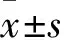
2 结果
2.1 H/R诱导对心肌细胞增殖活性的影响与常氧组比较,不同复氧时间组H9c2细胞增殖活性降低,差异有统计学意义(F=196.149,P<0.001),且随着复氧时间的增加,H9c2细胞增殖活性呈现先降低后增加的趋势。与常氧组比较,不同复氧时间组H9c2细胞上清液中LDH释放量升高,差异有统计学意义(F=870.111,P<0.001),随着复氧时间的增加,H9c2细胞上清液中LDH释放量呈现升高后降低的趋势,而H6R8与H6R12比较,细胞增殖活性[(72.67±3.06)%vs(69.00±2.65)%]和LDH释放量[(72.02±1.90)U/Lvs(74.47±3.31)U/L]差异无统计学意义(P>0.05)。选择缺氧6 h复氧4 h作为心肌细胞H/R损伤模型诱导条件。见图1。
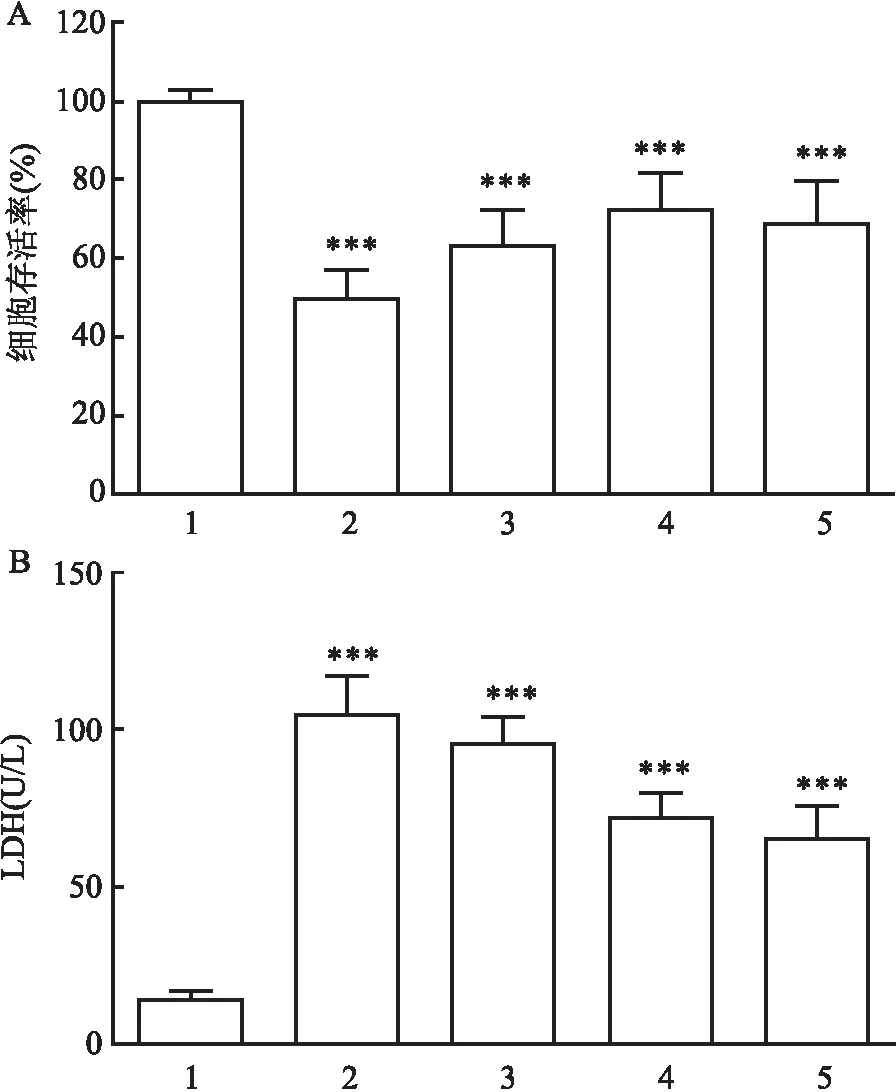
图1 不同时间复氧处理对H9c2心肌细胞的影响
2.2 H/R诱导的心肌细胞中miR-26a-3p和Survivin表达水平与常氧组比较,不同复氧时间组H9c2细胞Survivin mRNA和蛋白表达水平降低,而miR-26a-3p表达水平升高,差异有统计学意义(FSurvivin mRNA=71.481,FSurvivin蛋白=179.429,FmiR-26a-3p=15.691,均P<0.001)。此外,随着复氧时间的增加,Survivin mRNA和蛋白表达水平呈现先降低后升高的趋势,而miR-26a-3p表达水平呈现先升高后降低的趋势,而H6R8与H6R12比较,Survivin mRNA[(0.40±0.10)vs(0.38±0.06)]和蛋白表达水平[(0.36±0.06)vs(0.33±0.05)]及miR-26a-3p表达水平[(5.93±0.95)vs(6.08±1.02)]差异无统计学意义(P>0.05)。见图2。
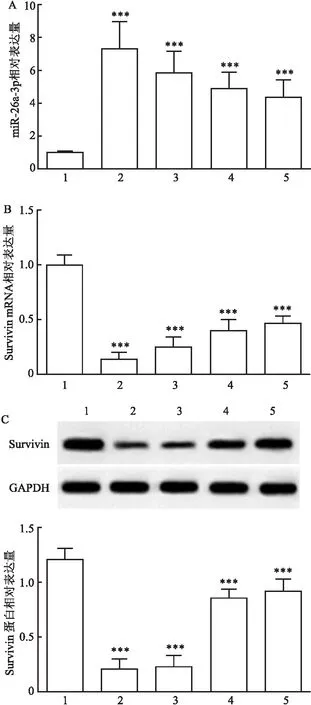
图2 不同时间复氧处理时H9c2心肌细胞中miR-26a-3p和Survivin表达水平
2.3 抑制miR-26a-3p表达对H/R干预下心肌细胞增殖活性的影响Western blot检测结果显示(图3A),各组Survivin 蛋白表达水平差异有统计学意义
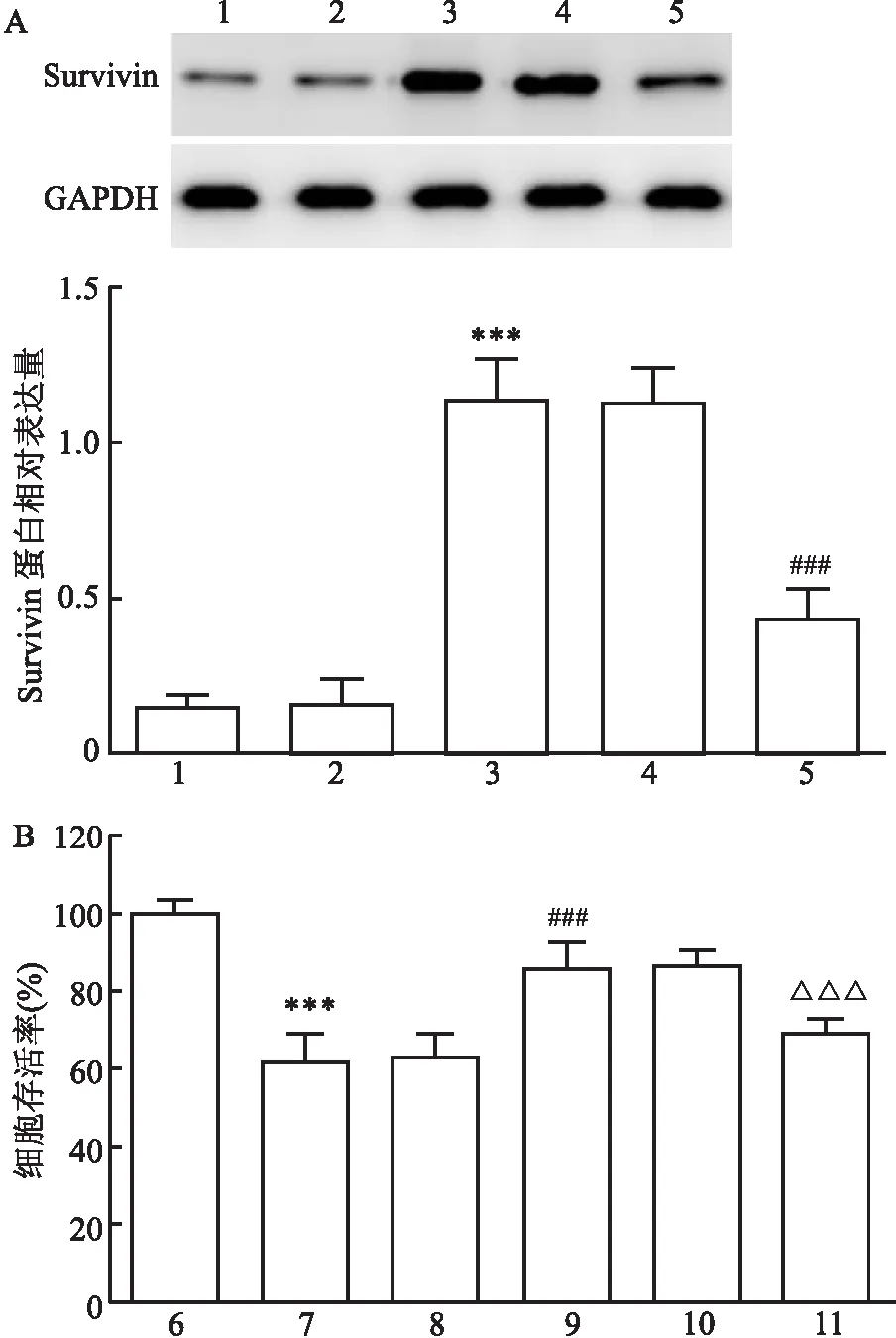
图3 抑制miR-26a-3p表达对H/R干预下H9c2心肌细胞中Survivin蛋白表达水平和增殖活性的影响
(F=81.775,P<0.001)。与blank组(0.15±0.04)或inhibitor: NC组(0.16±0.08)比较,inhibitor组细胞中Survivin 蛋白表达水平(1.14±0.13)升高,差异有统计学意义(P<0.001);与inhibitor组比较,inhibitor+si-Survivin组细胞中Survivin 蛋白表达水平(0.43±0.10)降低,差异有统计学意义(P<0.001),而inhibitor+si-NC组(0.13±0.11)差异无统计学意义(P>0.05)。CCK-8结果显示(图3B),各组H9c2细胞增殖活性差异有统计学意义(F=252.637,P<0.001)。与Control组[(100.00±0.00)%]比较,H/R组H9c2细胞增殖活性[(48.03±2.00)%]降低,差异有统计学意义(P<0.001);与H/R组比较,H/R+inhibitor组H9c2细胞增殖活性[(83.80±1.94)%]升高,差异有统计学意义(P<0.001),而H/R+inhibitor NC组[(48.22±1.80)%]差异无统计学意义(P>0.05);与H/R+inhibitor组比较,H/R+inhibitor+si-Survivin组H9c2细胞增殖活性[(69.31±3.51)%]降低,差异有统计学意义(P<0.001),而H/R+inhibitor+si-NC组[(85.51±2.97)%]差异无统计学意义(P>0.05)。
2.4 抑制miR-26a-3p表达对H/R干预下心肌细胞SOD、MDA及LDH水平的影响各组SOD、MDA和LDH水平差异有统计学意义(FSOD=16.184,FMDA=21.495,FLDH=573.514,P<0.001)。与Control组比较,H/R组H9c2细胞SOD活性降低,MDA含量和LDH释放量升高,差异有统计学意义(均P<0.001);与H/R组比较,H/R+inhibitor组H9c2细胞SOD活性升高,MDA含量和LDH释放量降低,差异有统计学意义(均P<0.001),而H/R+inhibitor NC组差异无统计学意义(P>0.05);与H/R+inhibitor组比较,H/R+inhibitor+si-Survivin组H9c2细胞SOD活性降低,MDA含量和LDH释放量升高,差异有统计学意义(P<0.05、P<0.01、P<0.001),而H/R+inhibitor+si-NC组差异无统计学意义(P>0.05)。见图4。
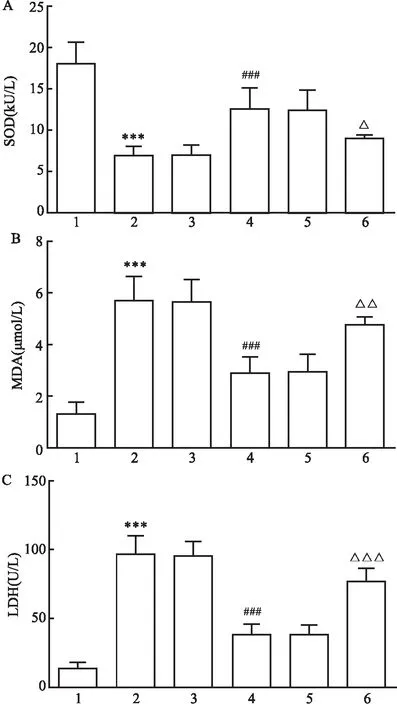
图4 抑制miR-26a-3p表达对H/R干预下H9c2心肌细胞SOD、MDA及LDH水平的影响
2.5 抑制miR-26a-3p表达对H/R干预下心肌细胞凋亡的影响各组细胞凋亡率及cleaved caspase-3、Bcl-2和Bax蛋白表达水平差异有统计学意义(F细胞凋亡率=968.422,Fcleaved caspase-3=52.139,FBcl-2=76.854,FBax=32.703,P<0.001)。与Control组比较,H/R组H9c2细胞凋亡率及Bax和cleaved caspase-3蛋白表达水平升高,而Bcl-2蛋白表达水平降低,差异有统计学意义(均P<0.001);与H/R组比较,H/R+inhibitor组H9c2细胞凋亡率及Bax和cleaved caspase-3蛋白表达水平降低,Bcl-2蛋白表达水平升高,差异有统计学意义(均P<0.001),而H/R+inhibitor NC组差异无统计学意义(P>0.05);与H/R+inhibitor组比较,H/R+inhibitor+si-Survivin组H9c2细胞凋亡率及Bax和cleaved caspase-3蛋白表达水平降低,Bcl-2蛋白表达水平升高,差异有统计学意义(均P<0.001),而H/R+inhibitor+si-NC组差异无统计学意义(P>0.05)。见图5。
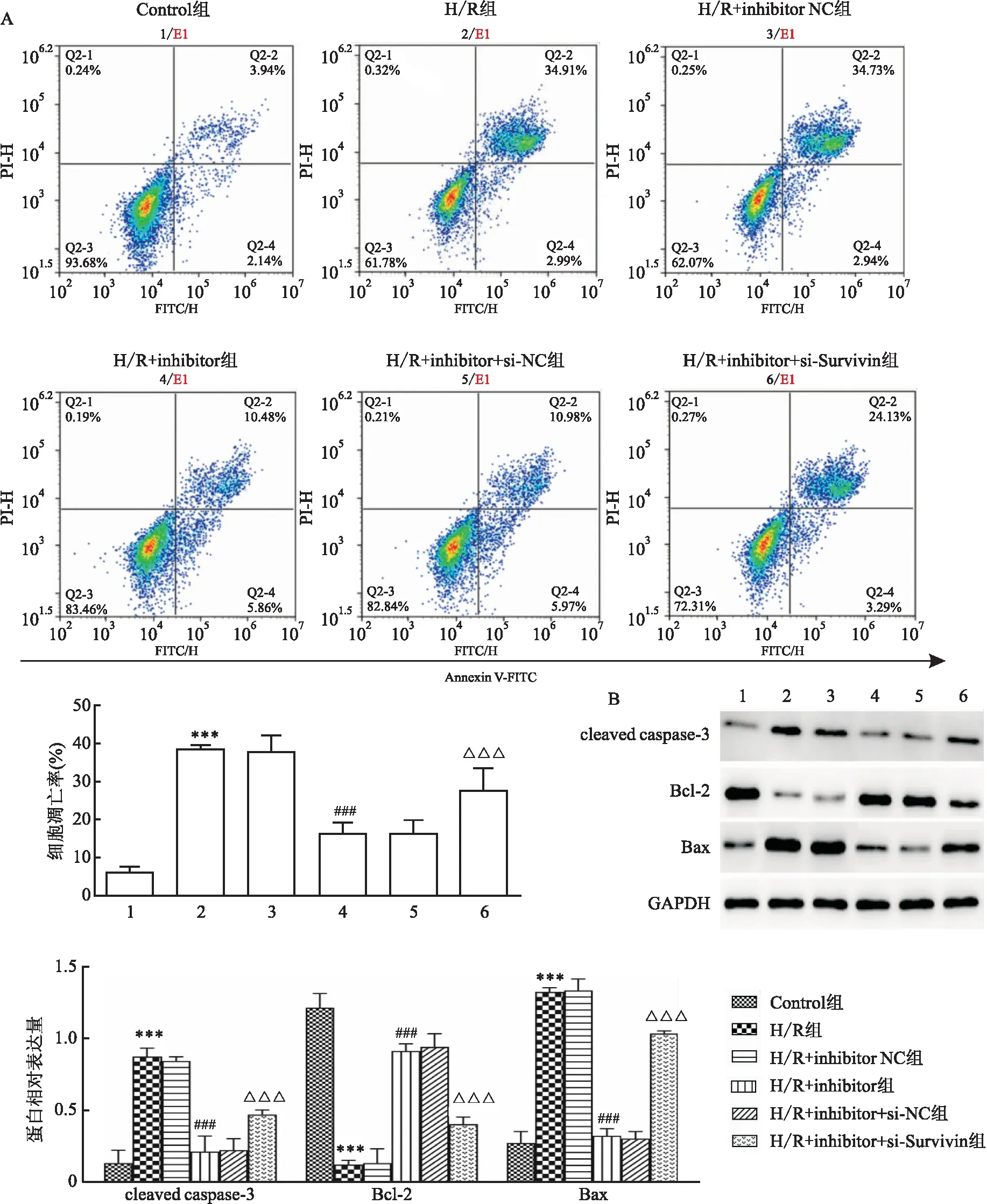
图5 抑制miR-26a-3p表达对H/R干预下H9c2心肌细胞凋亡的影响
2.6 miR-26a-3p与Survivin的靶向关系qRT-PCR结果(图6A)显示,与blank组或inhibitor NC组比较,inhibitor组细胞中miR-26a-3p表达水平降低,差异有统计学意义[(1.00±0.04)/(1.00±0.04)vs(6.54±1.03),F=85.809,P<0.001]。Western blot结果(图6B)显示,与blank组或inhibitor NC组比较,inhibitor组细胞中Survivin蛋白表达水平显著升高[(0.97±0.09)/(0.99±0.05)vs(3.87±0.53),F=86.894,P<0.001]。Target Scan 7.1在线网站显示(图6C),Survivin 3′-UTR区域存在与miR-26a-3p结合位点。双荧光素酶报告结果显示(图6D),转染miR-26a-3p mimics可降低Survivin-WT荧光素酶活性[(0.98±0.04)vs(0.26±0.06),F=339.234,P<0.001],但对Survivin-MUT荧光素酶活性差异无统计学意义[(1.00±0.00)vs(0.99±0.02),P>0.05]。结果提示miR-26a-3p可靶向调控Survivin表达。
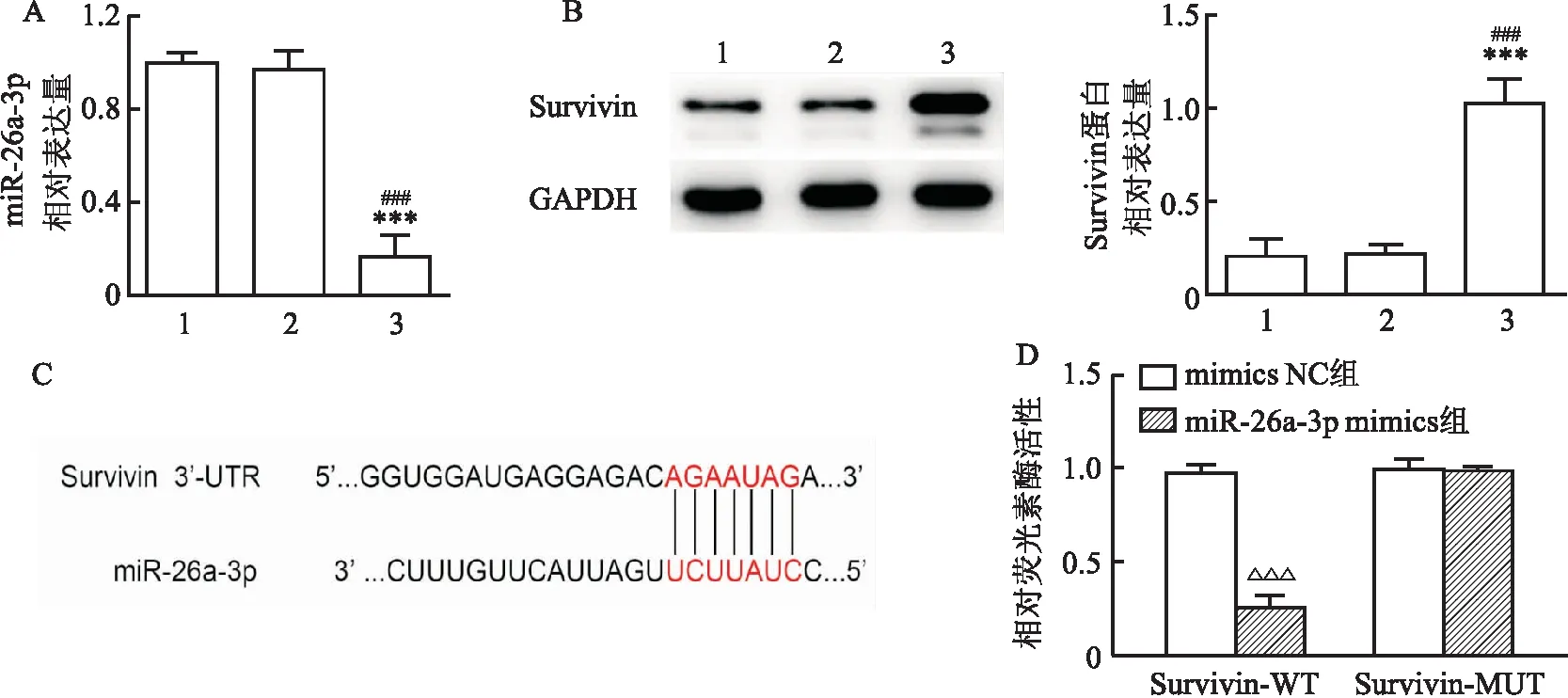
图6 miR-26a-3p靶向调控Survivin表达
3 讨论
心肌I/R损伤可造成心肌细胞坏死、凋亡,脂质过氧化物增加和自由基大量生成,而细胞凋亡是I/R损伤的重要发病机制[7]。该研究表明,经H/R干预的H9c2细胞大量释放LDH,细胞增殖活性降低,提示心肌细胞受损。随着复氧时间的延长,心肌细胞受损情况有所改善,但无法达到正常状态,说明I/R引起的损伤具有不可逆性。进一步研究表明,受损的心肌细胞中miR-26a-3p高表达,Survivin低表达。推测miR-26a-3p与Survivin可能参与心肌细胞损伤的作用机制。
多项研究[8-9]表明miRNA在I/R损伤中通过调控下游靶基因,影响心肌细胞凋亡,进而加重或减轻再灌注损伤。miR-26a-3p作为miRNA家族的一员,主要参与神经系统疾病,具有调节神经元凋亡和海马体炎症反应的作用[10-11]。但miR-26a-3p针对I/R损伤的研究鲜有报道。该研究表明,下调miR-26a-3p表达,可升高H/R干预下H9c2心肌细胞细胞增殖活性和SOD活性,降低MDA含量和LDH释放量。提示抑制miR-26a-3p表达可减轻氧化应激,提高细胞活力,改善受损心肌细胞。
Survivin是一种在进化上高度保守的真核蛋白,具有抗细胞凋亡、抑制过度自噬、促进迁移和血管生成等作用[12]。cleaved caspase-3作为caspase-3活化形式,是参与细胞凋亡的重要蛋白酶[13]。Bcl-2和Bax相互关联并相互制约,共同作用于下游caspase-3,调控细胞凋亡[14]。Survivin可减轻心肌I/R损伤,通过激活Survivin调控Bcl-2和Bax表达,达到抗凋亡的作用[15]。该研究表明,H/R组心肌细胞出现明显细胞凋亡;经miR-26a-3p inhibitor处理后,Survivin呈高表达,细胞内Bax和cleaved caspase-3蛋白水平降低,Bcl-2蛋白水平升高,细胞凋亡减轻。双荧光素酶报告基因实验结果显示,miR-26a-3p可靶向负调控Survivin。为了进一步验证miR-26a-3p与Survivin的关系,将H/R干预的心肌细胞经miR-26a-3p inhibitor和si-Survivin共同处理后,结果显示Survivin缺失可明显逆转miR-26a-3p inhibitor对心肌细胞损伤的改善。提示,miR-26a-3p可通过靶向负调控Survivin抑制心肌细胞凋亡。

