Toll样受体4在对乙酰氨基酚诱导的小鼠急性肝损伤早期中的作用
郑秀良,陈明月,乔亚琴,沈海涛,路 燕
对乙酰氨基酚(acetaminophen, APAP)作为一种解热镇痛类药物,自问世以来,已在全球范围内得到广泛应用,并因其易获取性,往往导致有意或者无意识的超剂量服用,导致肝脏损害,严重者可出现急性肝衰竭[1]。随着人们对APAP致肝脏损害的深入研究,人们对其致病机制了解的越来越透彻,包括线粒体的氧化应激、自噬、无菌性炎症等[2-4]。在无菌性炎症的肝损伤中,过量的APAP导致肝细胞广泛坏死,引起高迁移率族蛋白B1(high mobility group box-1, HMGB1)、组蛋白等内源性损伤相关分子模式(damage-associated molecular patterns, DAMPs)的释放,从而活化Toll样受体(Toll-like receptors, TLRs)并与其结合,激活下游的炎症信号通路,导致炎症介质释放引起肝脏损害[4]。Toll样受体4(Toll-like receptor 4, TLR4)是TLRs家族的一员,可识别包括病原相关分子模式(pathogen-associated molecular patterns, PAMPs)和DAMPs等在内的配体,并活化下游信号通路激活机体自身固有免疫[5]。HMGB1是介导TLR4活化的内源性危险信号分子[6]。TLR4被HMGB1活化后可经髓样分化因子88(myeloid differentiation factor 88, MyD88)依赖途径激活核因子-κB(nuclear factor kappa B, NF-κB),产生白细胞介素(interleukin,IL)-1β、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)和IL-6等炎症细胞因子,从而引起非酒精性脂肪肝、肝缺血-再灌注损伤等[7-8]。但TLR4在APAP致急性肝损伤中的作用研究甚少,因此,该研究拟通过腹腔注射APAP构建急性药物性肝损伤动物模型,并利用TLR4抑制剂瑞沙托维(resatorvid,TAK-242)初步揭示TLR4在APAP致小鼠急性肝损伤早期中的作用。为今后TLR4是否可以在药物性肝损伤中成为一个治疗靶点而提供理论基础。
1 材料与方法
1.1 材料
1.1.1实验动物 58只6~8周龄SPF级雄性ICR小鼠购自浙江维通利华实验动物技术有限公司[生产许可证编号:SCXK(浙) 2019-0001;使用许可证编号:SYXK(皖) 2017-006]。所有小鼠于实验前1周放置于温度22~26 ℃、湿度40%~60%的环境中光/暗交替各12 h,且可自由获取水和食物。
1.1.2主要药物与试剂 对乙酰氨基酚(APAP)、TAK-242购自上海MedChemExpress公司;DMSO购自北京索莱宝科技有限公司;ALT检测试剂盒购自南京建成生物工程研究所;TLR4抗体购自英国Abcam公司;NF-κB抗体购自美国proteintech公司;HMGB1、β-actin抗体购自美国CST公司;RT-qPCR逆转录试剂盒购自上海新贝生物科技有限公司;引物由上海生工生物工程股份有限公司合成;免疫组化试剂盒购自北京中杉金桥生物技术有限公司;IL-6 ELISA试剂盒购自武汉伊莱瑞特生物科技股份有限公司。
1.2 实验方法
1.2.1实验动物分组与处理 将58只雄性ICR小鼠随机划分为7组,其中对照组(正常对照组、溶剂对照组、抑制剂对照组)每组6只,实验组(APAP 4 h组、APAP+TAK-242 4 h组、APAP 12 h组、APAP+TAK-242 12 h组)每组10只。在禁食12 h后,将APAP(300 mg/kg)腹腔注入到实验组小鼠体内,TAK-242(3 mg/kg)于APAP注射前3 h进行腹腔注射,其中APAP溶液用生理盐水配制,TAK-242溶液用0.5% DMSO配制。正常对照组小鼠腹腔注射与APAP组等体积生理盐水,抑制剂对照组小鼠注射与APAP+TAK-242组小鼠等体积TAK-242溶液,溶剂对照组小鼠注射与抑制剂对照组等体积的溶剂。在APAP处理后不同时间点(0、4、12 h)剖杀小鼠。
1.2.2血清ALT水平的测定 通过血清ALT水平评价小鼠肝损伤情况,根据ALT检测试剂盒说明书进行血清ALT水平的测量。
1.2.3肝组织病理学检查 将肝脏组织用石蜡包埋后制成5 μm厚的切片,切片于脱蜡水化后用苏木精-伊红染液着色,梯度乙醇脱水,二甲苯透明,中性树胶封片,显微镜下观察,Image-Pro Plus软件对其图像进行组织病理学分析。
1.2.4蛋白质免疫印迹 肝脏组织蛋白用RIPA裂解液提取并采用BCA法检测其浓度,经SDS-PAGE分离及PVDF膜电转移。用5%脱脂牛奶封闭后用相应的一抗孵育,并置于4 ℃冰箱冷藏过夜。次日,用相对应的二抗常温孵育1 h,然后用化学发光显影仪曝光和拍照,利用Image J软件对图像进行分析。
1.2.5RT-qPCR 应用TRIzol试剂对肝组织进行RNA的分离,利用FlexCycler多功能PCR仪使其逆转录成cDNA。cDNA在LightCycle-480 PCR仪上进行扩增,扩增程序为95 ℃、30 s,95 ℃、10 s,60 ℃、30 s,循环45次。最后通过分析熔解曲线判断PCR扩增产物的特异性,2-ΔΔCt法分析目的基因相对比值。相关引物序列见表1。
1.2.6免疫组织化学染色 肝脏组织切片脱蜡水化后进行过氧化物酶的阻断及抗原修复。然后将其与稀释后的HMGB1抗体(1 ∶200)孵育过夜。次日,将切片与相对应的二抗进行孵育,DAB显色,苏木精染色15 s、PBS返蓝、梯度乙醇脱水、二甲苯透明及中性树胶封片,显微镜下观察并拍照,利用Image-Pro Plus软件对图像进行分析。
1.2.7酶联免疫吸附试验 ELISA法测定肝脏组织IL-6含量。样本含量的测量及计算遵循使用说明书进行。
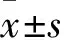
2 结果
2.1 溶剂和抑制剂对正常小鼠肝脏的影响溶剂对照组、抑制剂对照组及正常对照组的小鼠血清ALT水平、肝指数均未见明显差异(F=0.758、2.211,均P>0.05)。见表2。溶剂对照组和抑制剂对照组与正常对照组相比,HE染色均未见明显的肝脏组织病理学变化。见图1。
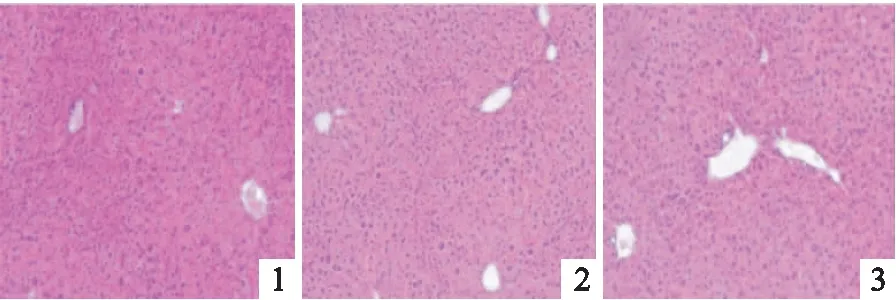
图1 溶剂和抑制剂对小鼠肝脏组织的影响 HE×100
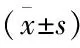
表2 溶剂和抑制剂对小鼠血清ALT、肝指数的影响
2.2 抑制TLR4对小鼠肝脏TLR4的影响与正常对照组相比,APAP 4 h组小鼠肝脏TLR4的表达量上调,差异有统计学意义(t=-2.319,P<0.05)。而APAP+TAK-242 4 h及12 h组小鼠肝脏的TLR4均较同时间点APAP组表达量下调,差异均有统计学意义(t=3.379、3.724,均P<0.01)。见图2。
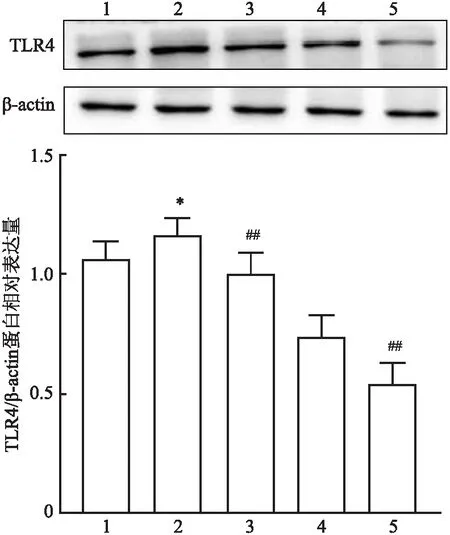
图2 抑制TLR4对小鼠肝脏TLR4的影响
2.3 抑制TLR4对APAP诱导的小鼠肝损伤的影响APAP 4 h和12 h组的小鼠血清ALT水平及肝指数与正常对照组相比均升高,差异均有统计学意义(F=27.674、24.387,均P<0.01);进一步分析显示APAP+TAK-242 4 h组与APAP 4 h组相比,其血清ALT水平和肝指数均降低,差异均有统计学意义(t=2.419、5.957,P<0.05,P<0.01)。HE染色显示正常对照组小鼠肝脏组织大小形态均正常,无明显的炎症及坏死。APAP 4 h组小鼠肝脏组织出现肿大充血,APAP 12 h组出现典型的小叶中心性坏死。APAP+TAK-242 4 h和12 h组均较同时间点APAP组肝脏组织坏死程度减轻。见表3、4和图3。
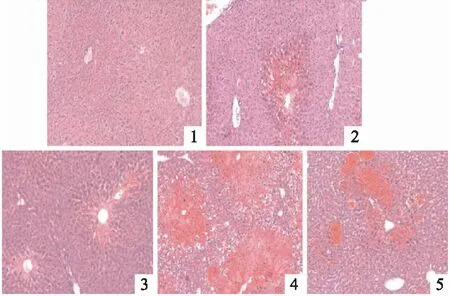
图3 抑制TLR4对APAP诱导的小鼠肝脏组织的影响 HE×100
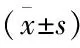
表3 APAP对小鼠血清ALT、肝指数和肝脏组织的影响
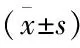
表4 抑制TLR4对APAP肝损伤小鼠血清ALT、肝指数和肝脏组织的影响
2.4 抑制TLR4对肝脏HMGB1和NF-κB蛋白表达的影响肝脏IHC结果显示APAP 4 h和12 h组的HMGB1蛋白含量均高于正常对照组,差异均有统计学意义(F=83.945,P<0.01);而APAP+TAK-242 4 h和12 h组的HMGB1的蛋白含量均较同时间点APAP组降低,差异均有统计学意义(t=3.561、5.022,均P<0.01)。见图4A、B。Western blot分析显示,APAP 4 h组HMGB1、NF-κB的蛋白含量高于正常对照组,两组间差异有统计学意义(t=-2.445、-2.994,均P<0.05);相较于APAP 4 h 组,APAP+TAK-242 4 h组的HMGB1、NF-κB的蛋白含量在肝脏中的表达均降低,差异均有统计学意义(t=3.113、4.506,均P<0.05);APAP+TAK-242 12 h组的HMGB1的蛋白含量较同时间点APAP组降低,差异有统计学意义(t=3.462,P<0.01)。见图4C-E。
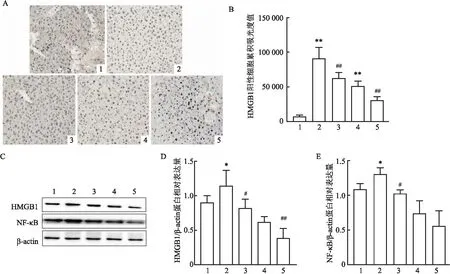
图4 抑制TLR4对肝脏HMGB1和NF-κB蛋白表达的影响
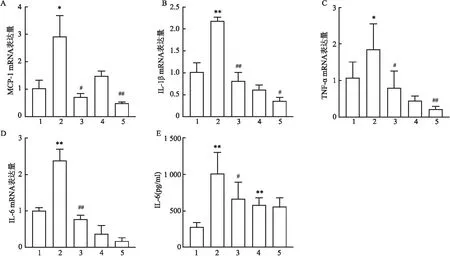
图5 抑制TLR4下调炎症因子MCP-1、IL-1β、TNF-α、IL-6在肝脏中的表达
2.5 抑制TLR4影响炎症因子MCP-1、IL-1β、TNF-α、IL-6在肝脏中的表达各组小鼠肝脏MCP-1、IL-1β、TNF-α 和IL-6基因水平用RT-qPCR检测,ELISA法检测各组小鼠肝组织IL-6含量。结果显示,与正常对照组相比,APAP 4 h组的肝脏MCP-1、IL-1β、TNF-α 和IL-6基因水平及肝组织IL-6的含量均升高,差异均有统计学意义(t=-3.935、-8.931、-2.300、-7.307、-6.026,P<0.05,P<0.01);见图5A-E。APAP 12 h组的肝组织IL-6含量升高,差异有统计学意义(t=-6.168,P<0.01)。见图5E。与APAP 4 h组相比,APAP+TAK-242 4 h组的MCP-1、IL-1β、TNF-α 和IL-6基因水平及组织IL-6的含量在肝脏中的表达均降低,差异均有统计学意义(t=4.855、11.196、3.071、8.364、2.277,P<0.05,P<0.01);见图5A-E。APAP+TAK-242 12 h组与APAP 12 h组相比,其MCP-1、IL-1β 和TNF-α 的基因水平在肝脏中的表达均降低,差异均有统计学意义(t=8.941、3.194、3.751,P<0.05,P<0.01)。见图5A-C。
3 讨论
药物性肝损伤是由药物本身或其代谢产物所致的肝脏损害。目前许多国内外学者对一些常引起肝损伤的药物做了大量研究,其中以APAP致肝脏损害的机制研究最为深入。目前研究[5,9]表明,服用过量的APAP可形成APAP蛋白加合物,引起氧化应激、MPTP开放,从而导致肝细胞坏死。坏死的肝细胞释放DAMPs,并与TLR4结合,从而活化下游的炎症信号通路,激活NF-κB,导致炎性细胞分泌TNF-α、IL-6等炎症介质加重肝损伤。
该研究通过腹腔注射APAP成功建立小鼠急性肝损伤模型,肝脏受损导致内源性配体DAMPs的释放,并与TLR4结合,激活下游的炎症信号通路,导致炎性介质的释放,从而引起急性肝损伤。研究表明ICR小鼠经腹腔注射APAP后其血清ALT水平、肝指数升高,肝组织病理学显示肝小叶中心性坏死。而抑制TLR4可在小鼠肝损伤早期降低血清ALT水平和肝指数,减轻肝组织病理损伤。
APAP诱导肝组织损伤后,坏死的肝细胞释放内源性配体DAMPs,DAMPs结合TLRs激活先天免疫系统,导致炎症因子释放,引起肝损伤[9]。有研究[10]表明抑制TLR4可通过对TLR4/NF-κB、TLR4/HMGB1等信号通路的抑制来降低炎症反应从而对肝脏具有保护作用;敲除TLR4则可通过对TLR4/MyD88/NF-κB信号通路的抑制,来减少炎症反应,达到减轻肝损伤的目的[11]。在该研究中,经TAK-242处理后的小鼠肝组织中的TLR4、HMGB1、NF-κB的蛋白含量均降低。这些结果表明TLR4的抑制可减轻APAP所致的急性肝损伤,其机制可能在于抑制了TLR4/HMGB1信号通路的活化。
部分研究[12-14]表明TLR4通路的激活可引起肌肉、骨关节、血管平滑肌等组织产生炎症细胞,引起IL-1β、TNF-α和IL-6等炎症因子的释放,从而对组织造成损伤;而抑制或敲除TLR4则能使组织减少上述炎症因子的释放,减轻损伤。在该研究中,APAP活化TLR4信号通路促进炎症因子(MCP-1、IL-1β、TNF-α 和IL-6)在肝组织中的分泌,而抑制TLR4则能下调上述炎症因子水平。以上结果表明肝脏损伤的减轻可能是通过抑制TLR4下游的炎症信号通路来下调炎症因子,降低肝脏炎症反应。
综上所述,该研究通过对ICR小鼠进行体内注射APAP溶液来构建急性药物性肝损伤模型并利用TLR4抑制剂(TAK-242)初步揭示TLR4在 APAP致小鼠急性肝损伤早期中的作用。结果显示,抑制TLR4能降低APAP致急性肝损伤早期小鼠的血清ALT活力和肝指数、减轻肝脏组织病理损伤改变。同时,抑制TLR4可以抑制肝脏TLR4/HMGB1通路的激活,使TLR4、HMGB1和NF-κB的蛋白含量降低,并下调炎症因子(MCP-1、IL-1β、TNF-α 和IL-6)在肝组织中的表达,从而减轻APAP诱导的急性肝损伤。本研究仅初步阐明抑制TLR4可能通过抑制TLR4下游的炎症信号通路对APAP致小鼠急性肝损伤早期阶段有一定的保护作用,但对其在整个肝损伤阶段是否具有持续减轻肝损伤的作用还尚未清楚,有待进一步探究。

