内吗啡肽2对神经病理性痛大鼠背根神经节内μ-阿片受体表达的影响
谢雨杉,刘海帆,孙 騊,万法萍
神经病理性痛(neuropathic pain,NP)是神经系统原发性损伤或功能障碍所引起的疼痛,阿片类药物对NP的治疗效果不理想[1]。研究[1]表明,背根神经节(dorsal root ganglion,DRG)中μ-阿片受体(μ-opioid receptor,MOR)表达下调是阿片类药物疗效不佳的主要原因之一。MOR属于G蛋白偶联受体,与配体结合后,发生受体内化和脱敏现象[1]。研究[2]表明,Rab7是胞内运输的关键调控因子,与疼痛状态下的MOR表达量降低有关。
内吗啡肽-2(endomorphin-2,EM2)是MOR的内源性激动剂,参与病理性痛的形成[3]和镇痛过程[4]。研究[5]表明,EM2可诱导MOR羧基末端第375位丝氨酸(Ser375)发生快速磷酸化,此过程在其复敏中发挥重要作用。糖尿病性痛大鼠脊髓中,EM2不仅增加了磷酸化MOR的表达量,还促进MOR的表达[3],提示在镇痛过程中,EM2可促进MOR的功能恢复。因此,该研究以NP模型为研究对象,初步探讨在EM2介导的镇痛过程中,大鼠DRG内MOR的表达变化及胞内囊泡转运对其表达的影响,以加深对内源性镇痛系统功能的理解。
1 材料与方法
1.1 实验动物及分组健康成年SD大鼠,雄性,初始体质量200~220 g,由徐州医科大学实验动物中心提供。大鼠随机分为正常对照组(Control组)、病理性痛组(SNI-NS组)和药物组(SNI-EM2组),每组10只。动物饲养和实验操作均符合徐州医科大学动物伦理委员会的要求和规定(伦理号:202208S027)。
1.2 主要仪器与试剂
1.2.1主要仪器 Von Frey纤维丝购自美国Stoelting公司,PE-10导管(i.d. 0.28 mm,o.d. 0.64 mm)购自美国Scientific Industries公司,荧光共聚焦显微镜(型号:STELLARIS 5)购自日本Olympus公司,微量进样针购自上海高鸽工贸有限公司。
1.2.2主要试剂 MOR抗体(货号:ab17394,ab10275)、Rab7抗体(货号:ab137029)购自美国Abcam公司,Ser375MOR抗体(货号:CSB-PA168551)购自武汉华美生物工程有限公司,actin抗体(货号:20536-1-AP)购自武汉三鹰生物技术有限公司,山羊抗兔IRDye 800CW二抗(货号:V926-32211)购自徐州微科曼得生物工程有限公司,溶酶体相关膜蛋白1(lysosome-associated membrane proteins 1,LAMP1)抗体(货号:bs-1970R)购自北京博奥森生物技术有限公司,Alexa488驴抗豚鼠IgG(货号:706-545-148)购自美国Jackson公司,Alexa594驴抗兔IgG(货号:#8889)购自美国Cell Signaling Technology公司,EM2(货号:GC10059)购自美国GlpBio公司。
1.3 方法
1.3.1病理性痛模型的制备 该研究参照Decosterd et al[6]的方法,制备坐骨神经分支选择性损伤(spared nerve injury,SNI)诱导的NP模型。大鼠腹腔注射戊巴比妥钠(50 mg/kg)麻醉后,切开左侧大腿背侧皮肤,钝性分离股二头肌,暴露坐骨神经及其3个分支:胫神经、腓总神经和腓肠神经,双重结扎并离断胫神经和腓总神经,保留并避免牵拉腓肠神经,逐层缝合手术切口。术后对切口进行常规消毒抗炎处理直至愈合。
1.3.2后足缩足反应阈值(paw withdrawal threshold,PWT)的测定 测试前3天,将大鼠放入行为学测试平台适应环境,每天1 h。手术当天、术后1、3、5、7 d以及给药后1、3、5、7、9 d使用校准的不同强度的Von Frey纤维丝测定大鼠的PWT值。测定时,待大鼠安静后,从最低刺激强度开始,用纤维丝垂直刺激大鼠足底外侧皮肤,持续3~5 s,当大鼠出现抬足、舔足或躲避等行为视为阳性反应。每个刺激强度重复测试5次,相邻两次刺激时间间隔5 min以上,以能引起3次以上阳性反应的最低刺激强度作为PWT值。
1.3.3鞘内置管和给药 大鼠麻醉后,以两侧髂前上棘连线中点为中心,沿脊柱两侧作纵向切口,钝性分离肌肉,暴露并去除第6腰椎棘突,将PE-10导管由腰5与腰6棘突间隙刺入蛛网膜下隙并向头端推入约2 cm,置管过程中可见导管内有清亮的脑脊液流出。固定导管,依次缝合肌肉和皮肤。置管术后的大鼠需分笼单独饲养。
鞘内给药时用微量注射器将5 μl药液或无菌生理盐水缓慢推入PE-10导管内,推注结束后再推入10 μl无菌生理盐水,使药物充分注射至蛛网膜下隙。推入过程以使大鼠一直保持安静状态为宜。
1.3.4Western blot实验 大鼠麻醉后,迅速取出腰4~6节段的DRG。提取蛋白后,采用BCA法检测上清液中的蛋白浓度。使用聚丙烯酰胺凝胶电泳,电泳后将蛋白转移到PVDF膜上,5%脱脂奶粉封闭30 min后,将PVDF膜置于一抗中:MOR抗体(1 ∶1 000)、Rab7抗体(1 ∶1 000)、Ser375MOR抗体(1 ∶1 000)或actin抗体(1 ∶1 000),4 ℃摇床过夜。TBST漂洗3次,每次10 min。滴加相应的二抗(1 ∶15 000),摇床上避光反应2 h后,TBST漂洗3次,每次10 min。使用双红外激光成像系统扫描成像。
1.3.5免疫荧光组织化学染色 大鼠麻醉后,经左心室、升主动脉灌注200 ml生理盐水后,灌注400 ml 4%多聚甲醛溶液,取腰4~6节段DRG后固定24 h,经30%蔗糖溶液脱水后行冰冻切片。10% FBS室温封闭30 min后,滴加一抗:MOR抗体(1 ∶500)、Rab7抗体(1 ∶200)或LAMP1抗体(1 ∶200),4 ℃孵育48 h,0.1 mol/L PBS漂洗3次,每次10 min。滴加二抗:Alexa488驴抗豚鼠IgG(1 ∶500)和Alexa594驴抗兔IgG(1 ∶500),室温避光孵育4 h,0.1 mol/L PBS漂洗3次,每次10 min,荧光封片剂封片后,荧光共聚焦显微镜拍照采集图像。
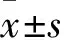
2 结果
2.1 SNI对大鼠PWT值的影响坐骨神经分支选择性损伤诱导的NP模型,可产生持久的机械痛行为学表现,是研究NP常用的模型之一。该实验SNI模型大鼠在术后第3天术侧PWT值与正常对照组比较明显降低(分组,F=430.8,P<0.01),术后第7天降低至最低水平,且至少持续至术后第21天。手术对侧的PWT值与正常对照组比较差异无统计学意义(图1)。
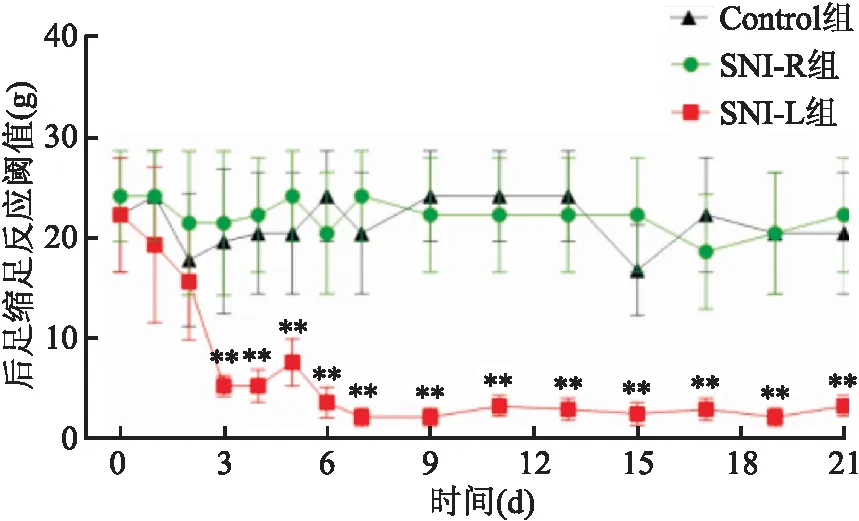
图1 SNI模型大鼠后足PWT的测定(n=6)
2.2 EM2的镇痛作用该实验使用SNI术后7 d的NP大鼠,鞘内注射不同剂量(1、5、10、20、40 μg)的EM2,给药后每隔10 min测定大鼠术侧后足PWT值,研究EM2作用的时程和量效变化。结果显示,鞘内注射1、5、10 μg的EM2对SNI的NP大鼠未产生明显的镇痛作用,20和40 μg EM2的镇痛效果和时程变化相似,即EM2给药10 min后的镇痛效应最显著(时间,F=88.44,P<0.01),给药20 min后药效降低,给药30 min后,EM2的镇痛效应消失,大鼠PWT值恢复至给药前水平(图2)。选择达到镇痛效应的最小剂量作为多次给药剂量,该实验EM2长期给药剂量为20 μg。

图2 鞘内注射EM2对SNI的NP大鼠镇痛作用的时程和量效变化
病理性痛组和药物组大鼠于术后第7天开始进行鞘内注射,每天1次,连续10 d,每隔1天于注射结束10 min后测定大鼠的PWT值。与注射前比较,鞘内注射生理盐水对NP大鼠PWT值没有明显的影响。与病理性痛组比较,鞘内注射EM2后,大鼠的PWT值明显升高(分组,F=376.8,P<0.01),连续给药10 d,EM2仍可有效缓解SNI的NP,且多次鞘内注射EM2,未见明显的镇痛效果降低现象(表1和图3)。

表1 三组大鼠后足缩足反应阈值比较
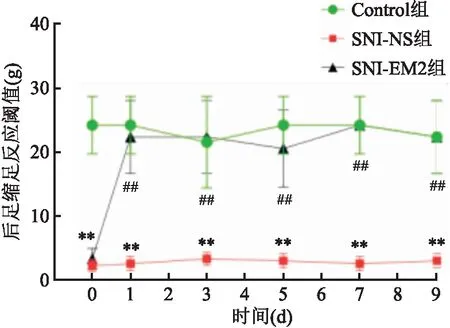
图3 EM2对SNI的NP大鼠后足PWT值的影响
2.3 EM2对SNI的NP大鼠DRG内MOR表达的影响免疫荧光染色结果显示,MOR免疫阳性产物主要分布于DRG的中、小直径神经元胞体和部分神经纤维中(图4A)。NP后,大鼠DRG内MOR阳性细胞数量明显降低(F=26.19,P<0.001)(图4A、B),鞘内注射EM2后,MOR阳性细胞数量明显升高(F=26.19,P<0.001),Western blot结果与形态学结果变化相似,与正常对照组比较,病理性痛组大鼠DRG内MOR的表达量下降(F=7.749,P<0.05)(图4C、D),药物组大鼠DRG内MOR蛋白的表达量升高(F=7.749,P<0.05)(图4C、D)。该实验进一步检测MOR磷酸化表达量的变化,结果显示,病理性痛组大鼠DRG内Ser375MOR蛋白的表达量较正常对照组降低(F=9.679,P<0.05),药物组大鼠DRG内Ser375MOR蛋白的表达量较病理性痛组升高(F=9.679,P<0.05)(图4E、F)。
图4 EM2对SNI的NP大鼠DRG内MOR表达的影响
2.4 胞内转运机制对EM2镇痛过程中的MOR表达变化的影响该实验使用免疫荧光单标染色和Western blot方法,研究了正常对照组、病理性痛组及药物组大鼠DRG内Rab7的表达变化。结果显示,与正常对照组比较,病理性痛组中Rab7的表达量明显增高(FIF=22.67,P<0.05;FWestern blot=12.19,P<0.01)。鞘内注射EM2后,药物组中的Rab7的表达量较病理性痛组降低(FIF=22.67,P<0.01;FWestern blot=12.19,P<0.05)(图5)。进一步对3组大鼠DRG神经元进行MOR与Rab7免疫荧光双重标记染色。结果显示:SNI的NP大鼠DRG内MOR/Rab7免疫双标阳性产物占Rab7阳性标志物或MOR阳性标志物的比例较正常对照组均明显升高(FRab7=10.76,P<0.01;FMOR=5.08,P<0.05),当给予EM2处理后,MOR/Rab7免疫双标阳性产物占Rab7阳性标志物或MOR阳性标志物的比例较病理性痛组均明显降低(FRab7=10.76,P<0.05;FMOR=5.08,P<0.05)(图6)。
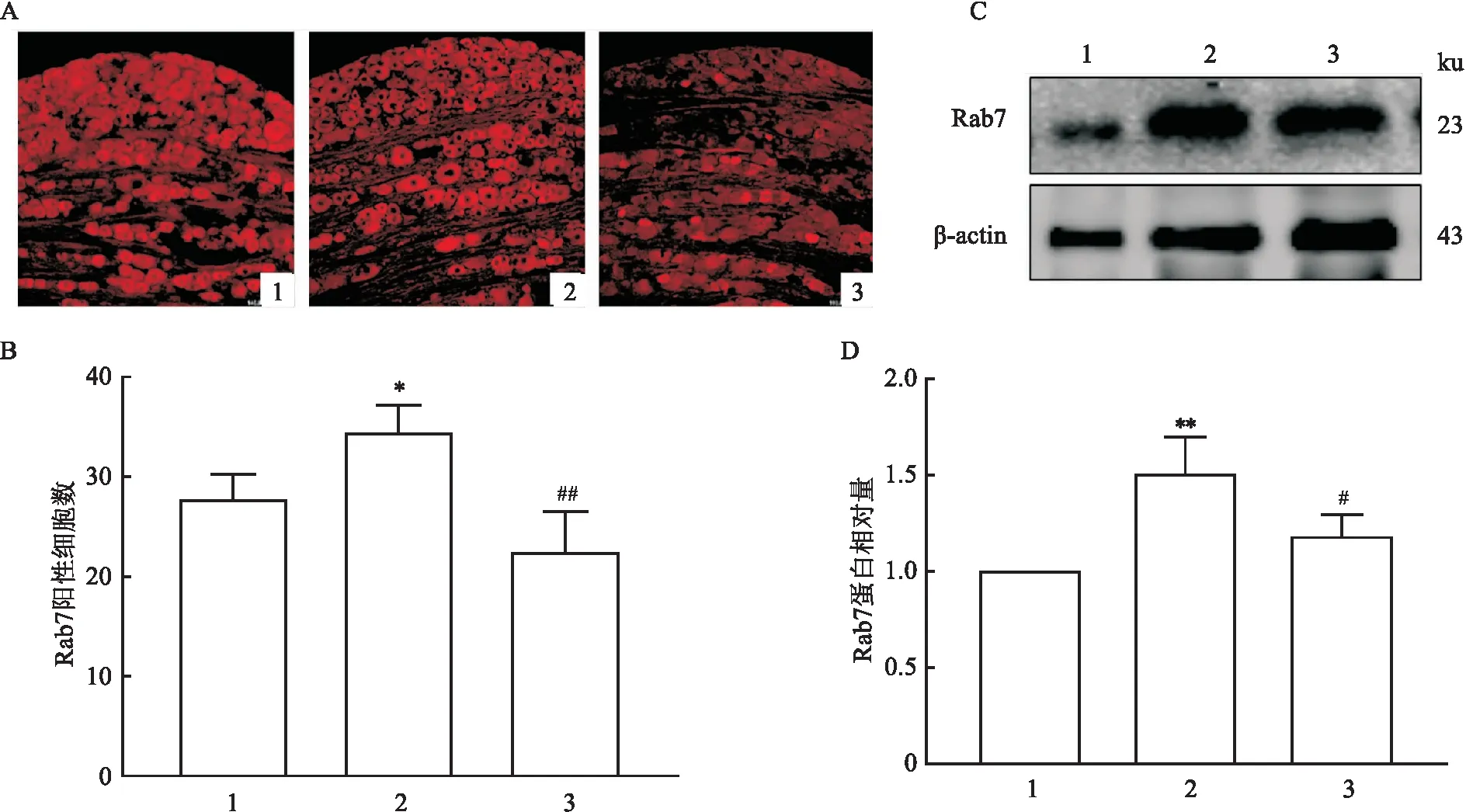
图5 EM2对SNI的NP大鼠DRG内Rab7表达的影响
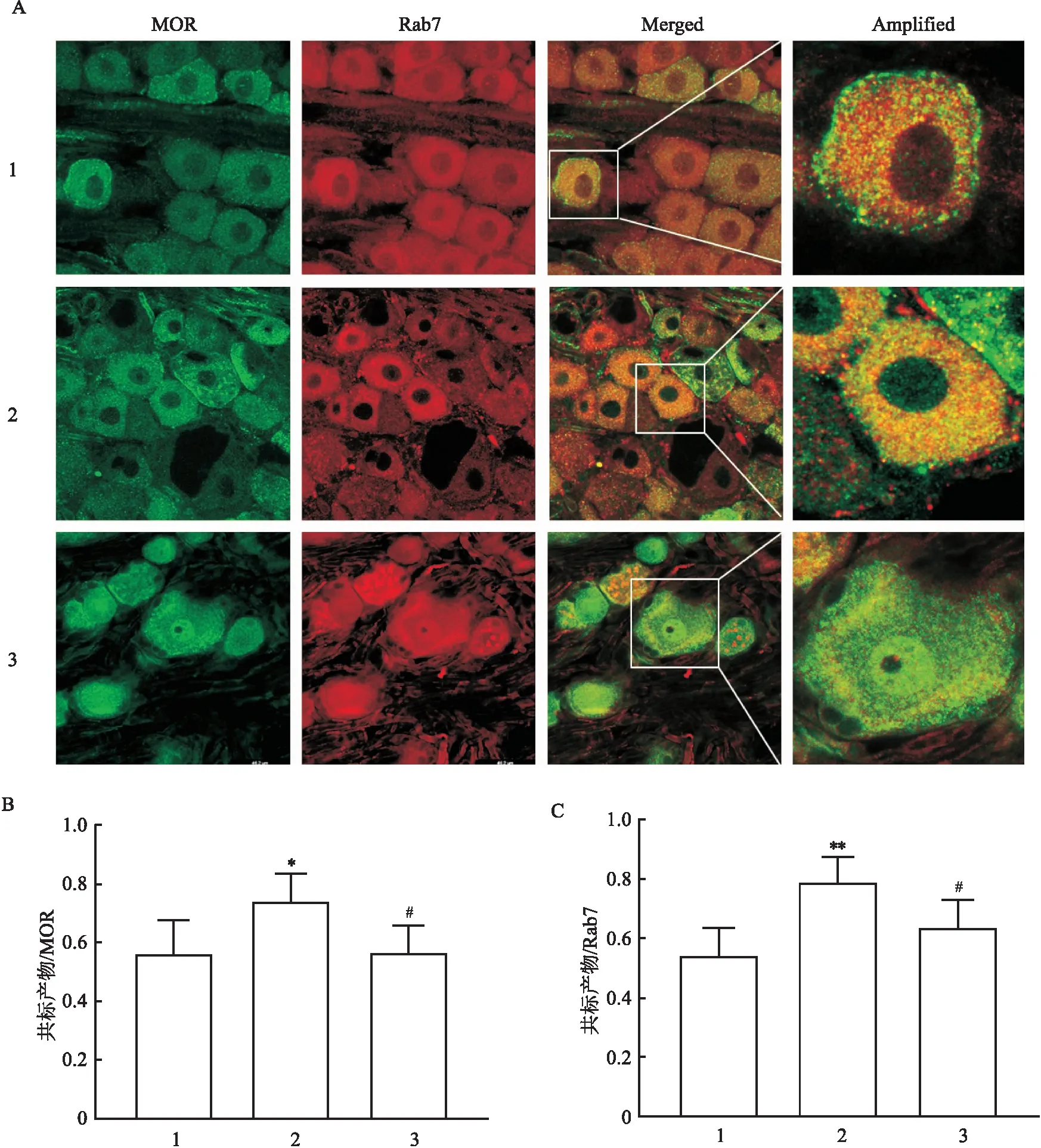
图6 免疫荧光双标染色检测MOR与Rab7双标阳性产物
溶酶体相关膜蛋白1 (lysosomal associated membrane protein 1,LAMP1)分布于自噬细胞器和内溶酶体细胞器,可作为溶酶体标志物。免疫荧光双标染色结果显示:与正常对照组比较,病理性痛组大鼠DRG内MOR/LAMP1免疫双标阳性产物占LAMP1或MOR免疫阳性产物的比例均增高(FLAMP1=6.215,P<0.05;FMOR=7.681,P<0.01)。鞘内注射EM2后,与病理性痛组比较,药物组大鼠DRG内MOR/LAMP1免疫双标阳性产物占LAMP1或MOR免疫阳性产物的比例均明显降低(FLAMP1=6.215,P<0.05;FMOR=7.681,P<0.05)(图7)。
3 讨论
DRG是外周感觉性信息传递至中枢的第一站。DRG神经元内的MOR,是内源性阿片系统的重要组成部分,也是临床上阿片类药物作用的主要受体。既往研究[7]表明,在阿片类药物治疗效果欠佳的NP和糖尿病NP等动物模型DRG神经元内MOR的表达量降低,但是在阿片类物质镇痛效果较好的炎性痛模型中,脊髓背角和DRG神经元内MOR的表达量增加,提示MOR的表达量与阿片类药物的镇痛疗效密切相关。
作为MOR的天然的内源性配体,EM2能有效缓解炎性痛、癌性痛和NP[8],尤其对传统镇痛药物不敏感的糖尿病NP具有较好的镇痛效果[3]。该实验显示多次注射EM2未见明显的药效降低。Wu et al[9]研究显示,鞘内注射携带EM2的重组腺病毒对SNI的NP具有较好的镇痛效应,且没有成瘾和耐受等副作用,以上结果与该研究结果一致,但是作者未研究DRG或脊髓中MOR的表达与EM2介导的镇痛效应之间的关系。体外研究显示,EM2可对人神经母细胞瘤细胞SH-SY5Y[10]和人乳腺癌细胞MCF7[11]中MOR的mRNA表达产生正向和负向的调节作用,推测这种调节的差异性是由于EM2对不同亚型腺苷酸环化酶活性的作用不同,抑制或促进cAMP表达,从而对基因转录水平产生不同影响。然而文中未探究EM2介导的MOR蛋白表达变化。研究[12]表明,在炎症、神经病变或骨损伤等病理状态下,外周阿片受体的数量增加是阿片类药物镇痛作用增强的原因之一。该实验在体研究中显示,药物组DRG内MOR的表达量明显升高,提示MOR的表达增加可能是EM2多次注射未见明显药效降低的原因。
MOR蛋白结构内大约有20个潜在的磷酸化位点有助于受体脱敏和胞吞作用。研究[13]显示,EM2对MOR具有高亲和力,其与MOR结合后,可使Ser375MOR发生快速磷酸化[14]。该实验连续鞘内注射EM2明显增加SNI大鼠DRG内Ser375MOR蛋白的含量,与上述结果一致。磷酸化后的受体与β-抑制蛋白2(β-arrestin 2)结合,形成MOR-β-arrestin 2复合体内吞进入胞内。Rab蛋白是一类小分子调节蛋白,广泛存在于细胞质膜和细胞器膜中,其中Rab7是将内吞囊泡运输至晚期溶酶体的关键调节蛋白,可作为受体降解失活的指标[15]。该研究表明,SNI的NP大鼠DRG内Rab7的表达增加,且MOR/Rab7和MOR/LAMP1免疫荧光双标产物占Rab7阳性标志物或LAMP1阳性标志物的比例增高。提示SNI的NP后DRG内Rab7表达上调,MOR进入溶酶体发生降解,导致受体数量减少。这与Mousa et al[2]在糖尿病NP大鼠DRG的观察的结果一致。鞘内注射EM2后,药物组大鼠DRG内Rab7的表达较病理性痛组降低,MOR/Rab7和MOR/LAMP1免疫荧光双标产物占Rab7阳性标志物或LAMP1阳性标志物的比例降低。提示EM2作用后,内吞的受体囊泡进入溶酶体降解途径减少,这可能是药物组大鼠DRG神经元中MOR表达增加的原因之一。
神经-免疫-内分泌环路是存在于动物和人体内重要的调节网络,维持机体稳态平衡。神经生长因子(nerve growth factor,NGF)是神经元的营养物质,由外周组织合成,逆行运输至脊髓和DRG的神经元中。外周神经损伤可阻断NGF的运输,从而降低其在脊髓和DRG神经元中的表达。EM2作为内源性阿片肽,除了发挥镇痛作用,在神经系统的保护和分化过程中均发挥着重要的作用。阿片肽可促进NGF的表达[16]。外源性NGF可增加初级神经元MOR的表达[17],而Mousa et al[2]在糖尿病性痛大鼠DRG内显示NGF可以抑制胞内Rab7的表达,由此推测,SNI的NP状态下,神经体液因素可能也参与了EM2与MOR结合后的受体胞内转运过程。

