创伤性脑损伤大鼠不同脑区胶质纤维酸性蛋白表达的变化
曹 艳,李恒希,李佳丽,凌腾晗,尹爱平,周 莹,杨 莉,吴海鹰,李 坪
创伤性脑损伤(traumatic brain injury,TBI)是由创伤性事件引起的神经系统损伤性疾病,是较为严重的公共卫生问题。研究[1]表明TBI的发病率还在迅速上升。星形胶质细胞是大脑中数量最庞大的胶质细胞,广泛分布于大脑和脊髓中。生理条件下,星形胶质细胞在支持神经元功能以及维持血脑屏障完整性等方面至关重要[2]。TBI发生后,机械损伤引起星形胶质细胞增生或活化[3],导致星形胶质细胞形态及功能发生异常变化。然而,对于脑创伤后活化星形胶质细胞在不同脑区出现的分布特点、打击侧的表达变化和形态学变化特征以及对侧是否被波及影响等依然缺乏报道,因此,研究活化星形胶质细胞对研究TBI后继发性病理变化以及预后具有重要意义。作为星形胶质细胞特征性标志物的胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)是一种中间纤维蛋白,可以调节星形胶质细胞的运动和形状,提供结构稳定性[4]。因此,在该研究中,主要观察TBI后星形胶质细胞在不同脑区被激活的形态学变化特点以及GFAP表达情况。
1 材料与方法
1.1 主要试剂与仪器兔抗大鼠GFAP单克隆抗体(美国Abcam公司),兔抗大鼠β-actin多克隆抗体、HRP标记的羊抗兔二抗(武汉三鹰生物技术有限公司),即用型免疫组化超敏UltraSensitiveTMSP试剂盒(福州迈新生物技术开发有限公司),超敏ECL化学发光底物(合肥白鲨生物科技有限公司),大鼠脑立体定位仪(深圳瑞沃德生命科技有限公司),光学显微镜(德国Leica公司),电泳仪、转膜仪、凝胶成像系统(美国Bio-Rad公司),RNAiso Plus(日本Takara公司)。
1.2 实验动物SPF级SD雄性大鼠购自昆明医科大学实验动物中心,体质量260~280 g,共16只,提前1周饲养于适宜环境(温度20~25 ℃、湿度55%~65%)中。
1.3 实验方法
1.3.1分组和模型制备 实验大鼠随机分为2组:假手术组(Sham组)和模型组(TBI组)。TBI模型采用改良的Feeney自由落体法进行制备。用2%戊巴比妥钠(2 ml/kg)腹腔麻醉大鼠后,固定于脑立体定位装置中,头顶部进行常规消毒后,在冠状缝下侧2 mm和矢状缝右侧2.5 mm处进行直径约6 mm的开骨窗手术,暴露硬脑膜,将砝码(40 g)通过铜管从15 cm的高度自由落体式落下,打击撞击子至暴露于骨窗的脑组织从而造成TBI,然后迅速拉回砝码,止血并清理手术区域后,用骨蜡封闭骨窗并缝合皮肤。假手术组大鼠进行相同的开骨窗手术,但不进行打击。
1.3.2组织样本处理和收集 脑创伤后2 d[5]进行组织取材,用2%戊巴比妥钠(2 ml/kg)进行腹腔内麻醉,经左心室灌注生理盐水直至流出的液体清亮,然后用4%多聚甲醛溶液灌注,在冰上解剖取出脑组织,浸入4%多聚甲醛溶液中进行后固定,用于组织学分析。部分脑组织仅用生理盐水灌注,取出脑组织后放入-80 ℃冰箱保存,用于蛋白质测定分析。
1.3.3免疫组织化学染色 从4%多聚甲醛溶液中取出后固定的脑组织,将组织包埋在石蜡中,用切片机制作成5 μm厚的冠状切片。选用福州迈新公司的免疫组化S-P法试剂盒进行染色。切片常规脱蜡至水后,通过高温高压进行抗原修复15 min,待其冷却至室温,PBS冲洗3次,滴加试剂1(内源性过氧化物酶阻断剂)室温孵育10 min,PBS冲洗3次,滴加试剂2(非特异性染色阻断剂)室温孵育20 min,直接倾去液体,滴加兔抗大鼠GFAP单克隆抗体(1 ∶500)于4 ℃孵育过夜,次日,PBS冲洗3次,滴加试剂3(生物素标记的羊抗兔IgG聚合物)室温孵育1 h,PBS冲洗3次,滴加试剂4(链霉菌抗生素蛋白-过氧化物酶)室温孵育15 min,PBS冲洗3次,DAB显色,梯度酒精脱水、二甲苯透明后,用中性树胶封固切片,在显微镜下进行观察并采集图像,使用Image J软件分析免疫阳性细胞的平均吸光度值。
1.3.4RT-qPCR实验 从-80 ℃冰箱取出脑组织样品,使用RNAiso Plus试剂盒提取总RNA,逆转录试剂盒将其合成cDNA后进行PCR反应,采用2-ΔΔCt法计算相对基因表达量。相关引物由上海生工生物有限公司合成,序列如下:GAPDH上游引物为5′-GACATGCCGCCTGGAGAAAC-3′,下游引物为:5′-AGCCCAGGATGCCCTTTAGT-3′;GFAP上游引物为:5′-TAAGCTAGCCCTGGACATCG-3′,下游引物为:5′-TACAGGAATGGTGATGCGGT-3′。
1.3.5Western blot实验 从-80 ℃冰箱取出脑组织样品,使用RIPA裂解液(含1%蛋白酶抑制剂)进行匀浆,提取脑组织中总蛋白,BCA蛋白检测试剂盒测定蛋白浓度。将蛋白样品经SDS-PAGE凝胶电泳分离并转移到PVDF膜上,在室温下用5%的脱脂牛奶封闭膜2 h,4 ℃下将膜与以下一抗孵育过夜:兔抗大鼠GFAP单克隆抗体(1 ∶5 000)、兔抗大鼠β-actin多克隆抗体(1 ∶5 000)。次日,用TBST溶液洗涤PVDF膜后,将膜与HRP结合山羊抗兔IgG二抗在室温下孵育1 h。使用ECL化学发光底物以及Bio - Rad成像系统检测蛋白条带,使用Image J软件测定各蛋白条带的灰度值。
1.3.6脑区划分 研究的脑区共有5个脑区,即:皮质1~4区和中脑区,见图1。样品蛋白分为右侧皮质总蛋白(包含部位1~4)、左侧皮质总蛋白、右侧中脑总蛋白(包含部位5)、左侧中脑总蛋白。
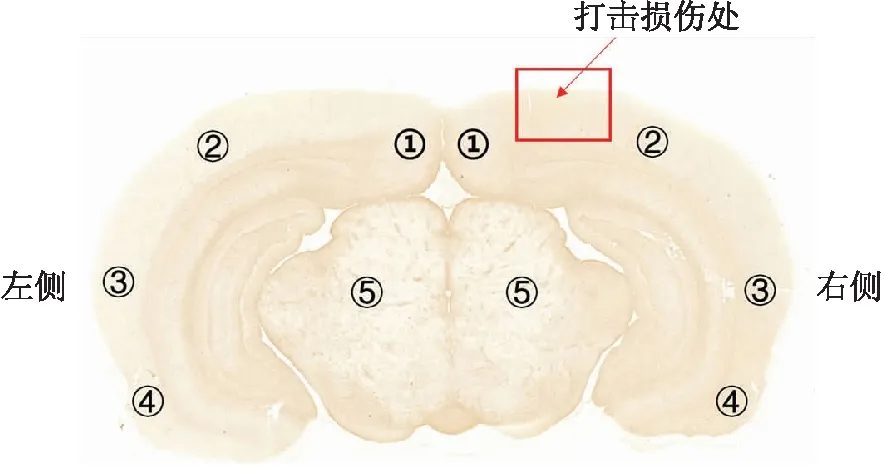
图1 大鼠脑区示意图
2 结果
2.1 TBI后不同脑区GFAP表达的变化通过免疫组化染色对5个脑区中GFAP阳性表达的平均吸光度值进行统计。结果显示:① Sham左侧与Sham右侧对比:GFAP阳性表达没有明显变化;② Sham左侧与TBI左侧对比:TBI组的皮质1区与中脑区的GFAP阳性表达有所升高[t=3.15(皮质1区),P<0.05;t=3.50(中脑区),P<0.01];③ Sham右侧与TBI右侧对比:TBI组各脑区的GFAP阳性表达均有所升高[t=5.98(皮质1区)、3.52(皮质2区)、3.20(皮质3区)、5.61(皮质4区)、7.02(中脑区),P<0.01];④ TBI左侧与TBI右侧对比:TBI右侧的GFAP阳性表达均有所升高[t=5.02(皮质1区),P<0.05;t=3.33(皮质2区),P<0.01;t=2.37(皮质3区)、3.17(皮质4区)、2.86(中脑区),P<0.05](图2)。提示TBI右侧各脑区的星形胶质细胞均发生激活,并且波及到对侧(左侧)的脑区仅有皮质1区和中脑区。
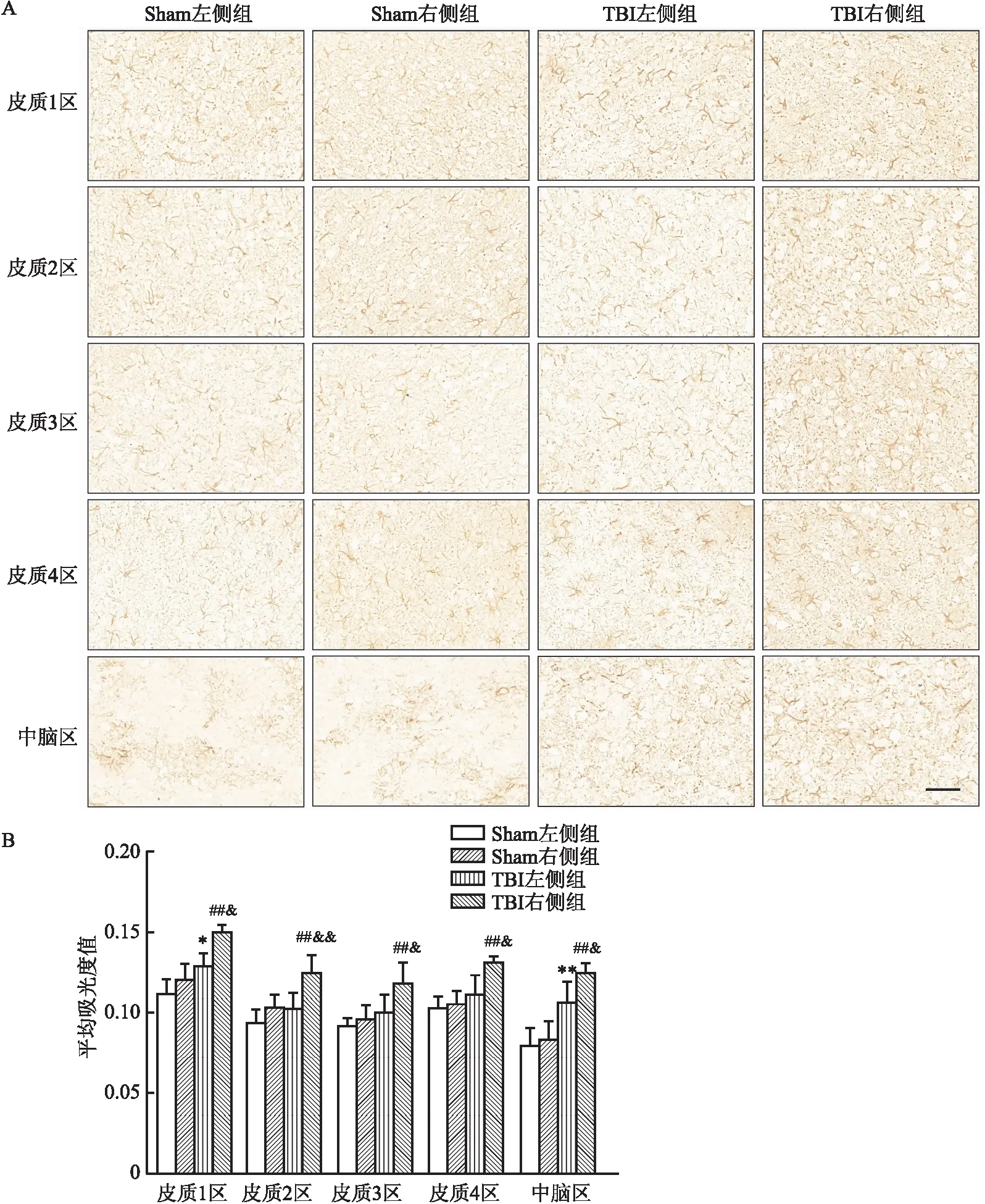
图2 不同区域GFAP的表达情况
2.2 TBI后皮质和中脑区GFAP蛋白表达的变化通过Western blot实验对不同脑区中GFAP蛋白的表达进行统计。结果显示:(1)在皮质总蛋白中,①
Sham左侧与Sham右侧比较:GFAP蛋白表达没有明显变化;② Sham左侧与TBI左侧比较:GFAP蛋白表达没有明显变化;③ Sham右侧与TBI右侧比较:TBI组的GFAP蛋白表达出现升高(F=7.751,P<0.05);④ TBI左侧与TBI右侧比较:TBI右侧的GFAP蛋白表达升高(P<0.05)。(2)在中脑总蛋白中,① Sham左侧与Sham右侧比较:GFAP蛋白表达没有明显变化;② Sham左侧与TBI左侧比较:TBI组的GFAP蛋白表达明显升高(F=40.03,P<0.01);③ Sham右侧与TBI右侧比较:TBI组的GFAP蛋白表达明显升高(P<0.01);④ TBI左侧与TBI右侧比较:TBI右侧的GFAP蛋白表达出现升高(P<0.05)(图3)。提示TBI右侧各脑区GFAP蛋白均出现高表达,并且波及到对侧(左侧)的中脑区。
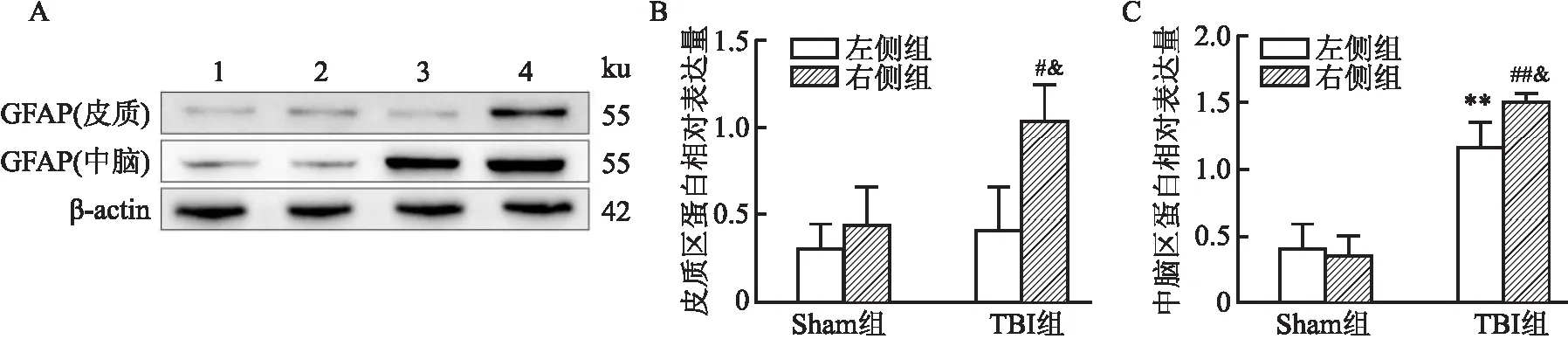
图3 皮质和中脑区GFAP蛋白的表达情况
2.3 TBI后皮质和中脑区GFAP的mRNA表达变化通过RT-qPCR实验对不同脑区中GFAP的mRNA表达进行统计。结果显示:(1)在皮质总RNA中,① Sham左侧与Sham右侧比较:GFAP的mRNA表达没有明显变化;② Sham左侧与TBI左侧比较:TBI组的GFAP mRNA表达出现升高(F=37.26,P<0.05);③ Sham右侧与TBI右侧比较:TBI组的GFAP mRNA表达出现升高(P<0.01);④ TBI左侧与TBI右侧比较:TBI右侧的GFAP mRNA表达升高(P<0.01)。(2)在中脑总RNA中,① Sham左侧与Sham右侧比较:GFAP mRNA表达没有明显变化;② Sham左侧与TBI左侧比较:TBI组的GFAP mRNA表达明显升高(F=301.2,P<0.01);③ Sham右侧与TBI右侧比较:TBI组的GFAP mRNA表达明显升高(P<0.01);④ TBI左侧与TBI右侧比较:TBI右侧的GFAP mRNA表达出现升高(P<0.01)(图4)。提示TBI右侧各脑区GFAP mRNA均出现高表达,并且波及到对侧(左侧)的皮质区和中脑区。
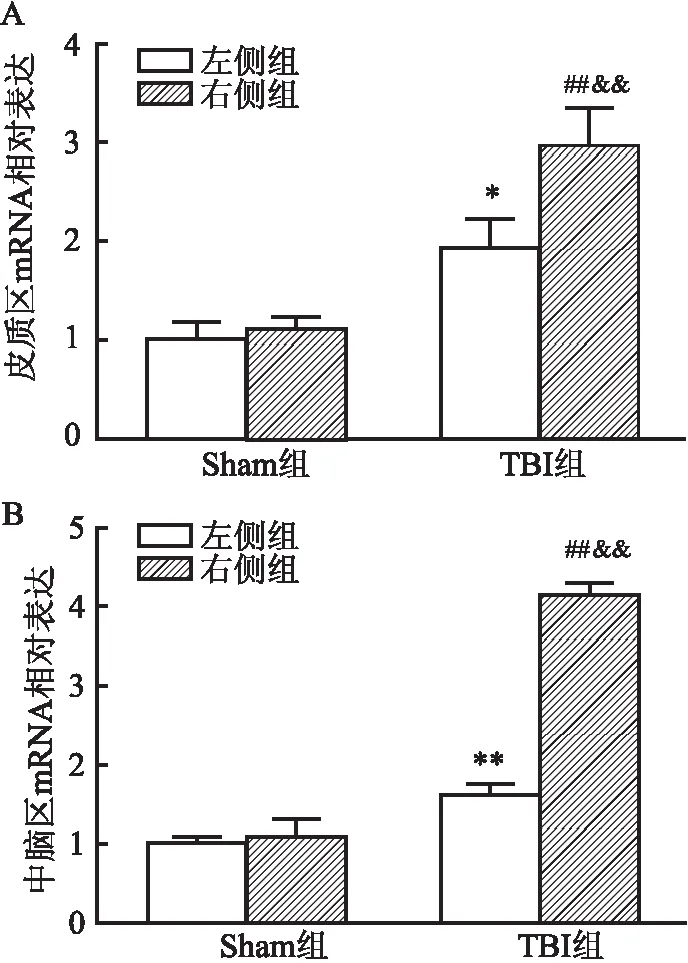
图4 皮质和中脑区GFAP的mRNA表达情况
3 讨论
星形胶质细胞作为大脑组织中数量最多的一种胶质细胞类型,是参与中枢神经系统稳态和血流控制的胶质细胞,为神经元提供结构和功能支持,包括通过细胞外离子浓度调节神经元活化,通过向神经元转移乳酸调节大脑能量动力学以及通过释放谷氨酸和三磷酸腺苷等神经递质调节突触传递。此外,星形胶质细胞在脑损伤后的神经元重建中发挥关键作用,包括神经发生、突触生成、血管形成、血脑屏障修复以及TBI后胶质瘢痕形成等,在疾病的发生、发展及治疗过程中起到重要作用[6]。在该研究中,TBI后右侧各脑区以及左侧的皮质1区和中脑区的星形胶质细胞出现胞体变大、突起增粗的形态学变化,打击损伤侧GFAP蛋白和mRNA表达也明显增多,以上提示脑损伤大鼠皮质区和中脑区域中星形胶质细胞被激活,表达增多,参与了TBI致伤后的病理变化。查阅文献[7],在大鼠控制性皮质撞击损伤模型中,星形胶质细胞在脑损伤后被激活,并且表明在打击损伤侧和对侧皮层中均被广泛激活,出现了与该研究结果相似的变化,当TBI诱导星形胶质细胞过度活化后,会导致继发性损伤,并引起一系列促氧化作用[7]。该课题组前期研究[8]表明,TBI会引起星形胶质细胞激活,造成GFAP以及炎症因子TNF-α、IL-1β蛋白表达升高,导致脑水肿、神经功能缺损等病理反应。有文献[9]也报道星形胶质细胞在脑损伤或其他神经退行性疾病发生后会变得过度激活,这将会导致突触丢失和选择性神经元死亡,此外,过度活化的星形胶质细胞释放细胞毒素,介导毒性水肿和炎症,并形成瘢痕,抑制轴突再生。这些证据均表明,星形胶质细胞在TBI后继发性脑损伤中起着关键作用。
该研究表明,TBI致伤后星形胶质细胞激活范围较广泛,打击侧呈现弥漫性的激活,并可累及对侧皮质区,这可能与自由落体打击脑组织时损伤力量的传递有关。有研究[10]报道,颅脑损伤后会出现出血部位脑组织肿胀以及局部低氧等继发性损伤,从而导致广泛的轴索变性,迅速累及未打击部位,从而使原发性损伤加剧。黄树宣 等[11]研究表明在TBI后第21天,模型组小鼠打击损伤对侧皮层的星形胶质细胞增殖活化依然较对照组显著增加,这与该研究中结果是一致的,表明脑损伤不仅可以出现在原发的撞击部位,也可以由近到远的波及到对侧部分脑区。同时,该研究还表明,打击对侧中脑区域的星形胶质细胞同样出现激活状态。有文献报道,在控制性皮质撞击损伤(CCI)模型中,Li et al[12]使用脂质组学和代谢组学的质谱成像技术追踪了大鼠脑组织受损后不同区域的变化,分析显示除了创伤区外,中脑是创伤后弥漫性变化最大的区域。而目前颅脑创伤的研究更多的集中在皮质和海马部位,中脑区的报道依然较少。
该研究对脑创伤后的星形胶质细胞区域异质性做了初步的探索,未来还可分别对皮质区和中脑区的功能进一步探讨,以说明星形胶质细胞在不同脑区中的作用机制。同时,TBI发生后,星形胶质细胞呈现激活,因此,对该细胞进行干预,可能对治疗TBI具有重要意义,为TBI的防治提供线索。该研究只选用了一个分子标签GFAP进行研究,具有一定局限性,因此,后续需要采用多个指标做进一步验证,以便更为准确地反映星形胶质细胞在大脑各区域的分布情况。

