T 淋巴细胞亚群、血管内皮功能指标与脓毒症患者预后的关系
陈玉凤, 陈宏毅, 王晓萍
(福建省立医院 急诊科, 福建 福州 350001)
脓毒症是临床常见严重感染性疾病, 其发病机制复杂, 涉及多种免疫细胞及分子的相互作用[1]。 血管内皮主要指血管壁分布的一层细胞, 其具有维持血管通透性、 调节血管张力等多种作用, 脓毒症发生后患者普遍存在血管内皮功能损伤[2]。 T淋巴细胞亚群作为机体免疫调节的参与者, 脓毒症发生后患者免疫功能改变可引起T 淋巴细胞亚群水平变化[3]。 本研究探讨T 淋巴细胞亚群及血管内皮功能指标与脓毒症患者预后的关系,现报道如下。
1 资料与方法
1.1 一般资料选取2020 年1 月至2023 年1 月期间我院收治的150 例脓毒症患者作为研究对象。 纳入标准: ①符合 《2012国际严重脓毒症及脓毒性休克诊疗指南》[4]中相关诊断标准;②年龄≤70 岁; ③已签署知情同意书。 排除标准: ①合并免疫功能障碍; ②合并其他可能影响血管内皮功能、 T 淋巴细胞亚群的疾病; ③合并心、 肺等器质性病变; ④认知功能障碍。 其中男性81 例, 女性69 例; 年龄36 ~69 岁, 平均年龄 (56.36± 5.84) 岁。 本 研 究 已 获 得 我 院 伦 理 委 员 会 批 准 (批 号:202001-15)。
1.2 方法采集患者肘静脉血4 mL, 3 000 r/min 常规离心10 min, 获取血清标本, 采用酶联免疫吸附试验测量患者血管性假血友病因子 (vWF)、 一氧化氮 (NO)、 内皮素-1 (ET-1)水平, 试剂盒购自武汉华美生物工程有限公司, 检测严格按照说明书进行。 采用流式细胞仪 (美国贝克曼库特尔, CytoFLEX型) 测定患者T 淋巴细胞亚群 (CD3+、 CD4+、 CD8+)。 根据患者1 个月内死亡情况分为死亡组与存活组, 比较不同预后患者T 淋巴细胞亚群及血管内皮功能指标, 并分析脓毒症患者1 个月内死亡的危险因素。
1.3 统计学分析采用SPSS 24.0 统计软件处理数据。 符合正态分布的计量资料以x ± s 表示, 比较采用t 检验; 危险因素分析采用Logistic 回归分析; P <0.05 为差异有统计学意义。
2 结果
2.1 不同预后患者T淋巴细胞亚群比较150 例患者1 个月内共死亡38 例, 存活112 例。 死亡组CD3+、 CD4+水平低于存活组, CD8+水平高于存活组 (P <0.05)。 见表1。
表1 死亡组与存活组CD3+、 CD4+、 CD8+水平比较 (±s, %)
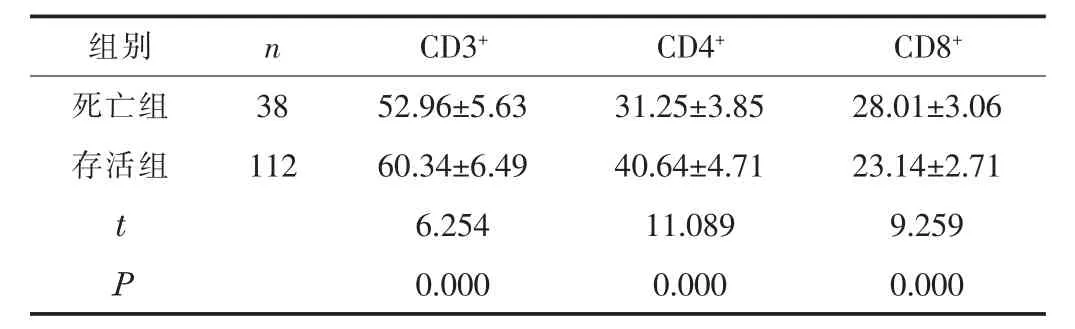
表1 死亡组与存活组CD3+、 CD4+、 CD8+水平比较 (±s, %)
组别 n CD3+ CD4+ CD8+死亡组 38 52.96±5.63 31.25±3.85 28.01±3.06存活组 112 60.34±6.49 40.64±4.71 23.14±2.71 t 6.254 11.089 9.259 P 0.000 0.000 0.000
2.2 不同预后患者血管内皮功能指标比较死亡组血清NO 水平低于存活组, vWF、 ET-1 水平高于存活组 (P <0.05)。 见表2。
表2 死亡组与存活组血管内皮功能指标比较 (±s)
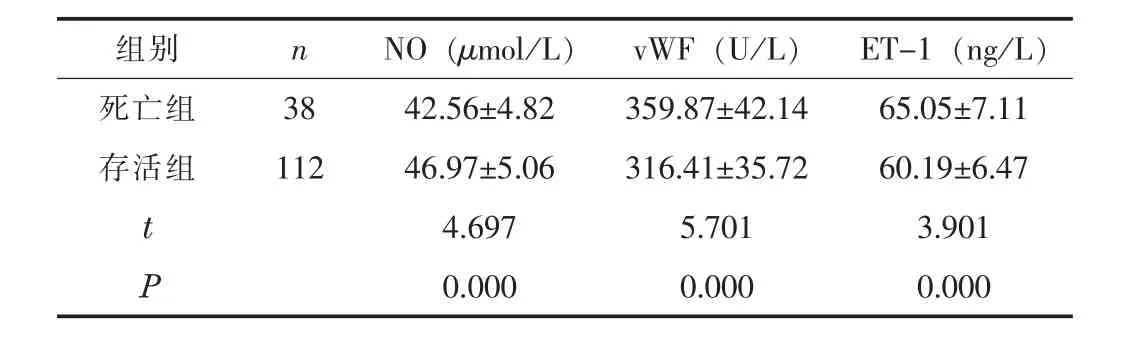
表2 死亡组与存活组血管内皮功能指标比较 (±s)
组别 n NO (μmol/L) vWF (U/L) ET-1 (ng/L)死亡组 38 42.56±4.82 359.87±42.14 65.05±7.11存活组 112 46.97±5.06 316.41±35.72 60.19±6.47 t 4.697 5.701 3.901 P 0.000 0.000 0.000?
2.3 脓毒症患者1个月死亡的危险因素分析以患者死亡/存活为应变量, 纳入CD3+、 CD4+、 CD8+及NO、 vWF、 ET-1 为自变量, 控制年龄、 性别等因素, Logistic 回归分析结果显示CD8+、ET-1、 vWF 为脓毒症患者1 个月内死亡的危险因素 (OR>1, P<0.05), CD3+、 CD4+及NO 为保护因素 (OR<1, P <0.05)。 见表3。

表3 脓毒症患者1 个月死亡的Logistic 回归分析结果
3 讨论
脓毒症具有恶性程度高、 死亡风险高的特点, 是临床常见危重症, 因此, 寻找可靠的血清学指标对于脓毒症患者的病情评估及预后预测至关重要。 研究[5]表明, 脓毒症病理过程复杂, 当机体促炎因子与抗炎因子平衡紊乱, 炎症级联反应增强时, 可引起免疫功能紊乱, 患者病原体清除能力进一步下降,病情加速恶化。 此外, 研究[6]表明, 除了免疫功能紊乱的影响, 约有20%的脓毒症患者死亡与血管内皮功能紊乱有关。
T 淋巴细胞亚群在机体免疫调节中具有重要作用, 其中CD3+可诱导T 细胞活化, 增强T 淋巴细胞的活化增殖; CD4+可分化为不同亚型的T 细胞, 抑制病毒复制, 减少病毒载量, 避免免疫损伤加重; CD8+为毒性T 细胞, 可抑制机体免疫力[7]。本研究结果显示, 死亡组CD3+、 CD4+水平低于存活组, CD8+高于存活组 (P <0.05); Logistic 回归分析结果显示CD8+为患者死亡的危险因素 (OR>1, P <0.05), CD3+、 CD4+为保护因素(OR<1, P <0.05), 表明T 淋巴细胞亚群与脓毒症患者预后具有密切关联。 脓毒症患者普遍存在免疫功能紊乱, 此类患者的诊疗过程中需改善患者的免疫功能。
既往研究[8]表明, 血管内皮功能损伤引起的微循环障碍也是脓毒症患者死亡的重要原因。 脓毒症发生后, 内皮细胞活化促使组织因子表达增加, 外源性凝血系统被激活, 凝血功能紊乱加重局部微循环障碍。 此外, 内皮细胞损伤后引起毛细血管通透性增加, 也可引起微循环灌注不足, 加重组织器官损伤。 血管内皮功能指标中, vWF 主要分布于血管内皮细胞, 正常状态下血内水平较低, 血管内皮细胞受损后释放入血, 其血内水平越高提示血管内皮损伤越严重; NO 具有血小板聚集抑制作用, 可舒张血管, ET-1 主要由血管内皮细胞分泌, 具有血管收缩作用, NO、 ET-1 分泌失调时可加重血管内皮损害,促使患者病情发展[9]。 本研究结果显示, 死亡组血清NO 水平低 于 存 活 组, vWF、 ET-1 水 平 高 于 存 活 组 (P <0.05), 且vWF、 ET-1为患者死亡的危险因素 (OR>1, P <0.05), NO 为保护因素 (OR<1, P <0.05), 表明血管内皮功能指标与脓毒症患者的预后关联密切。 脓毒症发生、 发展过程中血管内皮功能持续参与, 监测血管内皮功能并进行针对性治疗, 改善患者血管内皮功能可一定程度上改善预后。
综上所述, 血管内皮功能指标、 T 淋巴细胞亚群是脓毒症患者预后的影响因素, 临床诊疗中需重视患者血管内皮功能及T 淋巴细胞亚群的监测。

