铜氧化物对钨系延期药的燃烧催化作用
马文喆,贾玉馨,张 晔,于国强,付东晓,陈 丽,党鹏阳
(陕西应用物理化学研究所,陕西 西安 710061)
引 言
延期药通过稳定线性燃烧来控制火工品的传火或传爆序列的作用时间,从而实现延期起爆或引燃功能,在导弹武器系统、空间飞行器和常规兵器领域中得到广泛应用[1-5]。近年来,伴随着部队和总体单位加大产品的使用频次与极限环境使用条件,使得演训过程中越来越多的延期药暴露出延期时间不稳定,延期时间漂移过大等问题,严重影响武器装备系统的使用可靠性和安全性[6-9]。作为典型秒级延期药,作用时间为1~2s的钨系延期药主要由钨粉(W)、高氯酸钾(KClO4)以及铬酸钡(BaCrO4)组成,其燃烧速率长贮下偏低、延期时间稳定性不高等问题严重制约装置作用的可靠性与稳定性[10-13]。钨系延期药的供能体系主要是通过高氯酸钾的分解,释放氧气并与延期药体系中其他组分发生氧化还原反应,以达到钨系延期药高效反应目的[14]。因此,高氯酸钾热分解行为对于钨系延期药燃烧性能的影响至关重要。高氯酸钾的热分解温度为618℃,高分解温度壁垒严重制约了其在药剂使用过程中的组分含量,从而局限了高氯酸钾对钨系延期药燃烧性能的改善力度[15]。为了降低高氯酸钾的热分解温度,提升其在钨系延期药组成中的有效含量,具有特殊效能的功能性材料的添加为上述问题提供了解决策略[16]。
功能添加剂可以通过控制反应进行甚至是改变反应历程,达到加快或延迟反应进程的目的,因此被引入到延期药中用于改善延期药的性能[17-18]。铜化合物是一种绿色、高效、生态安全性良好的功能添加剂。在过去的二十年中,利用铜金属氧化物、铜金属有机配合物以及新型含能铜盐等(包括氧化铜、2,4-二羟基苯甲酸铜、1,8-二羟基-4,5-二硝基蒽醌铜等)的催化活性,对推进剂中氧化剂组分(AP、RDX、HMX等)的热分解以及基于氧化剂的推进剂进行了广泛研究并收到了理想的催化燃烧效果[19-23]。研究认为,金属氧化物与金属有机配合物燃烧催化过程均以金属氧化物作为催化活性中心,金属氧化物由于其独特的金属活性位点能够使得其在促进高能材料燃烧方面有较好的应用价值。铜氧化态作为催化剂在燃烧反应历程中与主组分发生氧化还原反应并伴随着部分电荷转移,+1价的Cu2O与+2价的CuO分别参与反应的电荷量有较大区别,从而影响催化活性位点的分布,因此价态的区别对于氧化物的燃烧催化活性影响至关重要[15,16-17,19]。基于此,异价铜金属氧化物作为延期药燃烧催化剂的不同催化效果以及差异化原因的探究对延期药性能提升具有重要意义。
因此,为了探究铜氧化物对钨系延期药的燃烧效能,本研究通过选用不同价态铜离子的铜氧化物分别与钨系延期药进行复合得到钨系复合延期药,探究了两种铜氧化物对高氯酸钾以及钨系延期药的燃烧催化性能的影响规律,以期为钨系延期药燃烧性能的优化提供一定的依据。
1 实 验
1.1 试剂与仪器
本实验所有材料均可商购且不需进一步提纯。高氯酸钾(KClO4,AR,纯度99.5%)、氧化铜(CuO,AR,纯度99.0%)、氧化亚铜(Cu2O,AR,纯度97.0%),上海阿拉丁生化科技股份有限公司;钨粉(W,分析纯,纯度98.5%),河北阔祥合金材料有限公司;铬酸钡(BaCrO4,分析纯,纯度99.5%),上海麦克林生化科技有限公司;丙酮(C3H6O),成都市科隆化学品有限公司;氟橡胶(FE2602),南昌萃业新材料有限公司。
场发射扫描电子显微镜(Zeiss SIGMA 300),卡尔蔡司(上海)管理有限公司;能量色散光谱(Oxford 51-XMX),牛津仪器科技(上海)有限公司;电感耦合等离子光谱发生仪(PerkinElmer NexION 300X),珀金埃尔默企业管理(上海)有限公司;差示扫描量热仪(DSC200 F3),德国耐驰热分析公司;热重分析仪(SDT-Q600) ,美国 TA仪器公司;粉末X射线衍射仪(PANalytical X′Pert Pro X),马尔文帕纳科公司。
1.2 样品制备
1.2.1 KClO4/CuO与KClO4/Cu2O的制备
按照高氯酸钾与氧化物质量比10∶1分别称取已细化后的样品,预混合后过200目筛6遍,可分别得KClO4/CuO与KClO4/Cu2O混合物样品。
1.2.2 延期药的制备
为了探究不同氧化物作为性能调节剂在钨系延期药中对延期时间的调节效果,将质量分数3%的 CuO与Cu2O引入到钨系延期药中,分别对应配方Y-1与Y-2。另外,不含有性能调节剂的配方Y-0是目前应用较为广泛的钨系延期药,在本研究中制备并作为对比例。不同配方组成列于表1。
1.2.3 各配方钨系延期药的制备
分别将钨粉、铬酸钡及高氯酸钾经机械球磨后,分别过100目筛,取筛下物作为原料;随后将配方中各组分混合后过60目筛3遍达到预混效果;将预混后的混合物加入球磨罐,在转速为75r/min的速度下运行4h;将混合物取出,将配制好的氟橡胶丙酮溶液加入,搅拌至合适黏稠度,随后在30目筛网上造粒,烘干后可得钨系延期药。
1.2.4 延期件的压制
通过模压法将不同配方的钨系延期药压至直径为4mm的延期管壳中,每个配方压制可供直接测试的延期样件5件。
1.3 钨系延期药样品表征
采用场发射扫描电子显微镜(FESEM)研究了混合物微观形貌;采用能谱仪获得能量色散光谱(EDS)数据和图谱;采用电感耦合等离子(ICP)光谱发生仪测定样品的Cu离子含量;使用差示扫描量热仪在氮气气氛下以 80mL/min的流速进行DSC实验,并且环境温度至700℃的加热速率为10.0℃/min;使用热重分析仪在氮气气氛下以100mL/min的流速进行TG/DTG实验,升温速率为10.0℃/min; 使用粉末X射线衍射仪(XRD)在40kV和40mA的CuKα辐射(λ=1.5418Å)下进行相鉴定,在室温下以0.05°的步距从5°到90°收集数据。
1.4 延期时间测试装置与原理
测试系统测试原理示意图如图1所示,整个系统由STQD2-B-00击发机构、延期时间测试装置(XD2041/XJ1)、硅光电池和输入阻抗不小于100MΩ的示波器及直流电源组成。

图1 测试原理示意图Fig.1 Schematic diagram of the test principle
调整击发机构的击发体下端面(上簧状态)到测试装置的击针上端面(安装延期管状态)间距在8~15mm,将装有被测产品的测试装置放在STQD2-B-00击发机构的击发位置,示波器处于待测状态,当击发机构的击发体撞击测试装置的击针时示波器开始计时,同时产品输入端撞击火帽受撞击作用发火并点燃产品装药;产品装药燃烧输出的光信号由硅光电池采集并转化为电信号输入到示波器,示波器终止计时,示波器所记录时间即为产品的延期时间。燃烧速率可根据延期时间以及药柱尺寸计算得到。
2 结果与讨论
2.1 形貌及结构表征
混合物KClO4/CuO与KClO4/Cu2O样品在扫描电镜下的微观形貌以及元素分布如图2所示;通过不同方法测试样品中Cu的含量,结果见表2。
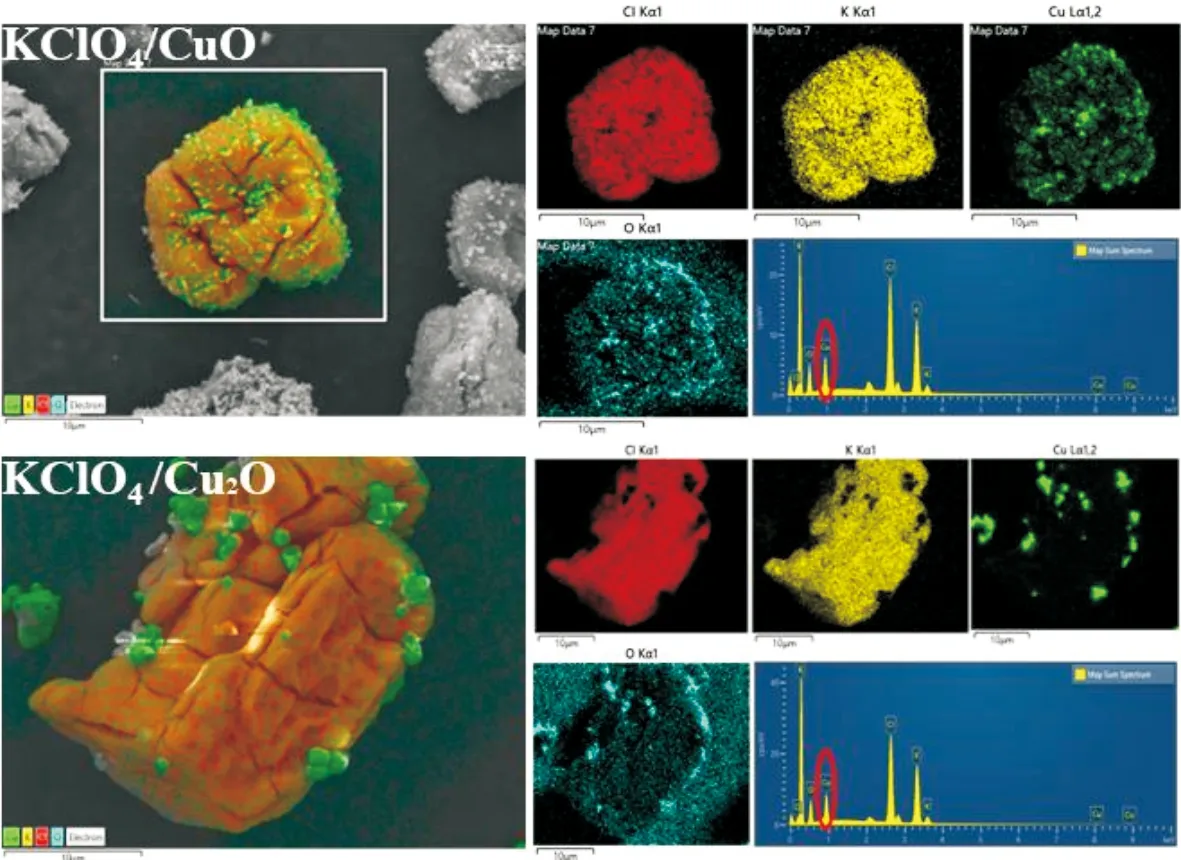
图2 混合物KClO4/CuO与KClO4/Cu2O的微观形貌、EDS和元素分析谱图Fig.2 Micromorphology, EDS and elemental analysis of the mixtures KClO4/CuO and KClO4/Cu2O
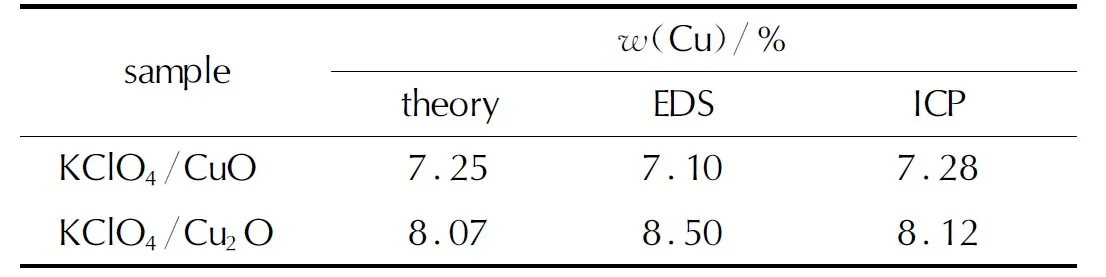
表2 不同方法测试所得混合物KClO4/CuO与KClO4/Cu2O中Cu的含量Table 2 The content of Cu in the mixtures of KClO4/CuO and KClO4/Cu2O by different test methods
CuO、Cu2O分别与高氯酸钾进行了充分混合。由图2可以看出,高氯酸钾呈块状,粒径介于10 ~20μm之间,块体表面出现的裂纹是由于扫面电镜在高放大倍数下捕捉目标时,产生的高强电压对KClO4表面造成损伤;而金属氧化物粒径均小于2μm,两者粒径相差较大。混合理想情况下,混合后金属氧化物应均匀附着于高氯酸钾表面。如混合物KClO4/CuO微观结构图所示,CuO的微观形态为无定形粉末,与大粒径的KClO4混合后,混合物中CuO均匀地附着于KClO4表面,形成了CuO层。元素分析图谱中代表氧化铜的Cu元素图谱在KClO4轮廓范围内均匀排布,KClO4表面能够形成一层均匀且致密的CuO网,而EDS谱图中Cu元素质量分数为7.10%,接近于理论质量分数7.25%。上述分析均证明了混合物中两组分混合较为均匀。Cu2O的粒径介于1~2μm,远远大于无定形CuO粉末。混合物中Cu2O粒子稀疏地附着于KClO4表面,并没有形成全面覆盖,且有部分KClO4裸露于外表面,附着于表面的多个Cu2O原子有团聚现象且较为分散。这是由于Cu2O粒径大,单个粒子质量较大导致Cu2O无法对KClO4进行全覆盖,除此之外分子量较大也会对混合产生负面影响。但混合后的Cu2O粒子在KClO4表面分布较分散且均匀,而EDS谱图中Cu元素质量分数为8.5%,与理论质量分数8.07%差异较小。
2.2 热分解机理分析
将不同价态金属铜氧化物与KClO4混合而得的KClO4/CuO、KClO4/Cu2O样品进行DSC测试,并与纯KClO4热分解行为进行对比分析,以评估不同价态金属铜氧化物CuO与Cu2O对KClO4热分解行为的影响作用。含CuO、Cu2O的KClO4的热行为曲线及原始KClO4的DSC测试结果如图3所示。
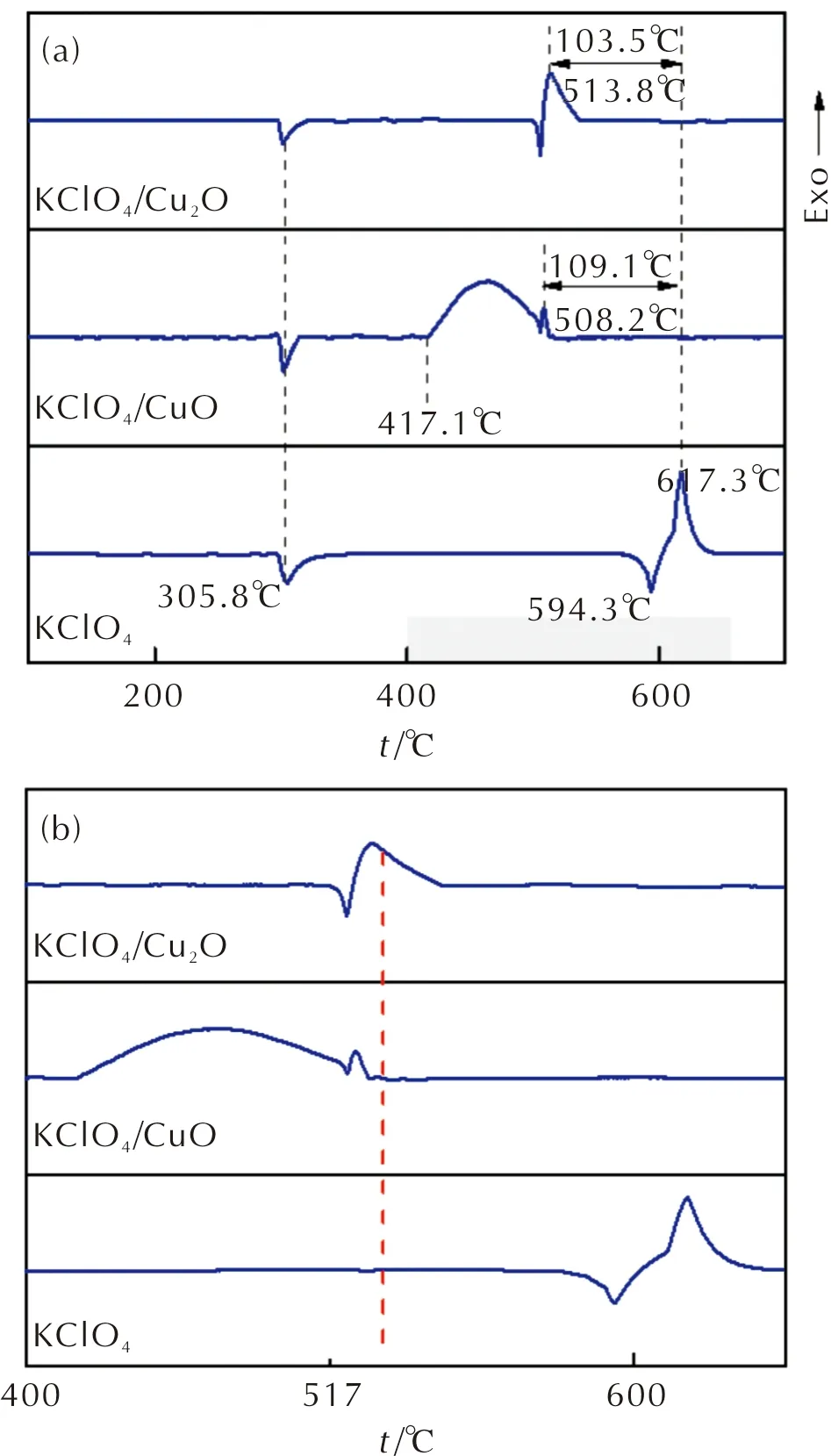
图3 KClO4、KClO4/CuO和KClO4/Cu2O样品的DSC曲线Fig.3 DSC curves of KClO4, KClO4/CuO and KClO4/Cu2O samples
由图3可知,从100到700℃温度范围内的原始KClO4热分解曲线检测到3个热行为,包括一个放热与两个吸热峰。由于在KClO4升温的过程中,从低温到高温会经历一个晶型转变,由正交晶型转变为立方晶型,且该热转变温度约为305℃。在图3(a)中,KClO4对应的热分解曲线在305.8℃时检测到样品的吸热过程,进一步证明了该结论的可靠性。转晶过程发生后对样品进一步加热,纯KClO4会在升温过程中首先经历吸热初分解过程,在该过程中,高氯酸钾会分解为氯酸钾与氧气,同时伴随有吸热现象发生。KClO4热分解曲线在594.3℃出现的吸热峰与该结论一致。随着加热过程进一步持续,初分解结束后氯酸钾会立即发生分解为氯化钾,同时会放出热量。在热分析曲线中对应剧烈的放热峰,该峰值温度Tp为617.3℃。研究认为,该分解过程主要遵循以下分解机理:(1)高氯酸钾首先吸收热量分解为氯酸钾与氧气;(2)氯酸钾进一步分解为氯化钾与氧气。其中第一步反应为速控步骤。经历了该阶段分解过程后,KClO4的主体结构将裂解为许多小分子进入环境中。
由图3(a)可知,分别将不同价态金属铜氧化物CuO、Cu2O分别与KClO4按照相同质量比[m(CuO/Cu2O)∶m(KClO4)=1∶10]混合后,KClO4/CuO与KClO4/Cu2O混合物的热分解曲线同样均在305.8℃处出现了KClO4由正交晶型转变为立方晶型的转晶热行为,这与纯KClO4所表现出的转晶热行为相一致,表明氧化物的加入不会对KClO4的转晶行为产生任何影响。纯KClO4在高温处的放热分解过程在混合物中仍表现非常明显。对于混合物KClO4/CuO,其DSC曲线在高温处表现为两个明显的放热阶段:第一阶段为起始温度为417.1℃的放热分解峰,第二阶段为峰值温度为508.2℃的放热分解过程。第一阶段的分解过程峰面积较大、持续时间较长,说明该阶段放热过程为持续缓慢放热,且放热量较大。该阶段可能是由于+2价Cu离子的存在,高氯酸钾与二价铜离子反应生成次氯酸铜,随后的放热过程归结为次氯酸铜的放热分解过程。由于次氯酸铜分解过程放热量较大,导致纯KClO4中吸热溶解峰与该阶段放热峰相互传热,形成自供热过程,因此,混合物KClO4/CuO的热分解过程未表现出吸热溶解过程。第二阶段的放热分解过程表现为一个较为尖锐的小峰,峰值温度为508.2℃,峰形与纯KClO4热分解过程中第二阶段放热峰基本一致,且该阶段过后并无任何热行为,由此判定该放热分解过程对应于纯KClO4中峰值温度为617.3的热分解过程。与纯KClO4相比,KClO4/CuO混合物中的峰值温度降低了109.1℃。可以发现,将CuO加入到KClO4中,对于材料放热分解过程中峰值温度降低有巨大的促进作用,CuO的加入能够使得KClO4在较低温度时开始其化学行为过程,对药剂有较强的催化分解作用。
混合物KClO4/Cu2O的热分解曲线表现出与纯KClO4相一致的热分解行为,在高温阶段均表现出先吸热溶解,随后分解放热两个热行为阶段。对于混合物KClO4/Cu2O,其该放热的热分解行为过程峰值温度为513.8℃。与纯KClO4相比,KClO4/Cu2O混合物系统中的峰值温度Tp降低了103.5℃。可以发现,将Cu2O加入到KClO4中,对于放热分解过程中峰值温度降低程度有一定的促进作用。考虑到KClO4/CuO体系中首先进行的是+2价的铜离子与高氯酸根离子反应生成次氯酸铜的过程,而+1价的铜离子未能与高氯酸根进行反应,因此两体系热分解行为出现了较大差异。相比于CuO,Cu2O对KClO4的燃烧催化作用较弱。
KClO4、KClO4/CuO以及KClO4/Cu2O样品在100~700℃升温过程中的失重情况如图4所示。

图4 KClO4、KClO4/CuO和KClO4/Cu2O样品的TG-DTG曲线Fig.4 TG-DTG curves of KClO4, KClO4/CuO and KClO4/Cu2O samples
由图4可知,随着热分解的进行,纯KClO4的样品在575.3~646.5℃有明显的失重过程,失重量为48.7%,按热分析升温速率为10℃/min计算,其失重过程约经历7.1min;KClO4/CuO混合物在加热过程中也出现一个失重阶段,出现在417.1~516.2℃范围内,失重量为39.2%,按热分析升温速率为10℃/min计算,其失重过程约经历9.9min;KClO4/Cu2O样品在499.2~536.7℃有明显的失重过程,失重量为38.7%,按热分析升温速率为10℃/min计算,其失重过程约经历3.7min。对比分析发现,相比于加入氧化物的样品,纯KClO4在加热过程中出现最大的失重量,达到48.7%。考虑到含有金属氧化物的样品在热分解过程中,金属氧化物不会随着有机物进行分解放热,分解后期依然会以金属单质或氧化物形式残留于体系中,因此纯KClO4的失重量高于其他含氧化物体系。KClO4/CuO与KClO4/Cu2O样品失重量分别为39.2%与38.7%。这是由于两者样品高温分解后,其中的CuO与Cu2O均会以CuO的形式存在于体系中,而Cu2O被氧化为CuO的过程中会额外存在固氧过程,导致失重量降低。对比研究发现,各体系失重过程的起始、终止温度与样品DSC热分解曲线分解过程基本一致。不同体系样品失重过程所经历的时间发现,KClO4/Cu2O样品失重过程进行地较快,而KClO4/CuO样品为缓慢失重过程。这是由于KClO4/CuO样品DSC曲线中出现了其他不同于纯KClO4的热分解反应过程,这与图3不同体系样品热分解过程基本一致。
由图3(b)可知,温度升至517℃时,纯KClO4样品未开始分解过程,KClO4/Cu2O样品的热行为已开始进行但未结束,而KClO4/CuO样品已完全结束了其热分解过程。为了探究不同价态铜氧化物在KClO4分解过程中的作用方式以及热分解机理,选定517℃为特征温度点,对该特征温度点下各样品组成进行了表征。将KClO4、KClO4/CuO以及KClO4/Cu2O样品按照热分解过程条件,以10℃/min的升温速率分别加热至517℃并保持至反应完成,将不同样品的分解产物提取并进行粉末X射线衍射试验。
纯KClO4的X射线衍射谱图如图5所示。
对仿真后获得的光照度数据进行处理,可得到三角形LED阵列的照度均匀度分别为74.7%、83.3%和77.3%,这一结果表明粒子群算法对三角形LED阵列优化后的均匀度较高,可提高6.0%~8.6%。

图5 KClO4样品加热至517℃时的XRD谱图Fig.5 XRD patterns of KClO4 sample heated to 517℃
由图5可知,XRD谱图中衍射峰的高信噪比表明KClO4具有良好的结晶度。在该谱图中,分别在15.78°、19.85°、24.50°、25.52°、26.51°、28.4°、30.92°以及31.58°具有较强的衍射信号,这些特征信号峰与高氯酸钾的标准卡片No.07-0211特征信号一一对应,因此可以将谱图中的特征峰均归因于高氯酸钾。基于上述分析,纯的高氯酸钾在经过升温至517℃时,其物质本身未发生分解,这与其热分行为曲线结论保持一致。
将KClO4/CuO样品加热至517℃时样品的X射线衍射谱图如图6所示。

图6 KClO4/CuO样品加热至517℃时的XRD谱图Fig.6 XRD patterns of KClO4/CuO sample heated to 517℃
由图6可知,分别在28.32°、35.51°、38.72°、40.51°、48.72°、50.16°、58.26°、61.52°、66.22°、74.96°以及87.68°具有较强的衍射信号,衍射峰的高信噪比表明经热分解后样品具有较好的结晶度。其中在35.51°、38.72°、48.72°、61.52°以及74.96°特征信号与氧化铜(CuO)的标准卡片No.48-1548特征信号一一对应,因此可以将谱图中上述特征峰均归因于氧化铜。谱图中在28.32°、40.51°、50.16°、58.26°、66.22°、74.96°以及87.68°出现的较强特征峰与氯化钾标准卡片No.41-1476完全吻合。基于上述分析,将KClO4/CuO样品加热至517℃时,高氯酸钾已完全分解为氯化钾,残留样品为氯化钾与氧化铜的混合物,并未含有其他杂质,这与KClO4/CuO样品热行为结果一致。因此进一步证明,氧化铜作为性能调节剂时,高氯酸钾经过一系列热行为后最终分解为氯化钾与氧气,而氧化铜在分解过程中作为催化剂参与反应,最终产物为氧化铜与氯化钾的混合物。
KClO4/Cu2O样品加热至517℃时样品的X射线衍射谱图如图7所示。

图7 KClO4/Cu2O样品加热至517℃时的XRD谱图Fig.7 XRD patterns of KClO4/Cu2O sample heated to 517℃
由图7可知,该谱图中既存在有对应于高氯酸钾特征信号的特征峰[图7(c),JCPD NO.07-0211],也有对应于氯化钾特征信号的特征峰[图7(d),JCPD NO.41-1476]。这表明在517℃时KClO4/Cu2O样品中部分高氯酸钾在Cu2O的作用下发生分解,形成了氯化钾与氧气。但也存在未参与热分解反应的高氯酸钾残余在混合样品中。为了分析添加剂氧化亚铜在高氯酸钾分解过程中扮演的重要作用,分析了铜氧化物在混合物中的存在形式。由图7(a)与图7(b)可知,在KClO4/Cu2O样品加热至517℃时的残余物图谱中分别发现了代表氧化铜与氧化亚铜的特征峰,分别与标准卡片No.05-0667以及No.48-1548的特征信号完全一致,因此这进一步表明,在KClO4/Cu2O样品加热分解过程中氧化铜会随着反应进行转化为氧化铜,并最终以氧化铜的形式存在于体系中,这与KClO4/Cu2O样品的热分解行为结论一致。
2.3 延期时间及燃烧性能分析
为了探究不同价态铜氧化物作为性能调节剂在钨系延期药中对延期时间的调节效果,依据表1配方制备了含不同价态铜氧化物的延期药并进行了延期性能测试实验。

表3 不同延期药配方延期性能以及燃速参数Table 3 The delay performance and burning rate data of different delay compositions
由图8(a)可知,3种延期药配方的延期时间分布曲线平稳度较好,表明不同配方5组平行样品的延期时间一致性较好。配方Y-0的5组平行样品延期时间均长于添加有金属氧化物的延期药配方。相比于Y-0,添加有金属氧化物的延期药配方的延期时间均有不同程度的缩短,其中添加有金属氧化物CuO的配方Y-1的延期时间下降最明显,配方Y-2的延期时间降低幅度较低。结合各配方样品的压药尺寸得以计算出其燃烧速率。由图8(b)可知,配方Y-0的燃烧速率曲线运行并不平稳,表明其燃烧过程并不稳定。反观添加有金属氧化物的配方Y-1与Y-2的燃烧速率曲线,燃烧速率均保持平稳,燃烧稳定性较好。相比于配方Y-0,添加有CuO的配方Y-1的燃烧速率提高最为明显,配方Y-2次于Y-1。结合KClO4、 KClO4/CuO以及KClO4/Cu2O样品的热分解曲线分析结论可知,添加有金属氧化物的配方Y-1与Y-2的燃烧速率与混合物热分解过程表现出一致的催化作用规律。
3 结 论
(1)不同价态铜金属氧化物分别与高氯酸钾进行了充分均匀混合,其对氧化剂KClO4热分解过程均有促进作用,CuO的促进效果优于Cu2O。
(2)分别添加有金属氧化物CuO、Cu2O的配方Y-1与Y-2的燃烧速率与混合物热分解过程表现出一致的燃烧催化作用规律,燃烧催化效果Y-1优于Y-2,燃烧稳定性Y-1优于 Y-2。
(3)金属氧化物的添加能够加速氧化剂KClO4的热分解过程,从而对含KClO4的钨系延期药的燃烧性能产生积极作用。考虑到添加有CuO的延期药体系中首先进行的是高价Cu2+与高氯酸根离子反应生成次氯酸铜的过程,次氯酸铜高的放热量与纯KClO4中初分解吸热过程形成自供热过程,加快了延期药的快速燃烧与分解,而Cu+由于氧化性较弱未能与高氯酸根进行反应。因此相比于CuO,Cu2O对钨系延期药的燃烧催化作用较弱。

