PTFE对Mg与Al12Mg17微爆反应特性的影响
谢 晓,李海建,张 言,仪建华,许 毅,赵凤起
(西安近代化学研究所 含能材料全国重点实验室,陕西 西安 710065)
引 言
镁及Al12Mg17具有能量密度高、点火温度低、燃烧稳定、燃烧效率高、价格便宜等优点,是性能优异的金属燃料[1-3]。将其与聚四氟乙烯(PTFE)混合后,其燃烧过程中可以释放大量的热并产生很强的红外辐射,因此在红外诱饵剂、燃烧剂等特种药剂中得到广泛使用[4-6]。林长津等[7]研究了Mg/PTFE基烟火药的燃烧性能与光辐射特性,对其固相反应机理进行了分析,获得了其燃烧过程中Mg转化为MgF2的转化机制与PTFE分解路径。WANG Lei等[8]对Mg/PTFE红外诱饵剂辐射性能进行了研究,发现当镁颗粒增大时,诱饵剂红外辐射强度增加。Trung等[9]对镁铝合金取代镁单质后配方的燃烧与红外辐射性能进行了研究,发现镁铝合金或PTFE的粒度对其性能有着明显影响,当选择合适的粒度级配后,可以获得较高的燃速和较强的红外辐射。研究表明,镁及Al12Mg17在燃烧过程中可能会发生“微爆燃烧”[10-12],而利用金属燃料的微爆燃烧来增加燃料的雾化性能以及提高含能材料的燃烧性能是一条有效途径。Gabriel[11]和Ao[13]等发现金属的微爆燃烧可以有效提高其燃速,增加释能效率。Terry等[14]也证明了推进剂中金属燃料的微爆燃烧可以改善推进剂的释能效率和增加推进剂燃速。
对于金属燃料的微爆燃烧,人们提出了几种可能的机理:对于沸点差异较大的合金,低沸点相的气化在液滴表面形成一层扩散层,当液滴温度上升,扩散层到达过热极限。此时,颗粒内部发生低沸点相的气相成核(产生气泡),内部压力增大最终超过扩散层的限制,导致了微爆[14-15];对于高沸点合金,在一个金属相发生气相燃烧的同时,另一个金属相会和空气中的氮气发生多相反应,但是当气相燃烧减弱之后,空气中的氧气会取代多相反应生成氮化物中的氮,而析出的氮气是颗粒发生微爆的主要原因[16]。
尽管微爆燃烧在金属燃料的释能过程中起到不可忽视的作用,但由于研究时间较短,相关的研究还比较少,特别是在氧化剂对金属微爆燃烧的影响方面,还缺乏深入的研究。基于此,本研究对Mg及Al12Mg17两种金属燃料与聚四氟乙烯(PTFE)反应过程中所观察到的微爆燃烧现象进行分析,探索氧化剂对金属燃料微爆燃烧特性的影响机制,以期为含能材料的高效释能提供实验依据,并促进火炸药、烟火药和推进剂的进一步发展。
1 实 验
1.1 原料与仪器
镁粉、Al12Mg17粉末,铭威志镁有限公司,两种样品均采用雾化成型工艺制备,其中镁粉纯度大于99.9%,Al12Mg17纯度大于99%;PTFE,天津希恩思奥普德科技有限公司,纯度大于99%,平均粒径(25±5)μm。
Quanta 400 FEG 型扫描电子显微镜(SEM),美国FEI公司;TG/DSC 3+热重-差示扫描量热仪,瑞士梅特勒-托利多公司;Mastersizer 2000激光粒度仪,英国马尔文仪器公司; HFCW-100型激光器,北京大族天成半导体有限公司;PCO.DIMAX HS2型高速摄像仪,德国PCO公司;FC4-UVIR400-2-ME型光谱仪,北京爱万提斯科技有限公司。
1.2 实验方法
实验前,对金属粉末与PTFE进行机械混合处理,其中镁与PTFE混合粉末中两者的质量分数为70%镁,30%PTFE;Al12Mg17与PTFE混合粉末中两者的质量分数为60%Al12Mg17,40%PTFE。样品的燃烧特性分析在自制的燃烧系统中进行。实验过程中,将样品置于样品台上,使用激光器(功率85W)对样品进行加热与点火,并使用高速显微摄像仪与光谱仪记录样品燃烧过程与光谱辐射特性。为更好地分析样品颗粒在加热与燃烧过程中的表界面反应特性,高速显微摄像机记录过程中尽量聚焦于单个金属颗粒。
1.3 结构表征与性能测试
粒度测试:采用马尔文激光粒度仪对样品粒度进行测试分析,以水作为分散介质。
形貌表征:采用扫描电子显微镜对样品的微观形貌进行观察,并使用Mapping对样品表面元素分布进行扫描。
氧化特性分析:采用热重-差示扫描量热仪(TG-DSC)对样品的氧化特性进行分析,反应气氛为空气,实验中使用Al2O3坩埚,升温速率为10℃/min,使用的样品质量约为1mg。
相组成分析:采用X射线衍射仪(XRD)对样品相组成进行分析,测试条件为:电压40kV,电流30mA,扫描速率10°/min。
2 结果与讨论
2.1 原料性质
原料的XRD谱图如图1所示,两种原料中分别只观测到Mg和Al12Mg17相的衍射峰,说明原料纯度较高,只由单相组成。使用SEM-Mapping对原料镁以及Al12Mg17粉末的形貌、结构以及元素分布进行观察,其结果如图2所示。从图2(a)和(b)中可以看出,二者的微观形貌相近,均为近球形,部分大颗粒表面附着有较小的颗粒。对于Al12Mg17粉末,所观察到的颗粒中均检测到了镁元素与铝元素,说明合成过程中,加入的单质镁和单质铝均匀地结合在一起,以Al12Mg17相的形式存在。同时,在两种样品中均检测到了氧元素的存在,这是金属颗粒在生产、运输、储存过程中表面发生氧化所造成的,这种氧化会导致样品中活性成分的降低,还会造成样品起始反应温度上升,燃烧状态发生改变[17]。目前,金属燃料的一个重要研究方向便是如何防止颗粒表面的氧化[18]。两种金属原料的粒度分布如图2(c)所示,其中镁的中位径为107.5μm,Al12Mg17的中位径为92.4μm。
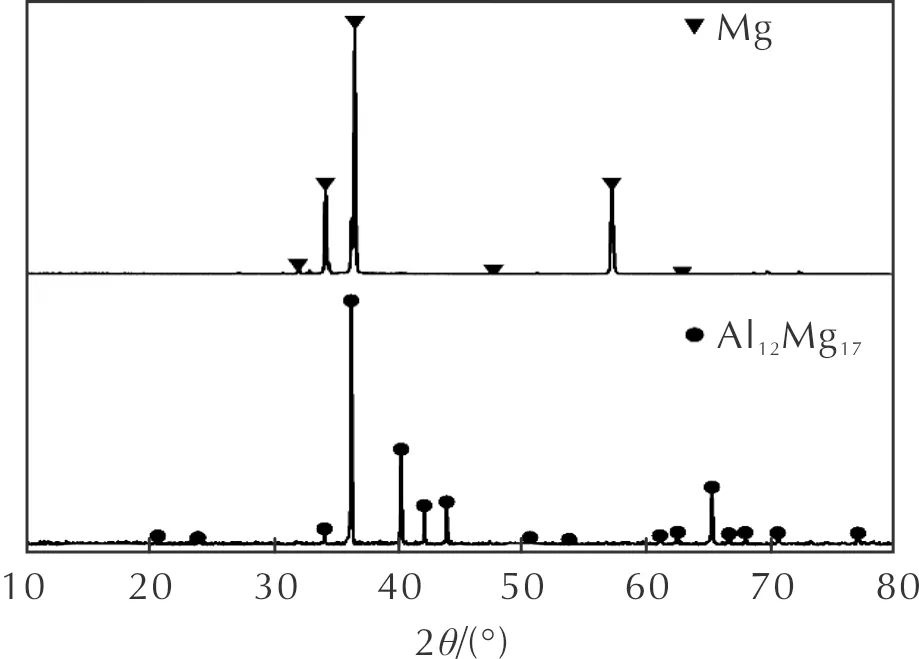
图1 原料的XRD谱图Fig.1 XRD patterns of the raw Mg and Al12Mg17 powders

图2 原料Mg及Al12Mg17的形貌、结构和元素分布特性Fig.2 Microstructure and element distribution of the raw Mg and Al12Mg17 powders
两种原料与PTFE混合后混合物的SEM图如图3所示。从图3可以看出,金属颗粒与PTFE颗粒均匀的混合在一起,没有形成包覆结构。

图3 金属原料与PTFE混合后的SEM图Fig.3 SEM images of the Mg/PTFE and the Al12Mg17/PTFE powder mixture
2.2 氧化特性
镁和Al12Mg17粉末在空气中加热时的TG-DSC曲线如图4所示。从图4中可以看出,镁在613.5℃左右开始反应,反应放出热量并伴随着质量增加。Al12Mg17在空气中的反应可以分为两个阶段:第一个阶段主要为镁的氧化;第二个阶段主要为铝的氧化以及MgAl2O4的形成[19]。从Al12Mg17的TG-DSC曲线可知,其第一阶段镁的起始反应温度约为510.9℃,对应的放热峰温约为527.7℃。

图4 Mg及Al12Mg17在空气中的TG-DSC曲线Fig.4 TG-DSC curves of the Mg and Al12Mg17 powders in air
两种混合粉末在空气中加热时的TG-DSC曲线如图5所示。从图5中可以看出,Mg/PTFE混合粉末的反应大致可以分为两个阶段:第一个阶段是发生在554.4℃左右的一个失重放热过程。研究表明[7, 20-21],PTFE在空气中加热时,其在500~600℃之间会发生分解,分解过程放热,并释放出C2F4单体、CO2、COF2等气体产物;当PTFE在惰性气体下加热时,由于没有氧气等参与其分解反应,因此,其分解过程吸热,且产物主要为C2F4单体。样品在这个阶段失重29.7%,接近混合物中PTFE的含量。第二个阶段发生在896.8℃以上,样品的DSC曲线上观察到一系列剧烈的放热峰,对应的TG曲线上出现了质量增加。当样品加热到320.1℃和647.6℃时,样品的DSC曲线上出现吸热峰,对应的TG曲线上没有观察到明显的质量变化。前者应该是PTFE融化吸热导致的,后者则是样品中剩余的Mg熔化吸热导致,这表明在第一阶段的PTFE分解过程中,镁并没有大量地转化为MgF2,而仍是以单质形式存在。因此Mg/PTFE混合粉末在第二阶段的质量增加是样品中剩余的镁与空气中的氧气反应生成氧化镁所导致的。
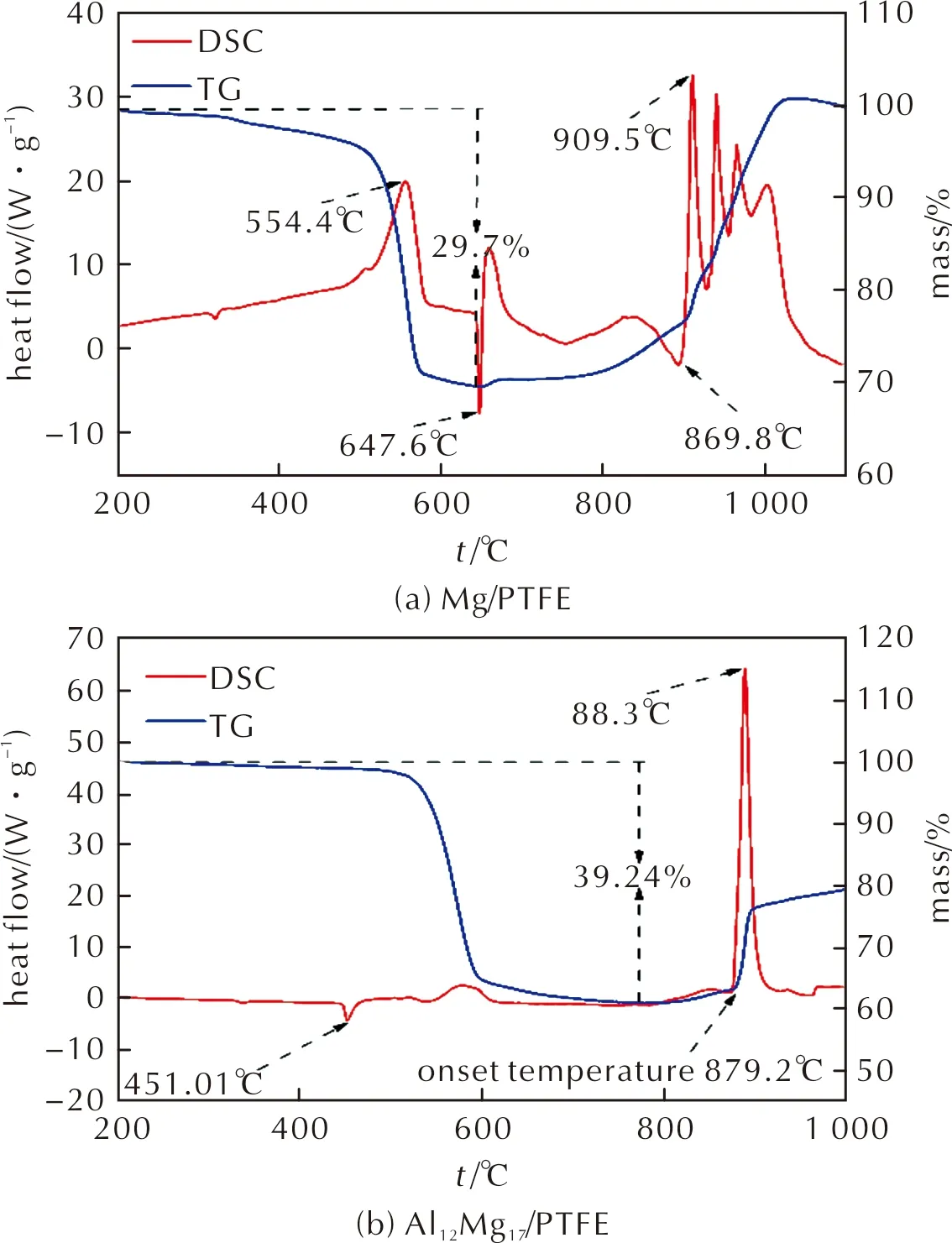
图5 两种混合样品在空气中的TG-DSC曲线Fig.5 TG-DSC curves of Mg/PTFE and Al12Mg17/PTFE powder mixture in air
同样两阶段的反应过程可以在Al12Mg17/PTFE混合粉末中被观察到,其中第一阶段的反应发生在579.9℃左右,样品失重约39.24%。第二阶段的起始温度约为819.2℃左右,反应剧烈放热并伴随着质量增加,DSC曲线上放热峰峰温约为888.3℃。在451.01℃左右观察到吸热峰,对应Al12Mg17的熔化[19, 22]。和Mg/PTFE相比,Al12Mg17/PTFE粉末第一阶段反应后移,反应起始温度有所上升,而第二阶段反应提前,反应起始温度下降。尽管Al12Mg17/PTFE粉末在579.9℃左右就已经观察到了反应,但此时的反应似乎只涉及PTFE的分解(该阶段失重39.24%,接近混合粉末中PTFE的质量分数),不涉及Al12Mg17与PTFE的反应。然而可以确定的是,即使不存在明显的反应过程,但PTFE的分解必将对Al12Mg17颗粒的表面性质产生影响。因为对于纯Al12Mg17粉末而言,在空气中加热时,在 600℃以前基体中的镁便已经发生氧化并产生单质Al,而在800℃左右有MgAl2O4的生成。而对于Al12Mg17/PTFE粉末,在600~800℃之间并没有观测到由于单质镁或单质铝熔化所导致的吸热峰的存在,说明此时样品中的镁、铝仍以Al12Mg17的形式存在,且为液体。而此时阻碍液态Al12Mg17发生反应的原因可能是由于PTFE的分解改变了Al12Mg17颗粒表层的性质,从而使得外界的氧气无法与层内的金属液发生反应。而当温度上升到888.3℃后,剧烈的放热反应伴随着明显的质量增加表明层内的金属液向外扩散,并被空气中的氧气所氧化。
2.3 燃烧特性
典型单质镁、Al12Mg17颗粒燃烧过程如图6所示。

图6 Mg及Al12Mg17在空气中的典型燃烧过程Fig.6 Typical combustion process of Mg and Al12Mg17 particles in air
由图6可知,二者展现了极大的不同。对于Al12Mg17而言,其最明显的特征为颗粒从样品台的飞散以及包裹在颗粒周围的气相火焰区。气态金属的喷射是导致颗粒飞散的原因,而气体的多点不均匀扩散导致了其在飞散过程中粒子发生旋转,这种旋转作用形成了如图6(a)所示的包覆火焰,微爆燃烧在Al12Mg17颗粒的燃烧过程中被观察到,部分微爆发生在观察到明显的气相燃烧前,剩余部分则是在颗粒经历过一段时间的气相燃烧后发生了微爆;对于镁而言,明亮的气相“火焰帽”在其燃烧过程中被观察到(0ms),气相燃烧产生的MgO在火焰区凝结并掉落回样品台,部分氧化产物由于冷凝点的形成会在颗粒表面形成“树枝状”氧化物(19.79~32.95ms)。“火焰帽”的形成说明镁蒸汽的扩散是从颗粒表面均匀向外,即扩散并非点状扩散而是面扩散。在燃烧后期,还观察到了燃烧从气相反应区向颗粒扩散的过程。除此之外,对于两种金属颗粒,在它们的燃烧过程中,颗粒表面的包覆层均处于固态,这是由于颗粒在被加热到点火前,表面已经发生了一定程度的氧化所导致的。同时,固态包覆层对Al12Mg17颗粒的微爆起着关键的作用,正是由于包覆层阻碍了层内气态金属的扩散,使得颗粒内部压力增大,导致了微爆。而对于镁颗粒,表面疏松多孔的氧化层无法形成有效包覆,因此观察不到颗粒的微爆。
Mg/PTFE粉末和Al12Mg17/PTFE混合样品在空气中的燃烧过程如图7和图8所示。
由图7可知,在观察到明显的气相火焰前,样品经历了一段较长时间的加热过程。此时,样品周围的PTFE粉末受热融化、分解,在该过程中,没有观察到镁颗粒明显的变化过程,其尺寸、形貌基本没有发生改变。当加热到一定温度后,颗粒表面出现裂缝,气态镁从这些裂缝中喷射而出,形成气相火焰。与纯镁的燃烧过程不同,气相火焰并不是在颗粒周围形成“火焰帽”,而是在裂缝处形成喷射型火焰,这种现象说明颗粒内部的镁蒸气处于高压状态,相比于单质镁,Mg/PTFE的燃烧显然更为剧烈。高温下镁蒸气的产生量大于从裂缝处喷射的镁蒸气的量,从而会导致颗粒内部压力不断升高,颗粒的微爆在这种情况下被观察到(8.4ms)。微爆使得镁的燃烧区极速增大,并在极短的时间内燃烧完全。同时,微爆还使得颗粒内部的镁液滴分散成为更小的液滴(10.4ms)。其燃烧时的光谱辐射曲线如图9所示,在490~505nm之间观察到的五指峰来源于MgO的分子辐射,在517nm和518nm处观察到的辐射峰则来源于Mg的原子辐射。同时,在347、357以及366nm附近观察到的三指辐射峰则来源于镁与PTFE反应时的特征辐射峰。除此之外,在586、768和770nm处同样观察到3个特征辐射峰,前者来源于环境中的钠,后两者则来源于环境中的钾。由图8可知,Al12Mg17/PTFE的燃烧不再形成包裹住整个颗粒的气相火焰,燃烧以更为剧烈的方式进行。
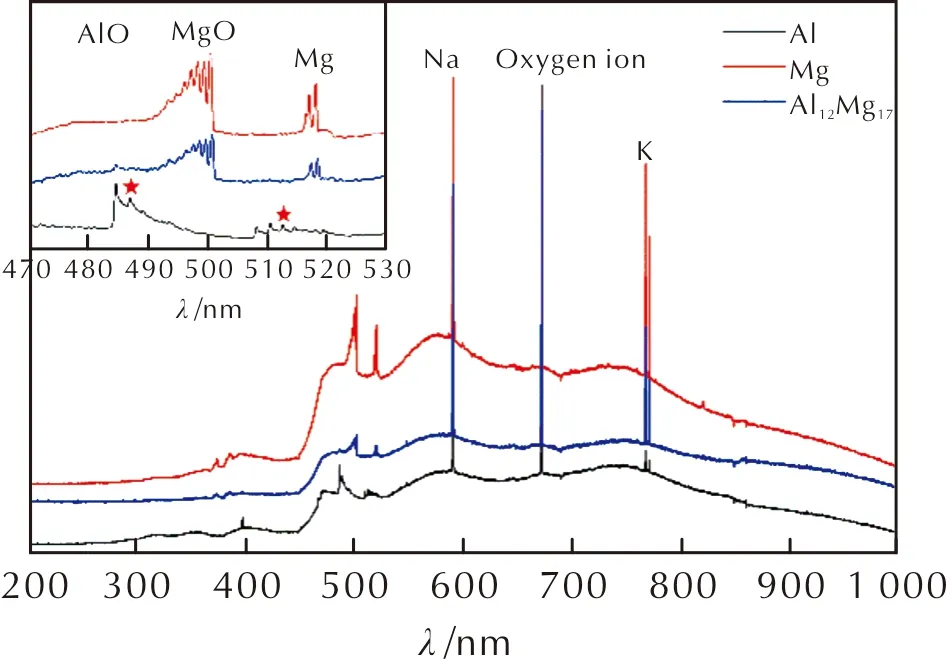
图9 三种原料在空气中燃烧时的光谱辐射曲线Fig.9 Spectrum radiation curves of Mg, Al and Al12Mg17 particle
由图9可见,在加热过程中,首先能看到颗粒表面附着的PTFE发生熔化、分解,此时Al12Mg17颗粒的形貌并没有明显改变。在经过一段较长的加热时间之后,气相燃烧被观察到。根据图5所示,PTFE会导致Al12Mg17样品的起始反应温度上升368.3℃左右,因此需要更长的加热时间才能点燃PTFE/Al12Mg17样品。经过上述分析可知,在PTFE分解时,Al12Mg17颗粒表面性质发生了改变,这种改变使得样品在燃烧过程中,颗粒表面包覆层会阻碍层内金属蒸气的扩散,只有少量气态金属可以从包覆层裂缝处向外扩散与周围气体发生反应(0ms)。燃烧产生的热量促使金属加速气化,在经过一段时间的孕育之后,颗粒发生剧烈微爆。对于大多数颗粒而言,颗粒首先发生微爆,微爆释放出包覆层内的气态金属,才观测到了明亮的气相燃烧,并没有观察到微爆孕育期(0~5.7ms),这种微爆形式是由于激光器连续加热使得包覆层内金属核不断气化所导致的。因此,相比于原始Al12Mg17颗粒,PTFE的加入使得颗粒表面包覆层变得更加致密与坚固,更有利于Al12Mg17颗粒的微爆燃烧。其燃烧时的光谱辐射曲线如图10所示,在586、768和770nm处存在Na与K的特征辐射峰。在470~530nm之间,不仅观察到了来自MgO和Mg的特征辐射,还观察到了Al燃烧时的特征辐射,一般而言,铝的气相燃烧会产生AlO,并在417、486和512nm处存在特征辐射峰[13]。这表明PTFE的加入不但有利于Al12Mg17的微爆燃烧,还能促进基体中Al的燃烧。

图10 两种混合样品在空气中燃烧时的光谱辐射曲线Fig.10 Spectrum radiation curves of Mg/PTFE and Al12Mg17/PTFE particle mixture
Mg/PTFE与Al12Mg17/PTFE的燃烧产物的XRD谱图如图11所示,相组成如图12所示。

图11 燃烧产物的XRD谱图Fig.11 XRD patterns of the combustion products

图12 燃烧产物的SEM图Fig.12 SEM images of the combustion products
对于Mg/PTFE,其燃烧产物中主要检测到MgF2、MgO和未完全反应的Mg单质;对于Al12Mg17/PTFE,其燃烧产物中主要包含MgF2、MgO、Al单质和Mg单质,这进一步说明Al12Mg17与PTFE的反应过程中,PTFE优先与其中的镁发生反应生成MgF2。同时,空气中的氧气也会参与镁的氧化。燃烧产物的XRD曲线中没有观察到Al2O3,而图10的光谱辐射曲线中检测到了铝的氧化特征峰,这可能是由于生成的Al2O3为非晶体所造成的。从燃烧产物的SEM图可以看出,单质镁的燃烧主要生成四方体形MgO,Al12Mg17的燃烧除了四方体形MgO外,还观察到许多不规则形状颗粒。在Al12Mg17/PTFE燃烧产物中还观察到了八面体形晶体,说明其燃烧过程中产物的结晶过程发生了改变,这可能是造成金属产生更剧烈微爆燃烧的原因。
3 结 论
(1)当在空气中加热时,镁的起始反应温度约为613.5℃,Al12Mg17的起始反应温度约为510.9℃。加入PTFE后,二者在空气中的起始反应温度分别增加了283.3℃和368.3℃。
(2)Mg在空气中燃烧时,由于表面氧化层无法对镁蒸气的扩散形成有效阻碍,因此基本观察不到颗粒的微爆燃烧,向外扩散的镁蒸气与空气中的氧气发生气相燃烧,在颗粒表面形成“火焰帽”。
(3)Al12Mg17在燃烧前,会在颗粒表面形成氧化层以限制层内气态金属的扩散。氧化层的破碎使得气态金属以多点扩散的方式向外喷出,并在颗粒周围形成包覆火焰,镁的燃烧是Al12Mg17气相燃烧区中主要的反应过程。
(4)PTFE分解时会使Mg和Al12Mg17颗粒表面包覆层变得更加致密与坚固,从而能更有效地限制层内气态金属的扩散,使得Mg或Al12Mg17微爆反应更为剧烈,同时还有助于Al12Mg17中铝的燃烧。

