单、双二茂铁基三氮唑化合物的合成和热稳定性及对AP的催化分解
侯雅慧,韦雄雄,黄世琪,常 帅,赵娅莉,苟小锋,赵军龙
(1.西北大学 化学与材料科学学院,陕西 西安 710127;2.西安航洁化工科技有限责任公司,陕西 西安 710100;3.西北大学 物理学院,陕西 西安 710127;4. 西北大学 医学院,陕西 西安 710069)
引 言
固体推进剂是火箭、导弹以及各种空间飞行器稳定的动力源[1],大多数固体推进剂由金属燃料、固化剂、速率调节剂、催化剂、氧化剂等物质复合而成。高氯酸铵(AP)是固体推进剂中常用的氧化剂(通常占复合推进剂质量分数的60%~90%),其热分解性能对推进剂的燃烧过程有很大的影响[2-4]。二茂铁衍生物被认为是一种广泛适用的有机金属化合物,尤其是在火箭固体推进剂的燃烧催化方面,由于其高效的燃烧催化活性、广泛的燃烧调节范围等优势而备受关注。研究表明二茂铁基化合物具有不可逆的氧化还原性和较高的热稳定性,能够提高燃烧速率以及降低推进剂压力指数,其在分解过程中释放出具有高活性、高催化的Fe2O3[5-7],对AP的热分解有催化作用。含氮杂环化合物本身是含能物质,具有高热量、高密度、良好的稳定性等优势。若将二茂铁基团与唑类化合物通过C—N键结合,构筑二茂铁基含氮化合物,既可以提高基于AP的催化效果,同时可以解决易迁移和易挥发问题。因此,二茂铁基含氮化合物是近年来研究的热点之一[8-12]。
本研究以三氮唑和二茂铁化合物反应合成单、双二茂铁基三氮唑化合物,测试其抗氧化性、热稳定性及对AP的催化性能,以期能够获得综合性能良好的新型二茂铁基燃烧速率催化剂。
1 实 验
1.1 试剂及仪器
二茂铁甲醛、二茂铁甲酸、3-氨基-1,2,4-三氮唑、4-氨基-1,2,4-三氮唑,北京百灵威科技有限公司;3,5-二氨基-1,2,4-三氮唑,湖北汉威化工有限公司;三乙胺,广东省化学试剂工程技术研究开发中心。
Burker Ascend-400MHz 核磁共振波谱仪、X-射线单晶面探仪、Bruker Tensor 27 FT-IR 光谱仪,德国Burker公司;N5000型紫外、可见分光光度计,上海佑科仪器仪表有限公司;SDT-Q600同步热分析仪,美国TA仪器公司,试样质量1.3mg,与AP以质量比1∶3均匀混合研磨,氮气保护下升温速率为10℃/min。DSC 404F3型差示扫描量热仪,耐驰科学仪器商贸(上海)有限公司,试样质量2.3mg,氮气保护下升温速率为10℃/min,测试温度为50~600℃。
1.2 化合物制备
1.2.1 二茂铁甲酰氯的制备
在50mL圆底烧瓶中加入二茂铁甲酸(6mmol, 1.38g),加入25mL二氯甲烷,再滴加3滴N,N-二甲基甲酰胺(DMF)作为催化剂。在冰浴条件下,向其中滴加草酰氯(48mmol, 4.06mL),30min内滴完。滴加结束后进行常温搅拌,TLC监测反应,4h后反应完全,减压旋干。用50℃的正己烷进行重结晶,真空干燥24h,产率约为68%[13-14]。反应式见图1。

图1 二茂铁甲酰氯的制备Fig.1 Preparation of ferrocene formyl chloride
1.2.2 单核二茂铁基三氮唑化合物的制备
在50mL圆底烧瓶中加入3-氨基-1,2,4-三氮唑(1mmol, 0.084g),加入30mL二氯甲烷,搅拌下滴加三乙胺(1mmol, 0.14mL),3min后加入二茂铁甲酰氯(1mmol, 0.248g),TLC监测反应,待反应结束后,柱色谱分离提纯,真空干燥24h,得到目标化合物A1,反应式见图2。化合物A2~A4的合成方法与A1类似,原料及产物见图3。

图2 单核二茂铁基三氮唑化合物的制备Fig.2 Preparation of mononuclear ferrocenyl triazole compound
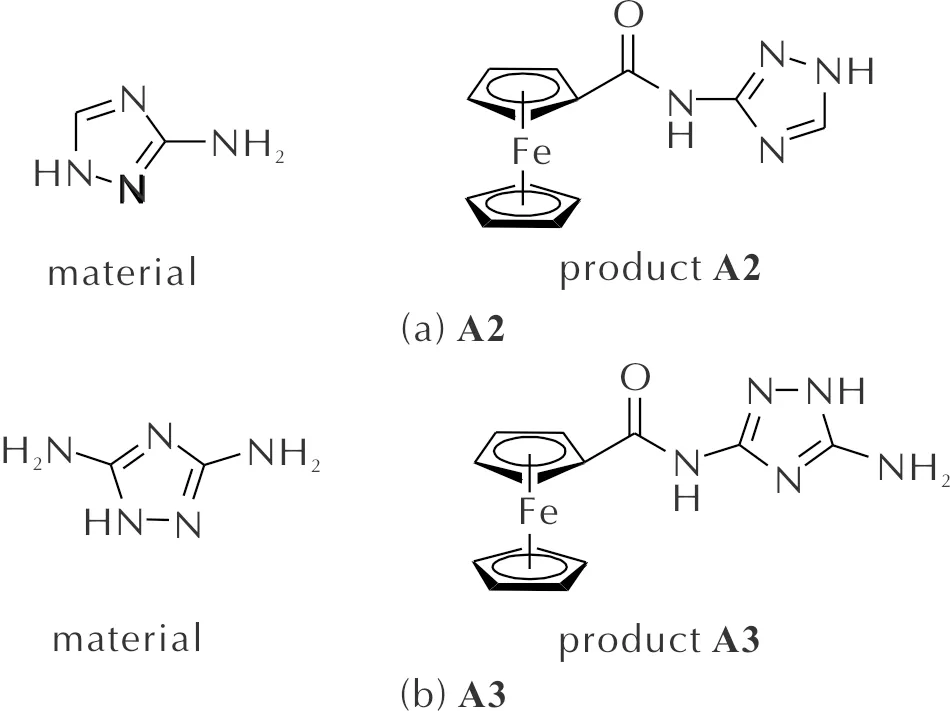
图3 化合物A2~A4的原料及产物Fig.3 Material and product of A2—A4

图4 双核二茂铁三氮唑化合物的制备Fig.4 Preparation of binuclear ferrocene triazole compounds
A1-yield: 46%, m.p. 180—181℃;1H NMR (400MHz, DMSO-d6),δ(ppm): 7.62 (s, 2H, C2HN3), 7.56 (s, H, NH2), 5.31 (s, 2H, C5H4), 4.67 (s, 2H, C5H4), 4.19 (s, 5H, C5H5);13C NMR (100MHz, DMSO-d6),δ(ppm): 167.76, 165.25, 145.44, 73.36, 72.95, 70.93, 70.88; IR (KBr): 3410, 3122, 1682, 1630, 1437, 1359, 1115, 1001, 835cm-1。
A2-yield: 34%, m.p. 193—194℃;1H NMR (400MHz, DMSO-d6),δ(ppm): 8.84 (s, H, NH), 6.06 (s, 2H, C2H2N3), 5.31 (s, 2H, C5H4), 4.67 (s, 2H, C5H4), 4.19 (s, 5H, C5H5); IR (KBr): 3730, 3017, 1682, 1665, 1638, 1437, 1332, 1097, 1009, 826cm-1。
A3-yield: 63%, m.p. 183—184℃;1H NMR (400MHz, CDCl3),δ(ppm): 6.92 (s, 2H, C2HN3), 5.43 (s, 2H, NH2), 4.59 (s, 2H, C5H4), 4.34 (s, 2H, C5H4), 4.26 (s, 5H, C5H5);13C NMR (100MHz, DMSO-d6),δ(ppm): 170.11, 162.21, 158.18, 133.80, 132.66, 73.06, 72.34, 70.28; IR (KBr): 3463, 3087, 1670, 1682, 1621, 1437, 1105, 1028, 809cm-1。
A4-yield: 68%, m.p. 220—221℃;1H NMR (400MHz, DMSO-d6),δ(ppm): 7.75 (s, 2H, NH2), 5.30 (s, 2H, C5H4), 4.75 (s, 2H, C5H4), 4.24 (s, 5H, C5H5), 3.88 (s, 3H, CH3);13C NMR (100MHz, DMSO-d6),δ(ppm): 171.75, 160.77, 158.84, 152.48, 73.77, 73.26, 71.07, 70.69, 53.02; IR (KBr): 3461, 3104, 1752, 1673, 1630, 1430, 1098, 1036, 817cm-1。
1.2.3 双核二茂铁基三氮唑化合物的制备
以二茂铁甲醛与3-氨基-1,2,4-三氮唑为原料,在甲醇中反应制备二茂铁基席夫碱类化合物,硼氢化钠还原,分离提纯得到二茂铁基三氮唑化合物。
在50mL圆底烧瓶中加入二茂铁基三氮唑(1mmol, 0.282g),加入35mL二氯甲烷,搅拌过程加7滴三乙胺,3min后加入二茂铁甲酰氯(1mmol, 0.248g),TLC监测反应,反应16h。待反应结束后,TLC显示生成两个新点,通过柱色谱对反应产物进行分离提纯[V(石油醚)∶V(乙酸乙酯)=2∶1],洗脱过程中先得到极性较小的A5,产率为47%,后得到极性较大的A6,产率为29%。真空干燥24h,得到目标化合物。反应式见图3。化合物A7的合成方法与A5类似。
A5-yield: 47%, m.p. 165—166℃;1H NMR (400MHz, CDCl3),δ(ppm): 7.68 (s, H, NH), 7.68 (s, H, CH), 5.43 (s, 2H, CH2), 4.63 (s, 2H, C5H4), 4.52 (s, 8H, C5H4, C5H5) , 4.24 (s, 8H, C5H4, C5H5);13C NMR (100MHz, DMSO-d6),δ(ppm): 171.90, 158.17, 151.44, 85.93, 73.41, 73.10, 71.57, 70.65, 68.85, 68.39, 68.08, 42.31; IR (KBr): 3454, 3104, 1667, 1632, 1437, 1327, 1316, 1098, 1001, 817cm-1。
A6-yield: 29%, m.p. 145—146℃;1H NMR (400MHz, CDCl3),δ(ppm): 8.78 (s, H, NH), 5.48 (s, 2H, CH2), 4.66 (s, 2H, C5H4), 4.25 (s, 16H, C5H4, C5H5);13C NMR (100MHz, DMSO-d6),δ(ppm): 167.79, 165.63, 145.81, 133.80, 132.66, 87.18, 73.48, 72.95, 70.65, 68.83, 68.77, 67.71; IR (KBr): 3445, 3105, 1670, 1636, 1429, 1106, 1001, 825cm-1。
A7-yield: 22%, m.p. 189—190℃;1H NMR (400MHz, DMSO-d6),δ(ppm): 8.66 (s, 2H, C2H2N3), 4.84(s, 2H, C5H4), 4.39 (s, 2H, C5H4), 4.22 (s, 5H, C5H5), 4.18 (s, 5H, C5H5), 4.09 (s, 2H, C5H4), 4.22 (s, 2H, C5H4);13C NMR (100MHz, DMSO-d6),δ(ppm): 169.77, 144.67, 80.44, 72.00, 70.44, 70.26, 69.87, 69.15, 69.09, 50.58. IR (KBr): 3455, 3108, 1638, 1621, 1429, 1106, 1008, 814cm-1。
1.3 性能测试
化合物红外光谱的测定:采用KBr压片法,测定合成的化合物A1~A7的红外光谱[15]。
化合物紫外光谱的测定:以DMSO为溶剂将A1~A7配置为0.1mg/mL的溶液,在200~800nm范围内测试。
电化学实验:准确称取一定质量的A1~A7,将其溶于5mL的0.1mol/L四丁基四氟硼酸铵的电解质溶液中,化合物的浓度为10-3mol/L,超声均匀溶解后进行氧化还原电位的测定[16]。
热稳定性测试:采用SDT-Q600同步热分析仪对化合物进行测试。A1~A7试样质量为1.3mg,氮气保护下升温速率为10℃/min。
化合物对AP的催化性能研究:采用差示扫描量热仪对混合物进行测试。A1~A7与AP均以1∶3的质量比混合研磨,试样质量为2.3mg,氮气保护下升温速率为10℃/min,测试温度为50~600℃[17-18]。
单晶衍射测试:在5mL的小烧杯中加入反应生成的化合物,加入适量的二氯甲烷,完全溶解且溶液澄清透亮,向其中加入正己烷至溶液稍有浑浊,再缓慢滴加二氯甲烷至刚好澄清透明,用保鲜膜密封、缓慢挥发。室温避光放置约1~2天,析出晶体。在显微镜下挑选形状规则、透亮的晶体进行单晶衍射测试。
2 结果与讨论
2.1 化合物A1、A5和A6的结构分析
化合物A1、A5和A6的分子结构式和单晶结构如图5所示,晶胞参数及精修数据见表1。

表1 化合物A1、A5和A6的晶体参数与精修数据Table 1 Crystal parameters and refinement data of compounds A1, A5 and A6
由图5和表1可知,化合物A1为三斜晶系,P-1空间群,晶胞参数a=7.8017(5)Å、b=11.9285(8)Å、c=13.6035(9)Å,α=91.544(2)°、β=91.858(2)°、γ=103.884(2)°。二茂铁甲酰基与三氮唑环上的N成键,反应生成的酰胺键(C11—N1),键长为1.415(3)Å。化合物A5为三斜晶系,P-1空间群,晶胞参数a=7.5399(4)Å、b=11.5119(5)Å、c=13.1026(6)Å,α=110.9380(10)°、β=96.524(2)°、γ=99.858(2)°。二茂铁甲酰基与三氮唑环上的N成键,反应生成的酰胺键(C11—N1),键长为1.405(2)Å。化合物A6为单斜晶系,空间群为P21/c,晶胞参数a=9.0471(2)Å、b=7.4896(2)Å、c=29.9335(7)Å,α=90.00°、β=97.9350(10)°、γ=90.00°。酰胺键(C11—N1)键长为1.413(3)Å,A5和A6为同分异构体。
2.2 紫外光谱分析
化合物的紫外-可见光谱图如图6所示。

图6 化合物A1~A4及A5~A7的紫外-可见光谱图Fig.6 The UV-vis spectra of compounds A1—A4 and A5—A7
由图6(a)可知,化合物A1~A4在251~417nm有强吸收带,是分子结构中二茂铁环,三氮唑的π-π*跃迁;C═O,C═N键n-π*跃迁产生的,并且化合物中存在发色基团和助色基团,产生红移,因此吸收峰产生重叠。由图6(b)可知,化合物A5~A7均为双核二茂铁基三氮唑,在250~414nm有强吸收带,是分子结构中的π-π*跃迁,n-π*跃迁产生的,在414~558nm处均有弱吸收带,化合物A7的共轭效应小于其他的双核二茂铁,在249~389nm有强吸收带,是分子结构中π-π*跃迁,n-π*跃迁产生,在389~561nm为二茂铁中铁原子的d-d跃迁[19]。
2.3 化合物的电化学性质分析
化合物的CV曲线如图7所示,氧化还原峰数据见表2。

表2 化合物A1~A7的氧化还原峰数据Table 2 Electrochemical data for compounds A1—A7

图7 化合物A1~A4及A5~A7的CV曲线Fig.7 CV curves of compounds A1—A4 and A5—A7
由图7和表2可知,A1~A7峰电位的差值范围在82~197mV,A1的峰电位差值最大为197mV,抗氧化能力最强,A5的的峰电位差值最小为82mV,抗氧化能力最弱。二茂铁基三氮唑化合物均具有氧化还原性,并比二茂铁具有更高的氧化还原电位,由于合成的二茂铁化合物比二茂铁具有更大的分子量,使得二茂铁基更难靠近电极表面,同时合成的二茂铁化合物有着更大的共轭基团,酯基、羰基的存在使二茂铁环上的电子云密度降低,并且化合物的电位差值均大于80mV,它们可能是一个准可逆反应,氧化还原峰的电流均随着扫描速度的增大而增大。结果表明合成的化合物均具有一定的抗氧化性[20]。
2.4 化合物的热重分析
化合物A1~A7的TG曲线如图8所示。从图8可知,化合物A1经历了,3个失重过程:第一个失重过程发生在199.1~216.2℃,失重约7.8%,为化合物中残留的溶剂脱除引起;第二阶段的缓慢失重发生在256.7~390.1℃,失重14.7%,是由酰胺键的断裂和三氮唑环的分解引起的失重;第三阶段为390.1~481.7℃的失重,失重率为3.4%,应为二茂铁骨架坍塌引起的失重。

图8 化合物A1~A7的TG曲线Fig.8 TG curves of compounds A1—A7
A2在135~216.2℃发生了轻微的失重,应为存在未充分干燥的溶剂;第二阶段的失重在259.6~353℃,失重率为5.3%,为酰胺键的断裂;第三阶段的失重在354~514℃,失重率为54.8%,推测为三氮唑环的分解和二茂铁自身的分解引起的失重。
A3经历了3个失重过程,在142.5~240℃,失重11.3%,为化合物中水分子的失去引起的失重;第二阶段的失重发生在391~417℃,失重4.6%,是由酰胺键的断裂引起的失重;第三阶段为430~463℃的失重,失重率为41.7%,应为二茂铁骨架的坍塌和三氮唑环的分解引起的失重。
A4存在两个失重过程,第一阶段在212.9~239.6℃,失重率为14.7%,为酰胺键的断裂和三氮唑环的分解;第二阶段在384.7~503℃,失重率为46%,推测为二茂铁自身的分解引起的失重。
A5、A6和A7经历了两个失重阶段,第一个阶段的失重过程分别为81.9~214℃,失重率为10.73%;191.6~214℃,失重率为4.0%;193.7~218.3℃,失重率为3.0%。这一过程的失重为化合物中残留的溶剂脱除引起的失重。第二阶段的失重过程分别为385.8~514.8℃,失重率为66.4%;379.4~481.7℃,失重率为63.4%;239.6~471.1℃,失重率为39.5%[21-23]。
2.5 化合物对AP的催化性能
化合物对AP的催化性能如图9所示。由图9可知,纯AP在242℃附近出现吸热峰,为晶型转换引起的吸热,在340℃出现低温放热峰,在467℃出现高温放热峰,释放大量的热。
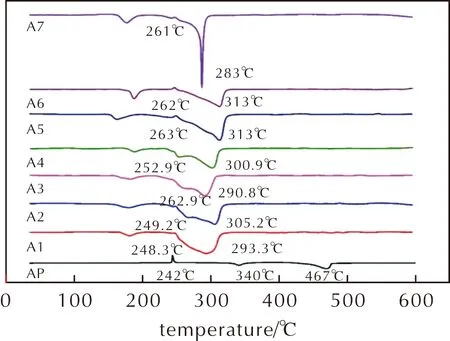
图9 化合物A1~A7的DSC曲线Fig.9 DSC curves of compounds A1—A7
A1+AP掩盖了晶型转换的吸热峰,放热峰始于248.3℃,终于324.6℃,峰温为293.3℃,放热量为4312.8J/g;A2+AP可看到晶型转换的吸热峰,放热峰始于249.2℃,终于327.1℃,低温放热峰和高温放热峰的峰温为268.6、305.2℃,放热量为3788.5J/g;A3+AP放热峰始于216.8℃,终于317.1℃,低温放热峰和高温放热峰的峰温为262.9、290.8℃,放热量为4024.9J/g;A4+AP放热峰始于235.3℃,终于317.8℃,低温放热峰和高温放热峰的峰温为252.9、300.9℃,放热量为3272.1J/g。这4种化合物的添加将AP的两个放热峰的峰温提前。A1+AP将AP的低温放热峰和高温放热峰完全合并,A2+AP~A4+AP将纯AP的低温放热峰提前69~84℃,高温放热峰提前144~165℃。
A5+AP~A7+AP均在250℃附近出现吸热峰,是晶型转换引起的吸热。A5和A6是同分异构体,DSC曲线变化并不大,表明同分异构体对AP的影响不大。这些化合物均有两个放热峰,第一个较小的峰在100~200℃之间,由于受到化合物A5~A7与AP的氧化还原反应形成纳米Fe2O3的影响,其他研究人员[24-25]也证实了纳米Fe2O3的形成,在研究二茂铁衍生物对AP的催化性能给出了类似的解释。第二个放热峰的区间在283~314℃,并且低温放热峰与高温放热峰完全合并为一个主峰,同时将AP的放热温度提前,因此双核二茂铁基三氮唑的综合性能更好。
3 结 论
(1)设计并合成了7种二茂铁基三氮唑化合物,通过X-单晶衍射、核磁、红外光谱,紫外光谱确证化合物结构。
(2)化合物A1~A7均具有氧化还原峰,而且峰电位大于可逆反应的最大峰电位差值,因此合成的化合物均具有抗氧化特性。
(3)化合物A1~A4的热分解温度约为200℃,A5~A7的热分解温度为240~380℃,说明它们具有良好的热稳定性。A1~A7可将纯AP的低温和高温放热峰的提前,A5+AP~A7+AP的放热最集中,对AP分解具有更显著的催化效果。
(4)双二茂铁基三氮唑化合物具有良好的抗氧化性、较高的热稳定性和显著的燃烧催化性能。

