嗜酸性粒细胞计数和嗜酸性粒细胞与淋巴细胞比率对腺病毒肺炎诊断及预后的影响*
张小珍 陈 娟 崔莉娜 黄义双 丘小其 刘晓萍
广东省深圳市宝安区妇幼保健院急诊儿科 518102
腺病毒肺炎(Adenovirus pneumonia,AdVP)常发生于婴幼儿时期,人腺病毒(Human adenovirus,HAdV)感染相关肺炎病死率约为50%,具有病情进展快、治疗难度大、预后差等特点,易引发脓毒症、急性呼吸窘迫综合征等严重并发症[1]。HAdV传统诊断方法为呼吸道样本多重HAdV聚合酶链反应,但具有一定局限性,未能识别早期下呼吸道HAdV感染,因而寻找AdVP诊断方法具有重要意义。嗜酸性粒细胞(EOS)可引起肺泡上皮、肺毛细血管内皮损伤,并可反映肺组织损伤、呼吸衰竭严重程度,且对感染相关器官功能障碍具有一定预测价值[2]。EOS属于免疫炎性细胞,其与气道重塑、气道高反应性、脓毒症、哮喘等炎性疾病有关,并可促进炎性因子、趋化因子、细胞因子释放,引起气道炎性反应[3]。嗜酸性粒细胞与淋巴细胞比率(ELR)变化可反映哮喘、气道炎性疾病严重程度[4]。目前EOS、ELR与AdVP相关研究较少,本研究主要检测AdVP患儿外周血中EOS、ELR,分析其对AdVP诊断价值及预后的影响,为改善AdVP患儿预后提供参考依据。
1 资料与方法
1.1 一般资料 选取2016年9月—2021年8月本院收治的肺炎患儿200例为研究对象,分为肺炎支原体肺炎(MPP)组124例、AdVP组76例,根据28d住院期间AdVP患儿预后情况[5]分为2个亚组:预后良好患儿53例、预后不良患儿23例。MPP组:男63例、女61例,年龄1~8(4.46±0.32)岁,体质量3~17(10.03±2.03)kg;肺部斑片状渗出108例、肺部实性改变15例。AdVP组:男40例、女36例,年龄2~8(4.52±0.35)岁,体质量2~16(9.83±1.97)kg;肺部斑片状渗出63例、肺部实性改变13例。两组一般资料比较无明显差异(P>0.05),具有可比性。研究经本院伦理委员会批准。
1.2 纳入与排除标准 纳入标准:符合AdVP、MPP诊断标准[6],经病原学检测确诊为HAdV阳性;近期未服用免疫抑制剂、糖皮质激素;生命体征平稳;既往无肺部手术史者;未合并肺部其他病变者;家属知情且签署同意书。排除标准:合并造血系统、脑血管等原发性疾病者;合并免疫系统疾病者;其他病原学检查结果显示阳性者;营养不良者;出现难以控制呼吸衰竭者;合并先天性疾病者。
1.3 方法 (1)收集肺炎患儿临床资料:包括性别、年龄、发病季节、机械通气、免疫功能、血常规、炎性指标[白细胞(WBC)、C反应蛋白(CRP)、中性粒细胞比值(N)、淋巴细胞比值(L)、红细胞沉降率(ESR)]等。(2)治疗方法:依据AdVP治疗标准,予以排痰、平喘、降温、并发症防治等对症治疗,依据病情需要予以肝肾保护,针对继发性感染者给予抗菌药物治疗。治疗7d后评价治疗效果:若症状、体征消失且经胸部影像学检查显示病灶完全吸收视为治愈,若症状、体征明显减轻且病灶明显吸收视为好转,若症状、体征及病灶无明显变化甚至恶化视为无效,其中治愈、好转提示预后良好,无效提示预后不良。(3)检测EOS、ELR:受试者入组后(24h内)采集静脉血3ml,加入抗凝试管(EDTA),使用Sysmex XT4000-i全自动血细胞分析仪(希森美康公司)检测EOS、淋巴细胞计数,并计算ELR。
1.4 观察指标 (1)比较入组后各组EOS、ELR,分析其与炎性指标相关性。(2)分析EOS、ELR联合CRP、ESR对AdVP的诊断价值。(3)分析EOS、ELR与AdVP患儿预后相关性,及其相关影响因素。(4)基于影响AdVP患儿预后的危险因素建立列线图预测模型,并进行外部验证,观察内容包括一致性指数(C-index)、区分度(Discrimination)、校准度(Calibration)。
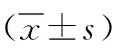
2 结果
2.1 MPP组、AdVP组EOS、ELR及炎性指标结果 与MPP组比较,AdVP组EOS、ELR、CRP、ESR升高(P<0.05),见表1。
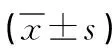
表1 MPP组、AdVP组EOS、ELR及炎性指标结果
2.2 EOS、ELR与炎性指标相关性分析 EOS、ELR与CRP、ESR呈正相关(P<0.05),见表2。
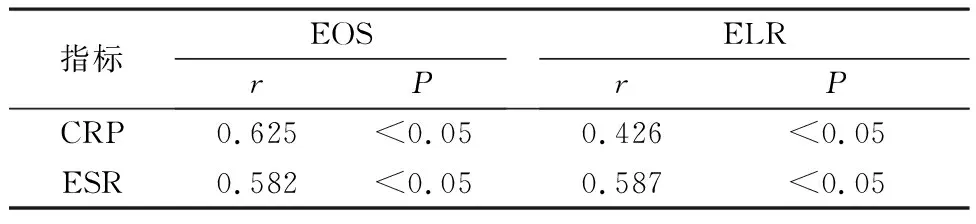
表2 EOS、ELR与炎性指标相关性分析
2.3 EOS、ELR、CRP、ESR对AdVP的诊断价值 以AdVP组76为阳性样本,以MPP组124例为阴性样本,绘制ROC曲线,结果显示EOS、ELR、CRP、ESR诊断AdVP的AUC分别为0.774、0.802、0.749、0.703,见图1、表3。

表3 EOS、ELR、CRP、ESR对AdVP的诊断价值
2.4 EOS、ELR联合CRP、ESR对AdVP的诊断价值 以AdVP组76为阳性样本,以MPP组124例为阴性样本,绘制ROC曲线,结果显示EOS+ELR、EOS+ELR+CRP、EOS+ELR+CRP+ESR诊断AdVP的AUC高于单个指标诊断(P<0.05),见图2、表4。
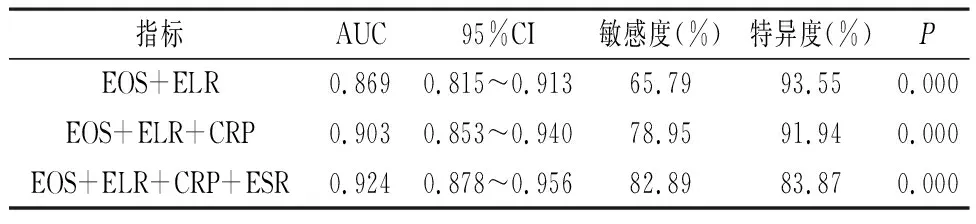
表4 EOS、ELR联合CRP、ESR对AdVP的诊断价值
2.5 不同预后患儿EOS、ELR及临床特征比较 与预后良好患儿比较,预后不良患儿乳酸脱氢酶、EOS、ELR、CRP、ESR水平升高(P<0.05),总胆红素、IgA、IgM水平降低(P<0.05),见表5。
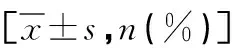
表5 不同预后患儿EOS、ELR及临床特征比较
2.6 Logistic回归分析影响AdVP患儿预后的危险因素 以AdVP患儿预后为因变量,以总胆红素、乳酸脱氢酶、EOS、ELR、IgA、IgM、CRP、ESR为自变量,Logistic回归分析影响AdVP患儿预后的危险因素,结果显示,EOS、ELR、CRP、ESR是患儿预后不良的危险因素(P<0.05),见表6。
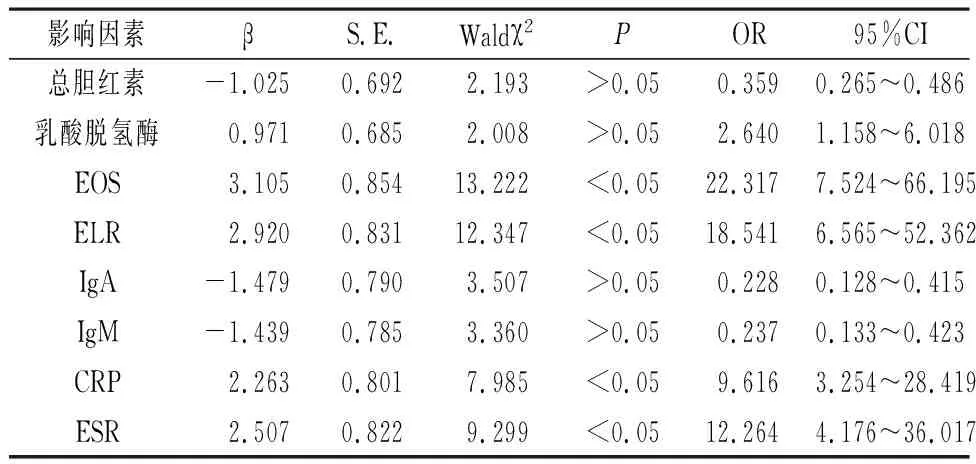
表6 Logistic回归分析影响AdVP患儿预后的危险因素
2.7 AdVP预后不良的列线图预测模型及外部验证 纳入2.6中分析所得相关影响因素,绘制预测AdVP预后不良(预后不良患儿23例)的列线图,见图3,C-index为0.985(95% CI:0.421~0.993)。采用200例肺炎患儿作为外部验证数据集对列线图进行验证,结果显示,Discrimination为0.730,Calibration为0.822,见图4。
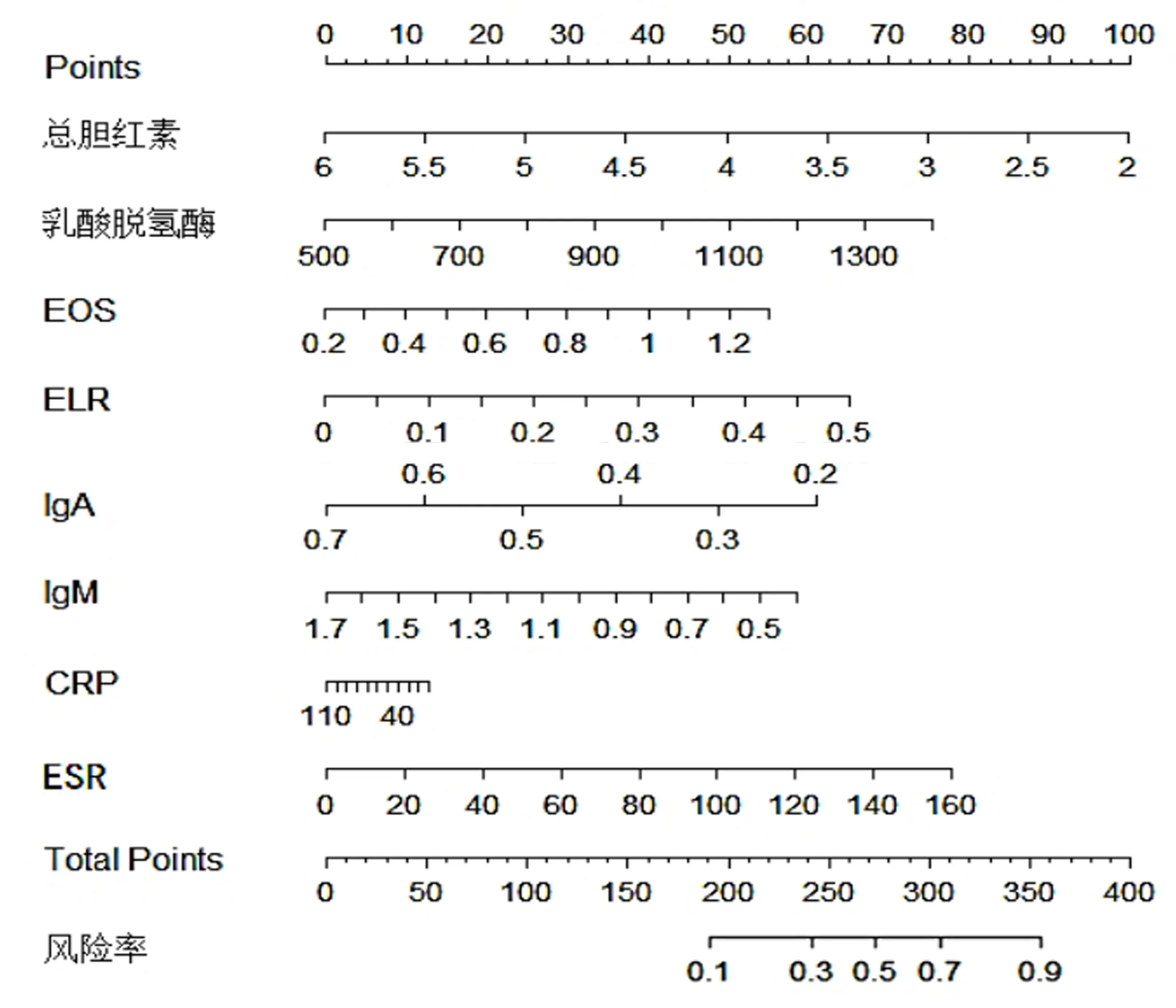
图3 AdVP预后不良的列线图预测模型
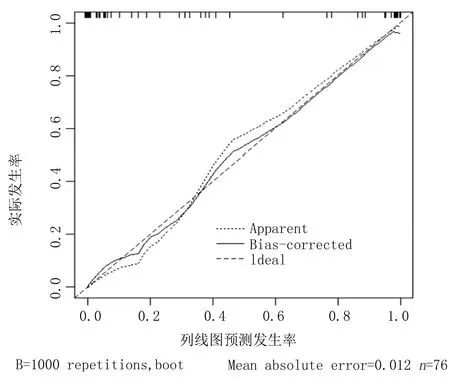
图4 列线图预测模型的外部验证
3 讨论
EOS、炎性因子与淋巴细胞计数、血小板计数呈正相关,并可用于评估新型冠状病毒肺炎(COVID-19)恢复情况[7]。本研究中AdVP组EOS、ELR、CRP、ESR水平高于MPP组,EOS、ELR与CRP、ESR呈正相关,表明EOS、ELR升高可增加CRP、ESR生成量,引起细胞免疫功能紊乱,诱发气道炎性损伤,参与AdVP发生发展过程。CRP、ESR可增加肺部血管通透性,诱发坏死性细支气管炎,可能作为早期诊断AdVP的标志物[8]。提示EOS、ELR可反映气道炎性反应水平,EOS可迁移至炎性部位,以自分泌/旁分泌形成生成ESR等炎性因子,引发炎性级联反应,在AdVP气道炎性反应中发挥重要作用,控制EOS活化的内源性途径可能控制AdVP发展进程。同时本研究尝试性分析EOS、ELR联合CRP、ESR对AdVP的诊断价值,结果显示EOS、ELR联合CRP、ESR诊断AdVP的AUC高于单个指标诊断价值。表明HAdV感染可激活机体免疫系统,增加炎性介质、细胞因子生成量,检测外周血EOS、ELR、CRP、ESR,可为临床早期诊断AdVP及治疗提供参考。
EOS可促进T细胞增殖、分化,调节辅助性T细胞1(Th1)/Th2极化,参与机体免疫反应过程,研究表明EOS计数增加、ELR升高与呼吸衰竭、多器官功能障碍有关[9]。本研究显示,预后不良患儿乳酸脱氢酶、EOS、ELR、CRP、ESR水平高于预后良好患儿,总胆红素、IgA、IgM水平低于预后良好患儿。其原因可能为EOS、ELR升高可释放Th2细胞因子,诱发Th2免疫反应,引起机体免疫失衡、细胞免疫功能障碍,并可激活趋化因子受体3,募集炎性因子聚集于气道,引起气道炎症反应,促进肺组织损伤,导致患儿预后不良。ELR可作为多种炎性疾病的诊断标志物[10]。本研究分析显示,EOS、ELR是AdVP患儿预后不良的危险因素。本研究纳入预后不良的相关因素建立列线图预测模型,结果显示C-index为0.985,进一步对列线图模型进行验证,结果发现该模型具有预测精确度、良好区分度、校准度。
综上所述,AdVP患儿外周血中EOS、ELR升高,可作为早期诊断AdVP的生物标志物,联合CRP、ESR可提高其诊断价值,基于EOS、ELR、CRP、ESR建立的列线图模型可准确预测AdVP患儿预后状态,为临床制定个性化治疗方案提供参考。

