高糖诱导人牙髓细胞钙化的初步探究
刘瑜佳 关为群
福建医科大学附属协和医院口腔科,福建省福州市 350000
糖尿病是一种以高血糖为特征的慢性多系统代谢疾病,影响许多器官和组织的结构、功能和免疫应答。通常表现为纤维化、视网膜病变、神经病变和心血管疾病等并发症。在我国,由于糖尿病的高发生率,糖尿病相关的口腔疾病包括牙周组织病变、口腔黏膜病变、牙体、牙髓组织病变等逐渐引起人们的重视。
牙髓钙化是牙髓组织对创伤、龋坏及牙周病等刺激的一种反应,也是一种增龄性变化[1]。关于糖尿病与牙髓钙化之间的关系,目前的研究很少,最近的一项研究报告称,与健康人群相比,2型糖尿病患者更容易出现牙髓钙化并伴有牙髓结石[2],同时有动物实验研究发现糖尿病大鼠牙髓组织中髓石的数量和大小均高于正常大鼠[3]。糖尿病患者不仅容易产生髓石,根尖周病变也经常发生[4],散在的钙化颗粒和髓石可能阻挡根管口,从而改变了髓腔内部的解剖形态,增加临床医生根管治疗难度,为此需要采用合适的器械和方法将髓石移除以完成良好的牙髓治疗。为了探索高糖是否会对人牙髓细胞钙化产生影响,本实验将不同高浓度的葡萄糖分别作用于人牙髓细胞,观察其对人牙髓细胞增殖以及钙化结节形成的影响。
1 材料与方法
1.1 主要试剂及仪器 DMEM、胎牛血清、青霉素、链霉素、胰酶、MTT均购自Hyclone公司(美国),葡萄糖、DMSO、茜素红购于Sigma公司(美国),鼠抗人角蛋白抗体、鼠抗人波形蛋白抗体、DAB显色剂购于北京中杉金桥生物技术公司,十二烷基硫酸钠购于北京鼎国生物有限公司,倒置显微镜(Nikon TS-100,日本); 高速低温离心机(Eppendorf,美国);酶联检测仪(Biotek Power Wave,美国)。
1.2 人牙髓细胞原代培养 本研究经福建医科大学附属协和医院医学伦理委员会批准,获得参与者知情同意,人牙髓组织取自于福建医科大学附属协和医院口腔科因阻生或正畸需要拔除的14~20 岁新鲜健康的恒牙,拔除后置于含双抗(100μg/ml 青霉素、100μg/ml链霉素)的PBS中; 无菌条件下取出牙髓组织,剪成小碎片。使用组织块贴壁法分离培养。将获得的细胞悬液置于37°C、5%CO2孵育箱内培养,每2d换液,当细胞融合率达到80%时传代,取第3~5代细胞进行后续实验。
1.3 人牙髓细胞(hDPCs)的组织来源鉴定 取处于对数生长期性能稳定、细胞单一的hDPCs,常规消化制备细胞悬液,调整细胞浓度,以每孔5 000个细胞接种于 24 孔板中,待细胞长满板底 80%时,行细胞波形蛋白及角蛋白免疫细胞化学染色。
1.4 细胞分组及培养基配制 将hDPCs分为: 对照组(5.5mmol/L组)和实验组(分别为15mmol/L、25mmol/L、35mmol/L、45mmol/L)。含5.5mmol/L 葡萄糖DMEM培养基是人牙髓细胞存活的最基本的营养要素,作为本实验的对照组。根据葡萄糖浓度(mmol/L)=葡萄糖含量(mg/L)/180(葡萄糖分子量),配制出含不同浓度葡萄糖的高糖培养基。
1.5 MTT法检测hDPCs增殖活性 将hDPCs以2×103个/孔的密度接种于96孔板内,配制含5.5mmol/L(对照组)、15mmol/L、25mmol/L、35mmol/L、45mmol/L的完全培养基,分别于培养1、3、5、7、10d,每天同一时间,每孔加入10μl MTT,置于37℃ 、CO2孵育箱培养4h后,小心吸掉上清,每孔加入100μl二甲基亚砜,置摇床上低速振荡10min,使结晶物充分溶解。酶标仪在450nm波长下检测各组细胞吸光度(A)值。本实验重复3次,并记录结果。
1.6 茜素红染色检测hDPCs形成钙化结节能力 将hDPCs以1×105个/孔的密度接种于6 孔培养板内, 培养28d后茜素红染色,显微镜观察并拍照。为了量化钙的相对量,每孔加入0.5mol/L HCl和5%十二烷基硫酸钠(SDS)37℃反应1h。吸取200μl等量的上清液在OD 450nm处测量其吸光度值。做茜素红标准曲线(0~10mmol/L茜素红溶解于5%SDS),上述测得的OD值与标准曲线比较,即可获得茜素红浓度。
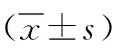
2 结果
2.1 hDPCs的形态及鉴定 牙髓组织块原代培养1周即可见有hDPCs从组织块周围爬出(见图1a),其形态为长梭形或星形,细胞核圆形或椭圆形,胞体均匀、丰满,核仁明显,围绕组织块呈放射状或漩涡状生长。传代后的细胞以成纤维样细胞为主,形态趋于一致(见图1b)。hDPCs抗波形蛋白染色阳性(见图2a)抗角蛋白染色阴性(见图2b)。
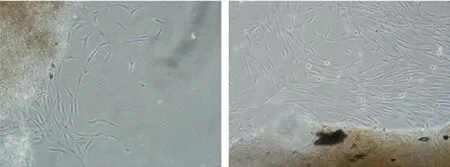
a 原代培养第6天 b 原代培养第12天
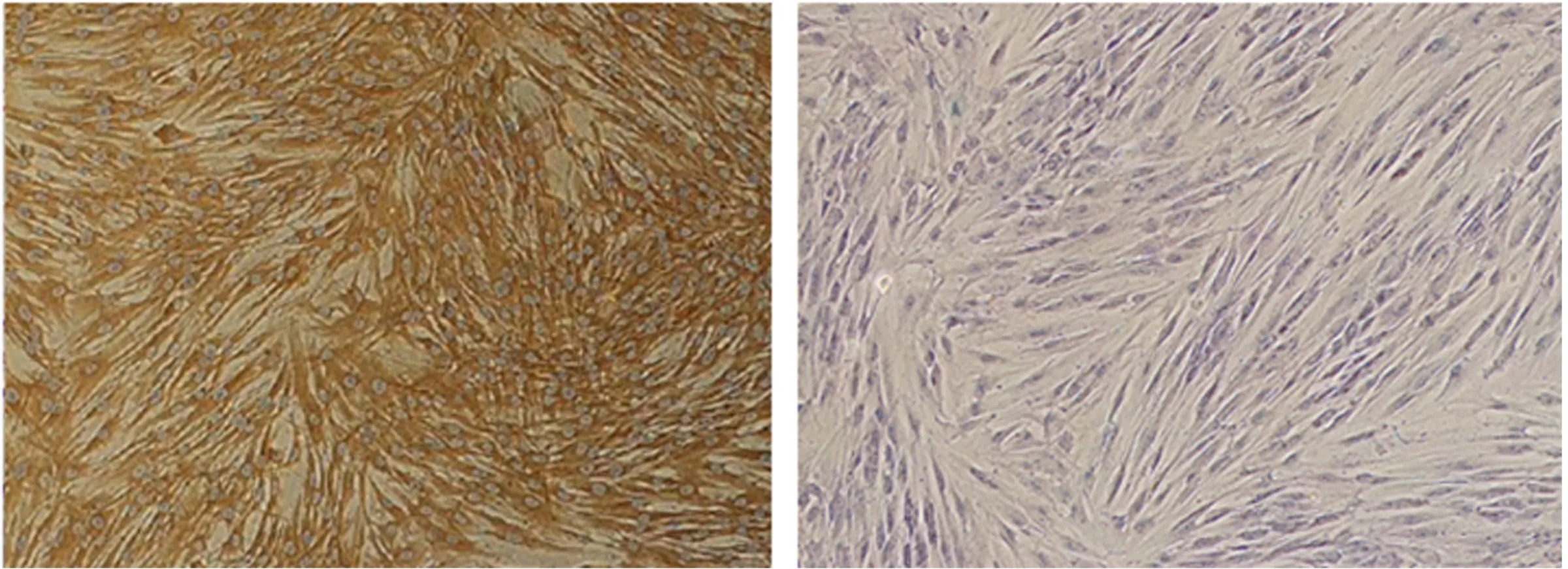
a 波形蛋白阳性染色 b 角质蛋白阴性染色
2.2 不同糖浓度对hDPCs增殖活性的影响 用MTT法检测第3代hDPCs在五种不同糖浓度培养基条件下的增殖情况见表1,从结果中可以看出:不同浓度葡萄糖(5.5、15、25、35、45mmol/L)对牙髓细胞的增殖作用具有时间依赖性,随着时间的延长对hDPCs增殖作用逐渐增强。采用单因素方差分析,15mmol/L组仅在第5、7天有促进牙髓细胞增殖的作用,与对照组(5.5mmol/L)相比,差异有统计学意义(P<0.05);25mmol/L组在第1、3、5、7天时有促进牙髓细胞增殖的作用,与对照组(5.5mmol/L)相比,差异有统计学意义(P<0.05),并且这种增殖效应在第7天时达到最高峰(P<0.001)。35mmol/L组在第10天与对照组(5.5mmol/L)相比,可明显促进hDPCs的增殖,与对照组(5.5mmol/L)相比,差异有统计学意义(P<0.05)。45mmol/L组在第1、3、5、7、10天与对照组(5.5mmol/L)相比,均无促进hDPCs的增殖,与对照组(5.5mmol/L)相比,差异无统计学意义(P>0.05)。
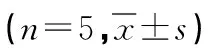
表1 不同浓度及作用时间葡萄糖刺激下hDPCs增殖活性变化
2.3 不同浓度葡萄糖对hDPCs矿化结节形成的影响 hDPCs在培养至21d时,即可看到两组细胞均呈复层生长,并呈漩涡状排列,在漩涡状中心处可出现致密的矿化结节,结节中心透光性较差(见图3a)。培养至28d时,茜素红染色可见两组均有红色的矿化结节,正常对照组(5.5mmol/L)矿化结节数目少,结节较小,染色浅(见图3b)。高糖组(15、25、35、45mmol/L)细胞钙结节数目较多,且结节较大,染色深并伴有许多颗粒状的致密的钙化小点(见图3c~f)。
将上述矿化结节通过SDS方法进行半定量分析,由图4可以看出,浓度为15、25、35、45mmol/L的矿化沉积量均高于对照组,但仅有15和25mmol/L组与对照组相比,其差异具有统计学意义(P<0.05),尤其25mmol/L差异最为显著(P<0.01)。
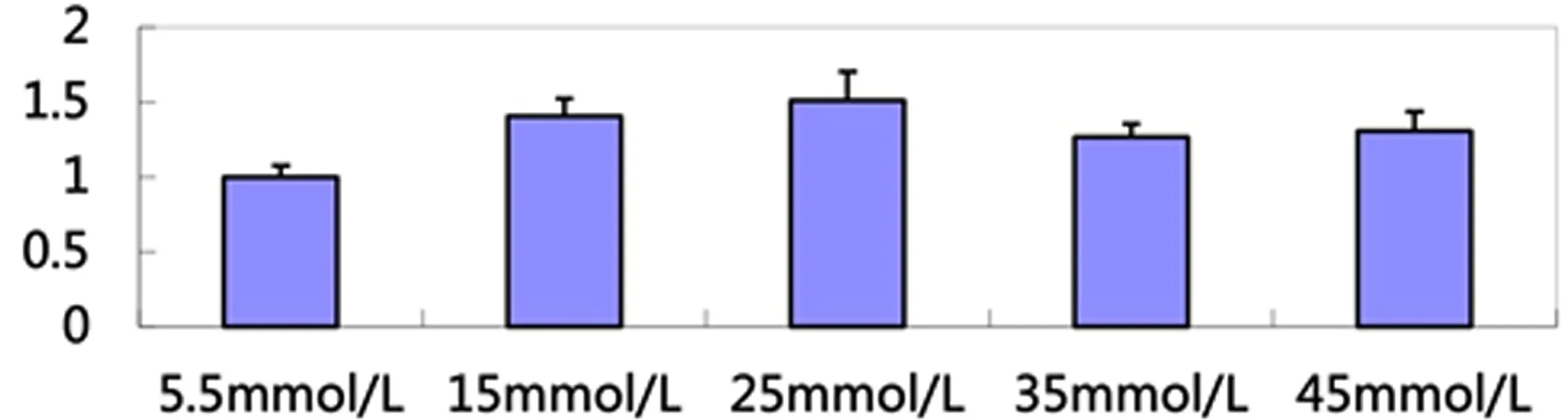
图4 半定量检测不同hDPCs组矿化结节情况
3 讨论
近年来我国糖尿病的发病率逐年升高,与糖尿病相关的并发症逐渐引起人们重视,高血糖是糖尿病的主要特征,研究显示其对血管内皮细胞、牙周膜韧带细胞、骨细胞等有明显影响[5-7],参与糖尿病并发症的发生。体外实验多采用高浓度的葡萄糖干预实验细胞,模拟糖尿病状态下细胞的生物学行为。本实验采用改良组织块法成功培养出人牙髓细胞,通过免疫组织化学染色方法发现体外培养的 hDPCs 抗波形蛋白染色阳性,角蛋白染色阴性,提示细胞来源于中胚层,无上皮细胞混杂,为进一步的实验研究奠定基础。
牙髓细胞增殖是人牙体组织钙化形成修复性牙本质或矿化结构的主要细胞以及生物基础[8]。用MTT方法检测高糖对hDPCs增殖的影响,从hDPCs增殖曲线图中可以看出,葡萄糖在一定浓度范围内(5.5~25mmol/L)对hDPCs的生长可以起到促进作用,并呈浓度和时间依赖性。这可能与一定范围内高浓度的葡萄糖给予细胞的生长提供更多的能量有关,从而促进其增殖,在第7天,15和25mmol/L组细胞进入生长平台期。随着葡萄糖浓度的进一步提高,35mmol/L组在培养7d内与对照组相比并无明显促进hDPCs生长的作用,从第7天起开始才显示促进hDPCs生长,这可能开始时由于过高浓度葡萄糖影响细胞外液渗透压对细胞增殖产生抑制作用,也有可能是因为过高浓度葡萄糖影响细胞内多种酶的活性有关[9],从而影响细胞的正常生长, Gabriella Doronzo 等人分别用5.5、15和25mmol/L浓度葡萄糖培养糖尿病模型的大鼠血管平滑肌细胞,发现高浓度葡萄糖促进大鼠平滑肌细胞的增殖,其中25mmol/L促进细胞增殖效果最为显著[10]。这与本实验结果大体一致,而超过一定浓度范围的高糖则抑制hDPCs增殖,但其机制尚不完全明确,需要进一步研究。
细胞外钙盐沉积是牙髓细胞具有矿化能力的最直接表现,反映钙盐变化最直观的表现就是矿化结节的形成[8]。通过不同条件下矿化结节大小和数量的比较,可以直观观察不同刺激对牙髓细胞矿化能力的影响。细胞形成矿化结节的先决条件是体外牙髓细胞呈复层生长的能力,而矿化的先决条件是细胞结节的三维结构[11]。体外持续培养hDPCs时,最初细胞以单层贴壁的方式生长,当细胞不断增殖单层汇合后可继续生长,此时表现为复层生长方式,继而形成具有三维结构的细胞结节,随后细胞外基质发生矿化,最终形成矿化结节。本实验采用茜素红与表面活性剂十二烷基硫酸钠(SDS)并用的方法发现,hDPCs无论在正常或者高糖条件培养下,在第28天时可形成茜素红染色阳性的钙化结节,这表明hDPCs在体外培养条件下具有合成、分泌并形成矿化细胞外基质的能力。同时还发现高糖组(25、35、45mmol/L)细胞钙结节数目较多,且结节较大,染色深并伴有许多颗粒状的致密的钙化小点;正常组(5.5mmol/L)钙化结节数目少,结节较小,染色浅,这表明高糖可明显促进hDPCs形成钙化结节的能力。用SDS法半定量检测矿化物沉积含量的结果显示,高糖组25mmol/L可以显著促进hDPCs钙化结节的形成。这与Yuji Inagaki等[3]的结果一致,他们运用免疫组织化学染色方法观察30周大小的糖尿病大鼠模型发现,糖尿病大鼠的牙髓组织的钙化结节在数目和数量上都高于正常大鼠,但其机制仍不详。另外,也有学者的研究也得出了类似的结论,发现高糖促进间充质细胞的骨向分化[12]。但是不同于Colombo和Kim的研究,他们认为高糖抑制骨细胞和牙周膜韧带细胞的成骨分化,抑制细胞外基质钙化结节的形成[13-14]。这可能是因为在不同的研究中,由于细胞来源的异质性,实验条件的不同以及实验所采用的葡萄糖刺激方式不同等因素,高糖对细胞矿化可能产生相反的作用。
综上所述,一定浓度范围内的高糖以浓度依赖的方式促进hDPCs的增殖及矿化。虽然目前的资料显示高血糖影响了细胞的增殖以及矿化,但是糖尿病是非常复杂的全身系统疾病,体外模拟糖尿病高糖是否能完全代表糖尿病的机体状态还未知。本实验拟初步探讨高糖是否会对牙髓细胞钙化产生影响,为解决糖尿病患者的一些临床问题提供实验基础,在后续的研究中我们将进一步研究高糖对牙髓细胞相关钙化因子表达的影响。

