核苷酸剪切修复基因mRNA和蛋白对头颈部鳞状细胞癌发生的预测价值研究
张 令,王 宁,许 楠,张晓彤,韩 鹏
(1.西安交通大学第一附属医院耳鼻咽喉头颈外科,陕西 西安 710061;2.西安交通大学第二附属医院耳鼻咽喉头颈外科,陕西 西安 710004;3.神木市医院耳鼻喉科,陕西 神木 719300;4.西安市鄠邑区人民医院耳鼻喉科,陕西 西安 710300)
头颈部鳞状细胞癌(Head and neck squamous cell carcinoma,HNSCC)是常见的恶性肿瘤之一[1-2]。由于HNSCC生存率较低且总体预后相对较差,给患者带来极大痛苦[3-4]。核苷酸剪切修复(Nucleotide excision repair,NER)通路在DNA修复中扮演重要角色,其功能多样化[5-7]。既往研究[8-10]发现,30多个基因参与NER通路来修复损伤DNA,NER通路可以修复受紫外线辐射损伤的DNA。一些化学物质(如烟草燃烧过程产生的苯并芘)可以与DNA内核苷酸残余的碱基成分发生反应进而生成一种块状加合物,该物质会导致正常的DNA螺旋结构发生扭曲。NER通路在去除这些加合物的过程中发挥重要作用,可修复约70%由环境因素引起的DNA损伤[11-13]。
既往研究[14-17]表明,NER基因mRNA和蛋白表达水平降低分别与HNSCC的易感性增加有关,但单一转录或翻译水平的NER通路标志物在预测HNSCC发病风险上具有一定的局限性。目前,将两种NER表型相结合来预测HNSCC发病风险的研究较少。因此,本研究探讨NER基因9个核心mRNA和蛋白的表达水平对HNSCC发病风险的预测价值。
1 对象与方法
1.1 研究对象 本研究选取2015年1月至2021年12月就诊于西安交通大学第一附属医院的HNSCC患者98例为病例组,另选取18岁及以上健康人群95例为对照组。本研究仅选取中国汉族人群作为研究对象。病例纳入标准:新诊断为HNSCC;年龄≥18岁;未接受过手术治疗(除诊断性穿刺术);未患过其他肿瘤;病理诊断为口腔、咽部(除外鼻咽部)及喉部的SCC。排除标准:年龄<18岁;不愿提供相应血液标本;中途退出研究;接受过任何化疗或放疗。本研究通过西安交通大学第一附属医院伦理委员会审批,所有入选研究对象均被告知相关风险并签署知情同意书。
1.2 研究方法
1.2.1 TRIzol法提取RNA:从血液标本中提取淋巴细胞,将淋巴细胞弃培养液,用磷酸盐缓冲液清洗细胞培养板/瓶。每孔加入TRIzol试剂1 ml,裂解细胞,置入1.5 ml EP管中,震荡60 s,并在室温下放置13 min。在4 ℃下将裂解液离心15 min,离心后样品分层,吸取上层RNA。取上清液至清洁的EP管中,离心13 min,弃上清液,可见沉于管底的RNA。取1 ml 75%乙醇加入沉淀中,离心13 min,弃除上清液。将EP管倒置于滤纸上5 min,测定OD值。将RNA反转录成cDNA,并置于-80 ℃冰箱中。
1.2.2 荧光定量PCR检测NER基因mRNA表达:每个扩增反应在引物和Master混合物的体系中进行,95 ℃ 5 min,变性15 s,40 ℃循环,60 ℃退火/延伸。以18S为内参,通过ΔCt值计算9个NER基因的表达水平,ΔCt值越小表示mRNA表达水平越高。所有NER基因mRNA及18S rRNA引物由美国Applied Biosystems公司提供。
1.2.3 反相蛋白微阵列(RPPA)实验:通过Aushon 2470点样仪将裂解物置于载玻片上,将含有抗原的样品放置3份。每个载玻片用一抗和偶联的二抗进行检测,将检测芯片与每个抗体在室温下孵育。使用Dako Cytomation-Catalyzed系统扩增信号,然后通过DAB比色反应显现信号。使用Array-Pro Analyzer软件对芯片上的信号进行扫描和分析,以确定光电强度,随后将其通过Logistic回归的R包进行处理。
2 结 果
2.1 两组患者一般资料比较 病例组年龄25~72岁,平均(55.22±12.45)岁。对照组年龄23~74岁,平均(55.48±14.27)岁。两组年龄比较差异无统计学意义(t=0.617,P=0.638)。病例组71.64%和对照组76.25%为男性,病例组28.36%和对照组23.75%为女性,两组性别构成比较差异无统计学意义(χ2=32.214,P=0.271)。与对照组比较,病例组吸烟占比较高(58.23%与65.16%,χ2=52.245,P=0.028)。与对照组比较,病例组饮酒人群比例相对较多,差异无统计学意义(66.31%与68.17%,χ2=45.653,P=0.105)。
2.2 两组患者NER基因mRNA和蛋白质表达水平比较 见表1。与对照组比较,病例组XPA mRNA和蛋白表达降低,XPB mRNA表达降低(均P<0.05)。

表1 两组患者NER基因mRNA和蛋白质表达水平比较
2.3 HNSCC发生影响因素Logistic回归分析 见表2。根据对照组的中位水平将病例组NER mRNA和蛋白划分为高、低表达水平。以XPA蛋白(≥0.206=0,<0.206=1)、XPA mRNA(>19.85=0,≤19.85=1)、XPB蛋白(≥0.582=0,<0.582=1)、XPB mRNA(>19.34=0,≤19.34=1)为自变量,以是否发生HNSCC(否=0,是=1)为因变量行Logistic回归分析,结果显示XPA mRNA≤19.85和XPA蛋白<0.206是HNSCC发生的独立危险因素(均P<0.05)。

表2 HNSCC发生影响因素Logistic回归分析
2.4 NER基因mRNA和蛋白表达对HNSCC发生的预测价值 见表3。单独XPA蛋白、XPA mRNA以及两者联合预测HNSCC发生的AUC分别为0.637、0.592、0.674。两者联合的AUC大于单独XPA蛋白的AUC和单独XPA mRNA的AUC(P=0.016、0.001)。
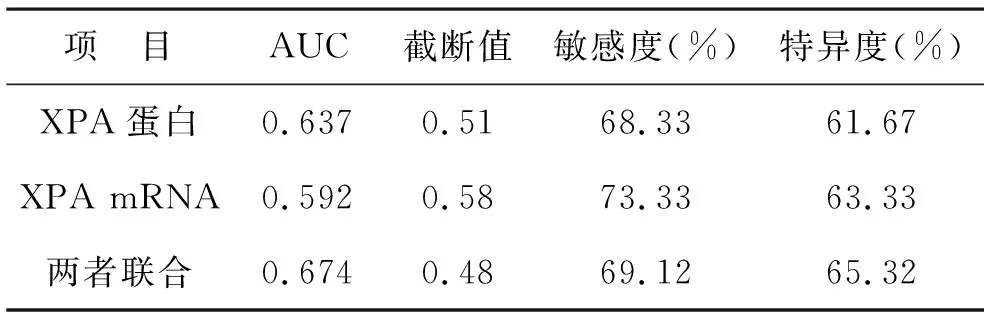
表3 NER基因mRNA和蛋白表达对HNSCC发生的预测价值
3 讨 论
既往研究[15,17]证实,NER基因mRNA或蛋白表达水平降低分别与HNSCC易感性增加有关。由于NER通路中单一表型对HNSCC风险预测的效能有限,因此我们将NER基因蛋白和mRNA的表达水平联合作为一个新的水平来预测HNSCC的发病风险。 本研究结果显示,NER基因蛋白和mRNA联合比单独一种表型更有效地预测HNSCC的风险。
国外研究[17]发现,HNSCC风险的增加与XPD、XPF、XPA和XPC蛋白表达水平的降低间存在相关性,因没有合适的DDB1和XPB抗体,因此无法进行相关检测。由于中国汉族人群中HNSCC的组成与非西班牙裔白种人有很大不同,本研究检测了中国汉族人群中9种核心NER基因蛋白的表达水平并验证了与HNSCC发病风险间的关系,发现XPA mRNA和蛋白表达降低与HNSCC发病风险增加相关。以上结果进一步支持NER通路的翻译水平改变可能导致HNSCC的发病风险增加,与转录水平相比,NER通路的翻译水平对NER修复能力有直接影响这一观点。既往对转录水平的研究[15]表明,在中国汉族人群中XPB mRNA表达水平的降低与HNSCC风险增加有关。然而,在本研究中,在翻译水平上未发现HNSCC与XPB的相关性。造成这种差异的原因可能是目前的研究样本量不够大。而且,NER基因的转录和翻译水平可能不直接相关。虽然NER基因的mRNA最终被翻译成NER蛋白,但转录和翻译过程可能远不止是简单的线性相关,其进一步机制可能是顺式作用和反式作用过程构造了一系列系统,促进或抑制从一定拷贝数的mRNA分子合成蛋白质,而翻译水平更直接地参与NER修复过程[17]。
组成XPA蛋白的结构域包括能够与转录因子ⅡH肽1(GTF2H1)相互作用的C端结构域,与RNA聚合酶Ⅰ亚基和ERCC1结合位点的N端结构域以及负责DNA结合的中心结构域,这些结构域功能的变异可能导致NER过程异常,进而增加癌症的易感性[18-20]。本研究结果发现,在汉族人群中HNSCC的易感性增加与XPA mRNA和蛋白表达水平降低有关。目前的结果与既往研究的非西班牙裔白人关于HNSCC风险研究一致,表明XPA可能是两个种族中HNSCC普遍的生物标志物。
虽然对NER mRNA表达水平的检测易进行,但PCR检测结果可能会因不同的细胞阶段而波动。因此,从转录水平的数据来预测HNSCC的风险可能是不稳定的,需要另一个试验来证实PCR试验的结果。RPPA法是一种快速、经济、高效的检测NER蛋白表达水平的方法[17]。既往研究在非西班牙裔白种人中,采用ROC曲线评估了NER蛋白对HNSCC发病风险预测的效能,发现与未包含XPB和XPA表达水平相比,包含XPB和XPA表达水平的AUC显著改善[17]。本研究发现,与仅包含NER蛋白或mRNA的表达水平相比, 两者联合能显著提高AUC。这些结果进一步表明,结合NER通路的两种表型可以显著提HNSCC风险预测的有效性。
综上所述,XPA mRNA和蛋白表达水平是HNSCC发生的影响因素,两者联合对HNSCC发生的预测价值高于单独预测。

