CD166对多发性骨髓瘤RPMI-8226细胞增殖、凋亡及自噬的影响实验研究
张治业,余醒醒,张 璐,翟志敏
(1.安徽医科大学附属阜阳医院血液内科,安徽 阜阳 236000;2.安徽医科大学第二附属医院血液内科,安徽 合肥 230601)
多发性骨髓瘤(Multiple myeloma,MM)是一种由克隆性浆细胞异常增殖导致的恶性疾病。据统计,MM占所有恶性肿瘤的1%,占造血肿瘤的10%~15%,是仅次于非霍奇金淋巴瘤(Non-Hodgkin lymphoma,NHL)的第二大血液性肿瘤[1-2]。截止到2020年,每年约有176404例新发患者,近117077例患者死于MM[3]。尽管新型药物引入和干细胞移植技术进步显著改善了患者的预后,然而在生存率方面仍面临巨大挑战[4-5]。因此,深入了解多发性骨髓瘤的分子机制并寻找有效的治疗靶点具有重要意义。CD166也称白细胞活化黏附分子(Activated leukocyte cell adhesion molecule,ALCAM)是黏附分子免疫球蛋白超家族的一种糖蛋白,已被证明在细胞间相互作用、血管生成、单核细胞转运和T细胞激活等方面发挥重要作用[6-7]。其在各种类型肿瘤中过表达,且表达水平或细胞表面丰度与不良预后相关[8]。CD166已成为一种肿瘤进展调节剂,主要通过调节细胞增殖、黏附、迁移和侵袭[9],也被确定为肿瘤干细胞标志物[10]。然而,CD166在MM中的作用机制尚不明确。本研究探究CD166对MM细胞增殖、凋亡和皮下成瘤能力的影响。
1 材料与方法
1.1 实验细胞与动物 多发性骨髓瘤细胞RPMI-8226购自中国科学院细胞库,在添加10%胎牛血清和1%青霉素/链霉素的PRIM1640 (Gibco)培养基中培养,保持潮湿、37 ℃、5% CO2环境,每2天更换1次培养基。BALB/c裸鼠(4周,雄性,10只)购自中国北京维通利华实验动物技术有限公司,动物实验方案经过动物伦理委员会批准并根据指南进行。
1.2 主要试剂 PRIM1640高糖培养基(C11875500BT)、胎牛血清(10099-141C)、青霉素/链霉素(15140122)和0.25%胰蛋白酶(25200-056)购自美国Gibco公司;Lipofectamine 3000(L3000015)购自美国Invitrogen公司;sh-CD166由中国上海吉凯基因医学科技股份有限公司合成;MTT细胞增殖和细胞毒性试剂盒(C0009M)、结晶紫染色液(C0121)与细胞凋亡试剂盒(C1052)购自中国碧云天生物技术有限公司;mCherry-GFP-LC3双标腺病毒试剂盒(AP22031201)购自汉恒生物科技(上海)有限公司。
1.3 实验方法
1.3.1 细胞转染[11]:当RPMI-8226细胞生长至80%时进行传代或开展实验。靶向CD166的短发夹RNA(shRNA)和阴性对照(NC)由上海吉凯基因医学科技股份有限公司设计并合成,基因序列分别为5’-TTCTCCGAACGTGTCACGT-3’(NC)、5’-AAGCCCGATGGCTCCCCAGTA-3’(sh-CD166-1)和5’-CCCGTGTCATGCACAATAT-3’(sh-CD166-2)。将RPMI-8226细胞以30%~50%融合度接种于6孔板中,更换无血清培养基并在37 ℃、5% CO2环境中继续孵育6 h。根据试剂盒说明书,将sh-CD166和NC与Lipofectamine 3000瞬时转染进细胞中。24~48 h后收集细胞进行鉴定并进行后续实验。
1.3.2 MTT实验:将稳定转染后的细胞以5×104/ml密度接种于96孔板上。随后,于接种后24、48、72 h在每孔中加入MTT溶液10 μl,在37 ℃下培养4 h。使用酶标仪检测450 nm处的光密度(OD)值。
1.3.3 平板克隆实验:将转染后的细胞以5×102/孔密度接种于6孔板中并在标准条件下连续培养2周,每周更换1次培养基。PBS清洗2次后,70%甲醇固定30 min。0.1%结晶紫在室温下染色30 min,拍照并在光学显微镜下计数菌落数(>50个细胞)。
1.3.4 细胞凋亡实验:上述转染后细胞继续孵育24 h,胰酶消化后获得单细胞悬液并用PBS多次清洗。使用Annexin-V和碘化丙啶避光孵育15 min,流式细胞仪分析细胞凋亡情况并使用FlowJo V10分析各组细胞凋亡率。凋亡率=早期凋亡率+晚期凋亡率。每组实验重复3次。
1.3.5 自噬实验:转染后细胞用96孔板继续培育24 h,将细胞分为NC组和sh-CD166组,根据实验手册推荐量加入LC3腺病毒孵育24 h后,共聚焦显微镜观察自噬小体水平并拍照。
1.3.6 皮下移植瘤模型:将BALB/c裸鼠随机分为NC组和sh-CD166组,每组5只。以1×107个/ml细胞密度将100 μl转染后细胞悬液(NC组和sh-CD166组)注射至小鼠背侧皮下。每3天检查肿瘤生长情况并测量大小,计算公式为:移植瘤体积(mm3)=1/2×肿瘤长径×肿瘤短径2。4周后,麻醉并处死小鼠。分离肿瘤组织,拍照并将其固定于多聚甲醛溶液中。
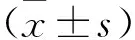
2 结 果
2.1 转染后三组细胞增殖能力及平板克隆能力比较 见表1。为了探讨CD166对MM细胞增殖的影响,我们转染靶向CD166的shRNA并构建CD166敲低细胞株。与NC组比较,sh-CD166-1和sh-CD166-2组细胞增殖能力和平板克隆能力下降(均P<0.05),但sh-CD166-1和sh-CD166-2组比较差异无统计学意义(均P>0.05)。

表1 转染后三组细胞增殖能力及平板克隆能力比较
2.2 转染后三组细胞凋亡情况比较 见图1。NC组、sh-CD166-1组以及sh-CD166-2组细胞凋亡率依次为(4.25±0.37)%、(17.18±0.96)%、(12.24±1.03)%。与NC组比较,sh-CD166-1和sh-CD166-2组细胞凋亡率升高(均P<0.05),但sh-CD166-1和sh-CD166-2组比较差异无统计学意义(均P>0.05)。
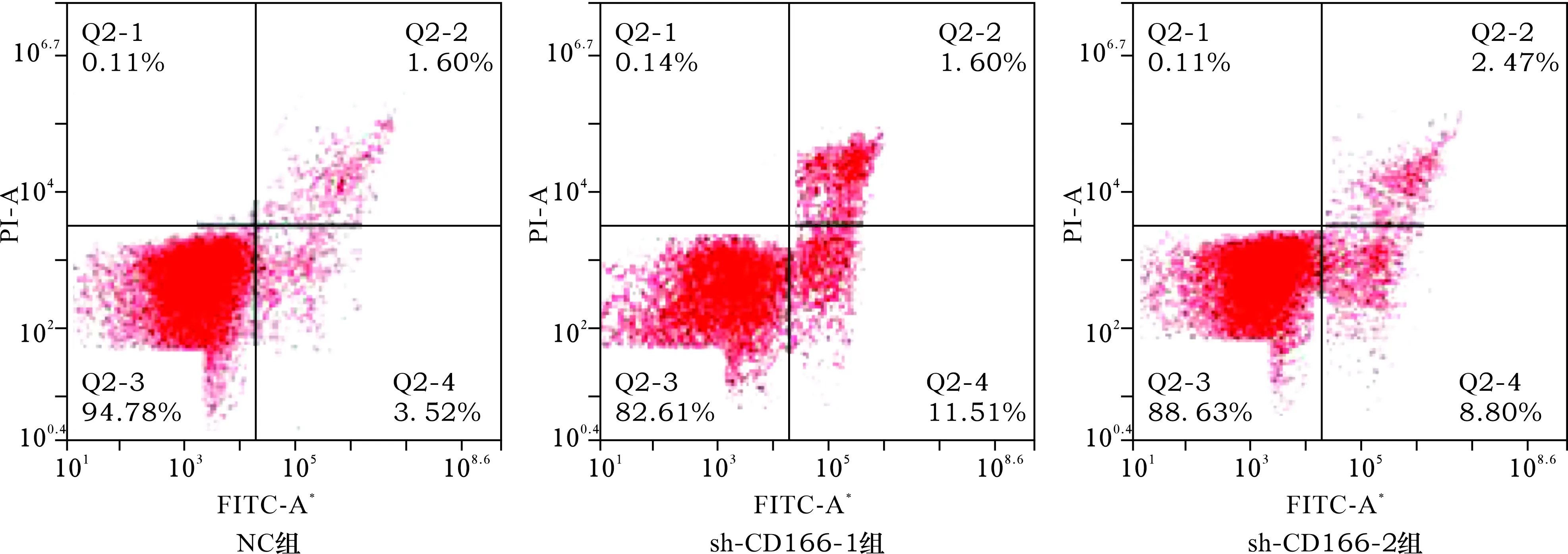
图1 转染后三组细胞凋亡情况流式细胞仪检测结果
2.3 转染后两组细胞自噬小体表达量比较 见图2。与NC组比较,sh-CD166组细胞中自噬小体表达量明显减少[(4.30±0.67)个与(0.19±0.02)个,P<0.05]。
图2 两组细胞自噬实验结果(荧光染色,×400)
2.4 两组裸鼠移植瘤体积比较 见图3。为了评估CD166对裸鼠体内肿瘤生长的影响,我们用NC及sh-CD166组细胞行裸鼠皮下成瘤实验。与NC组比较,sh-CD166组移植瘤体积明显减小[(0.37±0.08)g与(0.19±0.03)g,P<0.05]。

图3 两组裸鼠移植瘤实物标本
3 讨 论
MM是一种不可治愈和生物异质性的浆细胞疾病,伴有骨髓中单克隆浆细胞不受控制地生长,导致功能不完整的免疫球蛋白或免疫球蛋白链异常产生。同时,免疫球蛋白无限制积累以及异常单克隆浆细胞与骨髓中其他细胞不断相互作用引发一系列临床症状,包括贫血、骨骼病变、感染、高钙血症、肾衰竭、疲劳和疼痛等[12]。化疗联合类固醇治疗是新诊断患者的主要治疗方法。糖皮质激素、蛋白酶体抑制剂、免疫抑制剂以及干细胞移植等新型治疗手段已证明可以显著改善MM患者的临床预后[13-15],然而部分患者出现耐药,患者中位生存期约5年,严重威胁着广大患者的生命健康[16-17]。因此,迫切需要针对MM基因改变和分子生物学的异常表达寻找合适的分子靶点。
CD166位于人类3q13.1-q13.2染色体,由16个外显子组成。同时,CD166是一种细胞黏附分子,作为淋巴细胞CD6抗原的配体,广泛表达于各种组织,如神经元、成纤维细胞、内皮细胞、角质形成细胞等[17]。除细胞黏附之外,CD166还具有其他重要功能,如血管生成、单核细胞转运、白细胞通过血脑屏障内渗、T细胞激活、造血、神经轴突延伸、成骨等[18]。随着基础研究的深入,越来越多的证据表明CD166与肿瘤发生、进展和转移密切相关。多项研究[15,17-18]表明,CD166通过激活金属蛋白酶信号级联促进细胞-细胞和(或)细胞-基质相互作用,进而参与肿瘤细胞的侵袭过程。同时,CD166已成为一种肿瘤进展的介导者,主要调节细胞的增殖、黏附、迁移和侵袭[19]。超微结构研究表明,CD166与MUC18/MEL-CAM/CD146黑色素瘤细胞的表面的黏附分子存在27%的同源性,能够促进黑色素瘤进展并形成局部和远处转移。CD166的表达与前列腺癌的转移能力、胆管癌的侵入性以及乳腺癌凋亡的逃避有关[20]。然而,CD166在MM中的作用及其具体分子机制尚不清楚。
近年研究[21]发现,肿瘤的发生和发展可能是由于细胞信号传导异常激活、细胞异常增殖和肿瘤相关基因异常表达等原因导致。Kijima等[17]研究发现,CD166在胶质母细胞瘤中表达增高。在结直肠癌组织中,CD166+CSCs阳性表达率均高于癌旁正常组织[22]。Fujiwara等[23]探究CD166对胰腺癌细胞致瘤性和侵袭迁移活性的特征,通过免疫组化分析检测发现CD166在胰腺癌组织中表达,但在正常细胞中不表达。
肿瘤细胞异常增殖是肿瘤无法控制的主要原因。Kijima等[17]研究发现,将CD166小干扰RNA或小发夹RNA转染到胶质母细胞瘤中可促进细胞侵袭而不影响细胞增殖。此外,Fujiwara等[23]研究发现,CD166可以提高胰腺癌细胞克隆形成能力。本研究结果发现,干扰CD166表达可以抑制MM细胞增殖和克隆形成,说明CD166具有促进MM细胞增殖的作用。
细胞凋亡作为一种由基因控制自主的、有序的细胞死亡过程,在维持人体内环境稳态中发挥着重要作用。因此,激活或抑制细胞凋亡被认为是抗肿瘤或促肿瘤的策略。近年来,已有多个研究报道CD166对人肿瘤细胞凋亡具有诱导作用。例如,Jezierska等[9]探究CD166对乳腺癌细胞凋亡和自噬的影响,在乳腺癌细胞中CD166基因沉默后降低B淋巴细胞瘤-2浓度,凋亡率明显升高。Hansen等[20]研究发现,CD166翻译后修饰可以作为前列腺癌进展的标志且敲低CD166表达可促进前列腺癌细胞中促凋亡蛋白半胱天冬酶3表达。本研究发现,抑制CD166表达后,MM细胞凋亡率明显上升。
小鼠皮下移植瘤模型被广泛用于肿瘤微环境和药物疗效方面的研究。这种模型目的是为肿瘤生长提供合适的生存条件,以便于它们能够正常生长并与宿主建立类似于在供体观察到的相互作用。于是,我们利用裸鼠皮下成瘤模型对体外实验结果进行验证。Yan等[24]通过肿瘤球质膜蛋白组学鉴定CD166是否能够成为头颈部鳞状细胞癌中肿瘤干细胞的标记物,结果发现与鳞癌恶性生物学行为显著相关的是CD166表达情况,而非已经明确的鳞癌干细胞标记物CD44,且相较于CD166(低)头颈部鳞状细胞癌细胞,CD166(高)头颈部鳞状细胞癌细胞在体外具有更强的成球能力,在体内具有更强的成瘤能力。Fujiwara等[23]研究表明,在皮下和原位小鼠肿瘤模型中,CD166+胰腺癌细胞比CD166-胰腺癌细胞引起的肿瘤生长明显且体积更大。本研究结果表明,干扰CD166表达可以抑制MM细胞皮下成瘤。
综上所述,CD166能促进MM细胞 RPMI-8226增殖,抑制细胞凋亡,并促进皮下成瘤。

