大黄酚通过核因子E2相关因子2/血红素氧合酶-1信号通路对糖尿病足溃疡大鼠新生血管生成及氧化应激的影响
黎珊珊,区岛良,张 梅,谢桃梅
(儋州市人民医院内分泌科,海南 儋州 571700)
随着糖尿病病情的恶化,部分患者会出现糖尿病足溃疡,即足部出现较严重的感染、溃烂等现象,严重时可导致患者残疾,对患者的生活质量造成负面影响[1]。糖尿病足溃疡发病机制复杂且易反复发作,持续高血糖状态、周围神经病变、炎症反应及氧化应激等因素造成的血管损伤均可导致创面愈合失败[2]。核因子E2相关因子2/血红素氧合酶-1(Nuclear factor E2 related factor 2/heme oxygenase-1,Nrf2/HO-1)信号通路是调控机体抗氧化能力的重要通路,多项研究[3-4]表明该通路的激活对糖尿病相关疾病具有一定的保护作用。抑制Nrf2/HO-1信号通路可延缓血管生成,损害糖尿病足溃疡的伤口愈合[5]。大黄酚是从中药大黄中分离出的一种蒽醌类活性成分,可以缓解糖尿病的进展。据报道[6-7],大黄酚可以减轻糖尿病引起的心肌损伤及肾损伤。然而,大黄酚在糖尿病足溃疡中的作用尚不清楚。最近的研究[8]显示,生肌化瘀方可促进胶原蛋白再生和表皮修复,有效加速糖尿病溃疡创面愈合,而大黄酚是其治疗糖尿病溃疡的主要药效成分之一。此外,有报道[9]显示,大黄酚的抗氧化、抗炎等活性受Nrf2表达的调节,大黄酚可通过激活Nrf2减轻氧化损伤和炎症反应,改善高脂肪饮食引起的糖尿病小鼠心脏损伤。因此,本研究基于Nrf2/HO-1信号通路探究大黄酚对糖尿病足溃疡大鼠新生血管生成及氧化应激的影响。
1 材料与方法
1.1 实验动物 SD雄性大鼠(武汉贝赛模式生物科技有限公司),SPF级,9~10周龄,体重339~358 g,生产许可证号为SCXK(鄂)2022-0009。所有大鼠饲养于25 ℃左右的动物房中,自由饮食及饮水,按时清洁鼠笼及饮水瓶。本研究经医院伦理委员会批准同意。
1.2 主要试剂 大黄酚(纯度≥98.96%,批号:B20238)购自上海源叶生物科技有限公司;链脲佐菌素(STZ)、Nrf2抑制剂ML385、丙二醛(MDA)、超氧化物歧化酶(SOD)试剂盒、蛋白提取试剂盒(批号:S10589、S02985、S18490、S28594、S21419)购自广西隆华生物技术股份有限公司;血管内皮生长因子(VEGF)、肿瘤坏死因子-α(TNF-α)、碱性成纤维细胞生长因子(bFGF)、血管性血友病因子(vWF)酶联免疫吸附(ELISA)试剂盒、HE染色试剂盒、BCA试剂盒(批号:XQ21055、XQ18544、XQ11590、XQ10499、XQ26770、XQ47889)购自湖北逸挚诚生物科技公司;兔源Nrf2、HO-1、GAPDH一抗、羊抗兔二抗(批号:JY18444、JY02859、JY29115、JY14495)购自长春西诺生物科技有限公司。
1.3 实验方法
1.3.1 动物模型制备及分组给药:参照文献[10]构建糖尿病足溃疡大鼠模型,SD大鼠用高糖高脂饲料喂养28 d,禁食不禁水12 h后一次性腹腔注射STZ(65 mg/kg)。在注射STZ第7天,大鼠空腹血糖(FBG)≥16.7 mmol/L表示糖尿病大鼠模型构建成功,成功造模48只。随即麻醉所有大鼠,除去大鼠后侧两足背部毛发,消毒后用钕铁硼磁铁做直径为0.5 cm的圆形全层皮肤组织缺失,观察到大鼠足部伤口有少量渗血及明显渗出液,呈现暗红色表明糖尿病足溃疡大鼠模型构建成功。将造模成功的48只大鼠随机分为模型组、大黄酚组、ML385组、大黄酚+ML385组,每组12只。另取12只大鼠作为对照组,喂养普通饲料28 d,禁食不禁水12 h后用等量0.9%氯化钠溶液代替STZ进行腹腔注射,注射后第7天用上述方法构建直径0.5 cm的圆形全层皮肤组织缺失。建模完成后,大黄酚组大鼠给予30 mg/kg大黄酚[11]灌胃给药(将大黄酚和0.9%氯化钠溶液混溶成浓度为3 mg/ml的混悬液,灌胃体积10 ml/kg),同时腹腔注射0.9%氯化钠溶液10 ml/kg;ML385组大鼠给予30 mg/kg ML385[12]腹腔注射给药(将ML385和0.9%氯化钠溶液混溶成浓度为3 mg/ml的溶液,注射体积10 ml/kg),同时灌胃0.9%氯化钠溶液10 ml/kg;大黄酚+ML385组大鼠灌胃30 mg/kg大黄酚和腹腔注射30 mg/kg ML385;对照组和模型组大鼠给予等体积0.9%氯化钠溶液(灌胃和腹腔注射)。各组给药1次/d,连续4周。在给药期间所有大鼠均以原来的饲养方式喂养。
1.3.2 创面愈合率检测:末次给药结束后24 h,在大鼠创面处贴网格透明膜,采用扫描仪进行扫描,用Adobe Photoshop CS6软件计算创面面积。创面愈合率=[1-(末次给药结束后24 h创面面积/造模结束后创面面积)]×100%。
1.3.3 新生血管生成相关指标测定及创面组织病理学观察:大鼠腹主动脉取血(约4 ml),4 ℃条件下以5700 r/min离心15 min,取血清,用VEGF、TNF-α ELISA试剂盒测定血清中VEGF、TNF-α水平。采集各组大鼠右后足创面组织,取部分研磨匀浆,4 ℃下以9700 r/min离心14 min,取上清,通过bFGF、vWF ELISA试剂盒测定上清液中bFGF、vWF水平。另一部分创面组织固定于4%多聚甲醛溶液,石蜡包埋,切片(4 μm),HE染色,显微镜观察。
1.3.4 创面组织氧化应激相关指标检测:采集各组大鼠左后足创面组织,分为两部分。一部分置于-80 ℃环境中保存。另一部分使用0.9%氯化钠溶液制成组织匀浆,4 ℃下9700 r/min离心10 min,取上清,根据MDA、SOD试剂盒的要求,测定上清液中MDA、SOD水平。
1.3.5 创面组织Nrf2/HO-1通路蛋白表达检测:取1.3.4中剩余大鼠创面组织,匀浆后提取其中总蛋白质。定量蛋白浓度后,经加热变性,取同质量的各组待测蛋白进行电泳分离实验,将蛋白进行转膜、封闭处理,加入稀释比为1∶1200的兔源Nrf2、HO-1、GAPDH一抗,4 ℃环境中孵育过夜。用TBST洗涤后加入稀释比为1∶2100的羊抗兔二抗溶液,室温孵育2 h,经过显色后置于凝胶成像仪中拍照,Image J软件分析条带灰度值并计算Nrf2、HO-1蛋白表达(以GAPDH 为内参)。
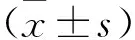
2 结 果
2.1 各组大鼠创面愈合率比较 见表1。与对照组比较,模型组创面愈合率降低(P<0.05)。与模型组比较,大黄酚组创面愈合率升高,ML385组大鼠创面愈合率降低(均P<0.05)。与大黄酚组比较,大黄酚+ML385组创面愈合率降低(P<0.05)。与ML385组比较,大黄酚+ML385组大鼠创面愈合率升高(P<0.05)。

表1 各组大鼠创面愈合率比较(%)
2.2 各组大鼠创面组织病理形态比较 见图1。对照组大鼠创面组织中炎性细胞较少,成纤维细胞较多,可见丰富的毛细血管。与对照组比较,模型组大鼠创面组织中可见大量炎性细胞,新生毛细血管分布较少。与模型组比较,大黄酚组大鼠创面组织中新生毛细血管显著增多,炎性细胞显著减少;ML385组大鼠创面组织中新生毛细血管显著减少,炎性细胞显著增多。与大黄酚组比较,大黄酚+ML385组大鼠创面组织中新生毛细血管显著减少。与ML385组比较,大黄酚+ML385组大鼠创面组织中新生毛细血管显著增多。
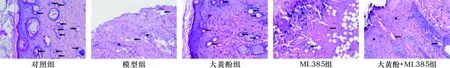
注:箭头指向为毛细血管,星号为炎性细胞
2.3 各组大鼠血清VEGF、TNF-α及创面组织bFGF、vWF水平比较 见表2。与对照组比较,模型组血清VEGF及创面组织bFGF、vWF水平降低,血清TNF-α水平升高(均P<0.05)。与模型组比较,大黄酚组血清VEGF及创面组织bFGF、vWF水平升高,血清TNF-α水平降低(均P<0.05);ML385组血清VEGF及创面组织bFGF、vWF水平降低,血清TNF-α水平升高(均P<0.05)。与大黄酚组比较,大黄酚+ML385组血清VEGF及创面组织bFGF、vWF水平降低,血清TNF-α水平升高(均P<0.05)。与ML385组比较,大黄酚+ML385组血清VEGF及创面组织bFGF、vWF水平升高,血清TNF-α水平降低(均P<0.05)。

表2 各组大鼠血清VEGF、TNF-α及创面组织bFGF、vWF水平比较
2.4 各组大鼠创面组织MDA、SOD水平比较 见表3。与对照组比较,模型组创面组织MDA水平升高,SOD水平降低(均P<0.05)。与模型组比较,大黄酚组创面组织MDA水平降低,SOD水平升高(均P<0.05);ML385组创面组织MDA水平升高,SOD水平降低(均P<0.05)。与大黄酚组比较,大黄酚+ML385组创面组织MDA水平升高,SOD水平降低(均P<0.05)。与ML385组比较,大黄酚+ML385组MDA水平降低,SOD水平升高(均P<0.05)。

表3 各组大鼠创面组织MDA、SOD水平比较
2.5 各组大鼠创面组织Nrf2、HO-1蛋白表达比较 见表4。与对照组比较,模型组创面组织Nrf2、HO-1蛋白表达降低(均P<0.05)。与模型组比较,大黄酚组创面组织Nrf2、HO-1蛋白表达升高,ML385组创面组织Nrf2、HO-1蛋白表达降低(均P<0.05)。与大黄酚组比较,大黄酚+ML385组创面组织Nrf2、HO-1蛋白表达降低(均P<0.05)。与ML385组比较,大黄酚+ML385组创面组织Nrf2、HO-1蛋白表达升高(均P<0.05)。

表4 各组大鼠创面组织Nrf2、HO-1蛋白表达比较
3 讨 论
研究[13]显示,高达20%的糖尿病患者发生伤口愈合反应受损,其中最常见的是糖尿病足溃疡。糖尿病通过影响多种生物学机制导致伤口愈合困难,常见的原因有持续高血糖状态、慢性炎症、微循环障碍、氧化应激反应、神经肽信号受损等,糖尿病创伤的复杂环境常导致糖尿病足溃疡治疗困难,且截肢率较高,由成纤维细胞及新生毛细血管构成的肉芽组织在溃疡创面愈合过程中发挥重要作用[14-15]。因此,了解糖尿病足溃疡病因,探究促进血管新生作用的药物对于糖尿病足溃疡的治疗具有重要意义。
在创面修复过程中,bFGF能促进胶原纤维及成纤维细胞的合成,VEGF是促血管生成因子[16],vWF是血管内皮损伤标志物,可促进新生血管的生成[17]。STZ具有毒性小、成模稳定且速度快等优点,是诱导糖尿病大鼠模型常用的方法。本研究通过此方法构建糖尿病大鼠模型,采用钕铁硼磁铁做直径为0.5 cm的圆形足部全层皮肤组织缺失构建糖尿病足溃疡大鼠模型。结果显示,与对照组比较,模型组大鼠创面组织中可见大量炎性细胞,新生毛细血管分布较少,创面愈合率、血清VEGF以及创面组织bFGF、vWF、SOD水平降低,血清TNF-α及创面组织MDA水平升高,表明糖尿病足溃疡大鼠新生血管生成缓慢,同时伴随炎症反应和氧化应激。给予大黄酚干预后,模型大鼠新生毛细血管增多,炎性细胞减少,创面愈合率、血清VEGF以及创面组织bFGF、vWF、SOD水平均升高,血清TNF-α及创面组织MDA水平降低,表明大黄酚具有促进糖尿病足溃疡大鼠新生血管生成以及抑制炎症反应和氧化应激的作用。
研究[18]显示糖尿病患者持续高血糖、慢性炎症反应、氧化应激增加均与病情恶化密切相关。Nrf2可使细胞免受氧化应激损伤并促进HO-1等抗氧化蛋白的表达,该通路的激活时具有抑制机体炎症反应、清除自由基、提高抗氧化能力等作用[19]。研究[5,20]表明Nrf2/HO-1通路与糖尿病肾病、糖尿病足溃疡等疾病联系密切,激活Nrf2/HO-1通路可减轻氧化应激及机体TNF-α等炎症因子的释放,减轻糖尿病肾病大鼠的肾脏损伤,并可促进血管生成,减轻糖尿病足溃疡。本研究中,大黄酚组创面组织Nrf2、HO-1蛋白表达较模型组升高;而大黄酚+ML385组大鼠创面组织Nrf2、HO-1蛋白表达较大黄酚组降低,较ML385组升高。提示大黄酚对糖尿病足溃疡大鼠创面组织新生血管生成的促进作用以及对炎症反应和氧化应激的抑制作用可能是通过Nrf2/HO-1信号通路的激活进行的。
综上所述,大黄酚能促进糖尿病足溃疡大鼠新生血管的生成,抑制炎症反应和氧化应激,其机制可能与激活Nrf2/HO-1信号通路有关。但糖尿病足溃疡发病机制复杂,本研究只是初步探究其可能机制,关于大黄酚是否通过其他途径发挥作用尚不清晰,仍需进一步探究。

