3.0T磁共振扩散加权成像结合超声造影对肝脏良恶性病变的诊断价值
刘洋洋 杨星星 葛舒
目前临床采用穿刺活检作为诊断肝脏占位性病变良恶性的金标准,但穿刺活检会提高良性病灶的出血率,临床应用受限[1,2]。常规超声能够获得病灶内部血流、形态等信息,但容易受到组织运动的影响,且无法识别深部病变,存在较大的局限性[3]。超声造影通过静脉注射造影剂来增强肝脏内的血流信号,实时观察肝脏占位性病变患者的血流动态信息,从而增加肝脏良恶性病变的检出率,但对于肝脏小结节的鉴别度较低[4]。3.0T磁共振扩散加权成像(MRI-DWI)可清晰展示病灶的数量、位置等,对软组织分辨率较高,在鉴别卵巢良恶性肿瘤、肝脏占位性病变等方面具有重要作用[5,6]。本研究回顾性分析69例肝脏占位性病变患者,期望为提高肝脏良恶性病变的诊断价值提供参考。
资料与方法
一、一般资料
回顾性分析2020年2月至2022年7月就诊的69例肝脏占位性病变患者的临床资料,年龄(48.2±8.4)岁;女28例,男41例。纳入标准:①均诊断为肝脏占位性病变;②临床资料完整;③年龄≥20岁。排除标准:①对造影剂过敏;②伴有严重的肺部疾病;③心肾功能严重障碍;④造血功能不全;⑤哺乳期或妊娠期女性;⑥合并其他类型恶性肿瘤。该研究经院内医学伦理委员会批准。
二、研究方法
(一)3.0TMRI-DWI检查 采用Philips Ingenia 3.0T全数字磁共振仪,体部相控阵线圈。检查前患者禁水禁食4 h,检查时患者呼气末屏住气。实施DWI、脂肪抑制剂T2WI、轴位同反相位T1WI、T2WI。T2WI使用TSE序列,DWI接受SENSE技术EPI序列,轴位同反相位T1WI接受TFE-IP序列,脂肪抑制序列T2WI接受TSE序列。把图像分析层面置于病灶最大直径处,测量表观弥散系数(ADC),通过扩散成像软件分析数据。测量感兴趣覆盖的全部病灶的ADC值,测量3次,结果取平均值,尽可能避开坏死区与囊变区。
(二)超声造影检查 采用彩色多普勒超声诊断仪。所有患者先采用常规超声检查,统计记录病灶位置、回声等,随后选取病灶的最佳切面,接着将反向脉冲谐波显像技术打开,机械指数调整为0.08,经肘静脉注射造影剂SonoVue,同时将超声仪内置计时器打开,随后实时不间断观察病灶动态灌注过程及病灶回声强度变化5~7 min,造影结束后,回放分析图像,观察肝脏占位性病变患者超声造影时各时相灌注增强方式,采用声学定量TIC分析软件分析数据,时相可分为动脉相(0~30 s)、门脉相(31~120 s)及延迟相(121~360 s)。统计始消时间、达峰时间、峰值高度及始增时间。
(三)诊断标准 3.0TMRI-DWI检查诊断标准:DWI表现为高信号即可诊断为肝脏恶性病变,否则为肝脏良性病变[7]。超声造影诊断标准:超声回声等于或高于周围肝组织,门脉相、延迟相、动脉相无增强或高增强可诊断为肝脏良性病变,否则为肝脏恶性病变[8]。二者联合诊断时,当3.0TMRI-DWI检查或超声造影诊断为肝脏良性病变时即为肝脏良性病变。3.0TMRI-DWI及病理诊断结果间的一致性,一致性好:Kappa值>0.75;一致性一般:0.4≤Kappa值≤0.75;一致性差:Kappa值<0.4。
三、统计学方法
结 果
一、病理诊断情况
病理诊断结果显示,69例肝脏占位性病变患者中肝脏良性病变38例(55.07%,共有47个病灶),其中肝囊肿15例(21.74%),肝血管瘤23例(33.33%);肝脏恶性病变31例(44.93%,共有病灶38个),其中原发性肝细胞癌21例(30.43%),肝转移瘤10例(14.49%)。
二、肝脏良、恶性病变患者3.0TMRI-DWI与超声造影特征
3.0TMRI-DWI检查:当b为800 s/mm2时,肝转移瘤、原发性肝细胞瘤在各ADC图上呈等低或混杂信号,DWI呈高信号;肝血管瘤在各ADC图上呈等或高信号,DWI呈稍高信号;肝囊肿呈低或等信号。超声造影检查:肝转移瘤病灶均为动脉相高增强,门脉相及延迟相低增强,动脉相高增强;原发性肝细胞癌病灶均为延迟相与门静脉相肿瘤组织的强化呈低增强,相比于周围正常肝组织,动脉期肝组织呈更高的强化;肝血管瘤所有病灶延迟相呈低增强,动脉相呈高增强;肝囊肿所有病灶延迟相、门脉相、动脉相均呈高增强。
三、肝脏良、恶性病变患者ADC值比较
肝脏恶性病变患者ADC值为(1.17±0.18)×10-3/mm2/s,低于肝脏良性病变患者(3.29±0.35)×10-3/mm2/s(t=30.561,P<0.01)。
四、肝脏恶性病灶与良性病灶超声造影参数比较
肝脏恶性病灶峰值强度比肝脏良性病灶高(P<0.05),而病灶始消时间、始增时间及达峰时间均比肝脏良性病灶短(P<0.05)。见表1。
表1 肝脏恶性病灶与肝脏良性病灶的超声造影参数比较(±s)
五、3.0TMRI-DWI、超声造影及二者联合检查诊断肝脏良恶性病变的效能
超声造影、3.0TMRI-DWI及二者联合检查诊断肝脏良恶性病变的准确率分别为68.12%(47/69)、82.61%(57/69)、94.20%(65/69),3.0TMRI-DWI检查、超声造影检查及二者联合检查诊断肝脏良恶性病变的灵敏度分别为88.87%、70.97%、93.55%、特异度分别为81.57%、65.79%、94.74%,诊断肝脏良恶性病变与病理诊断的Kappa值分别为0.851、0.727、0.873,具有较好的一致性(P<0.05)。见表2。
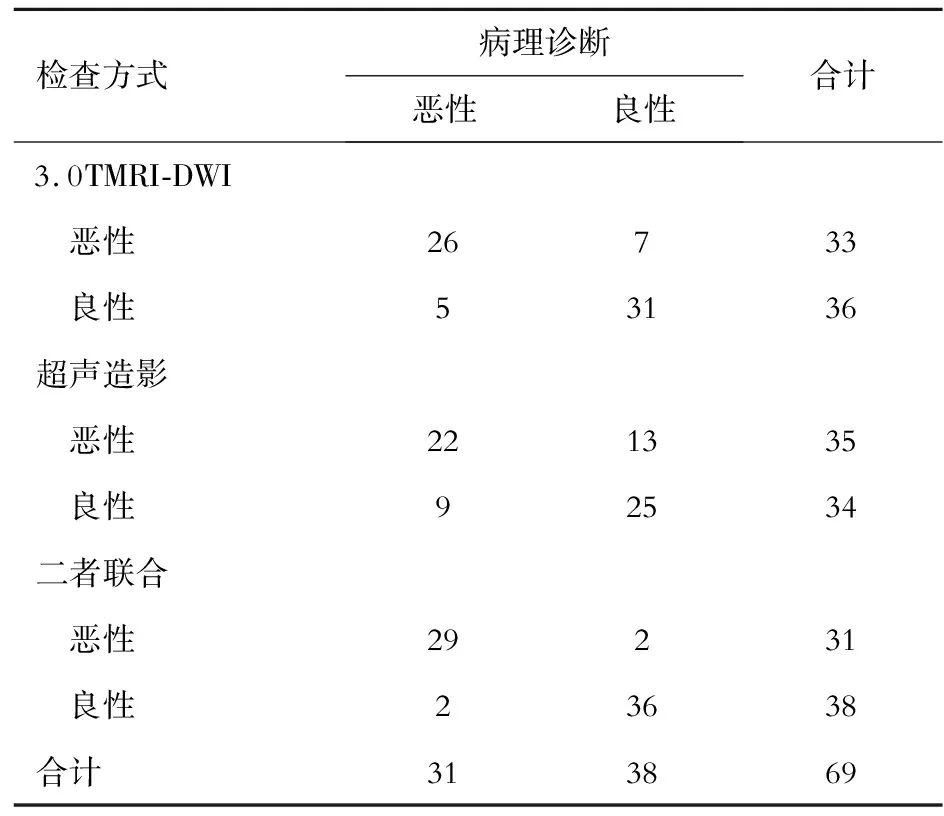
表2 3.0TMRI-DWI、超声造影及二者联合检查对肝脏良恶性病变的诊断效果
讨 论
研究表明,超声造影诊断直径≤2 cm肝内恶性病灶时,影像学特征并不典型,对于原发性肝细胞癌来说,病灶供血来源于肝动脉,超声造影理论情况下在延迟期与门脉期表现为低增强回声,在动脉期表现为增强回声,而在实际检查时,病情进展、病灶发展不同,不同直径的恶性病灶不完全典型现象不一[9-11]。本研究中,肝脏恶性病灶峰值强度比肝脏良性病灶高,肝脏恶性病灶始消时间、始增时间及达峰时间均比肝脏良性病灶短,与既往研究报道相符。肝脏恶性病灶峰值强度比良性病灶高的原因可能是由于在病变处恶性细胞的活跃度较高,导致病变处的损伤程度更严重,并产生更多的新血管和血流,相比之下,良性病变部位的代谢活跃度相对较低,因此不会影响血流动力学。而肝脏恶性病灶始消时间、始增时间及达峰时间比良性病灶短的原因在于恶性病灶的生长速度更快,所以造成了灶内局部微循环的改变,在灶周的毛细血管网格内形成了新的血管,这些血管数量多而分布密集,因此恶性病灶周围的血流增加,造成了更快的生长速度。此外,恶性病灶里面的血管结构也更加不规则,造成了更加复杂的灌注模式,这也是其始消时间、始增时间及达峰时间比良性病灶短的原因之一。DWI联合3.0高分辨率MRI平扫能提高直肠癌的诊断价值,与病理诊断结果具有良好的一致性,能够为临床合适的手术提供更为可靠的影像学依据[12]。常规MRI能够准确判断恶性肿瘤浸润深度与肿瘤体积,但对小体积的病灶漏诊率较高[13]。MRI-DWI从分子水平检查与含水量改变相关的疾病,可提供除形态学外的功能参数[14]。有研究采用3.0TMRI-DWI诊断肝脏良恶性病变,结果良性病灶ADC值均较高,DWI呈低、等或高信号,恶性病灶DWI呈高信号,ADC值较低,与本研究结果类似,3.0TMRI-DWI检查还可增加诊断微小肝癌病灶的准确率[15-17]。本研究提示3.0TMRI-DWI检查、超声造影检查及二者联合检查在诊断肝脏良恶性病变中,均具有良好的诊断准确性,且与病理诊断具有较好的一致性,再次印证二者联合检查的诊断效能更高。3.0TMRI-DWI检查对水分子的扩散情况进行了清晰的展示,可以更好地发现肝脏组织中的病理变化,尤其是灶周炎性反应、肿瘤与正常肝组织的边界和灶内异型细胞等病理改变。同时,MRI-DWI检查具有无创、多次重复检查可比较性好等优点。超声造影检查可以评估血流动力学变化,对动脉和门静脉阻塞的鉴别具有重要意义。此外,超声检查是一种非常安全的检查方式,不需要使用任何放射性物质,适用于某些特殊人群。
综上所述,联合3.0TMRI-DWI检查和超声造影检查,可以充分利用两种检查方法的优点,提高肝脏病变的诊断准确度,特别是在定性和定量方面。二者联合检查可以相互补充,提高对肝脏良恶性病变的精确判定。因此,在临床实践中,选择合适的检查方式可以更好地提高诊断准确性。
利益冲突声明:所有作者均声明不存在利益冲突。